南方水稻黑条矮缩病毒P7-2基因的克隆与原核表达
胡昱颛,王全兴,张金艺,宋水林,蒋军喜,2,熊桂红,2*
南方水稻黑条矮缩病毒基因的克隆与原核表达
胡昱颛1,王全兴1,张金艺1,宋水林1,蒋军喜1,2,熊桂红1,2*
(1. 江西农业大学 农学院,江西 南昌 330045;2. 江西农业大学 江西省薯芋生物学重点实验室,江西 南昌 330045)
【目的】为克隆获得南方水稻黑条矮缩病毒(,SRBSDV)的基因并实现其原核表达。【方法】利用RT-PCR技术从感染SRBSDV的水稻叶片中扩增出基因。利用Gateway重组技术将基因整合到原核表达载体pDEST17上,获得重组原核表达载体pDEST17-。随后将原核表达载体pDEST17-转化到原核表达菌株中。利用IPTG诱导P7-2蛋白表达并优化其诱导条件。【结果】利用RT-PCR技术扩增得到基因,其大小为930 bp。测序结果表明获得原核表达载体pDEST17-。菌液PCR鉴定了原核表达阳性菌株。在温度为28 ℃、IPTG浓度为0.1 mmol/L诱导表达8 h,可获得大量大小约为42 kDa含HIS标签的融合蛋白。【结论】克隆获得了SRBSDV的基因序列,实现了该基因的原核表达并探索其最佳诱导条件,为南方水稻黑条矮缩病的田间诊断、预测预报及的功能研究奠定了基础。
南方水稻黑条矮缩病毒(SRBSDV);RT-PCR;基因;原核表达
【研究意义】近年在我国南方稻区大面积发生的南方水稻黑条矮缩病是由南方水稻黑条矮缩病毒(,SRBSDV)引起的,是影响水稻生产的重要病害之一[1]。由于南方水稻黑条矮缩病发生后缺乏直接高效的防控方法,因此预测预报在该病的防治中显得尤为重要。而该病害预测预报的关键在于传毒介体带毒率和水稻植株发病率的检测。SRBSDV基因组包含10条dsRNA,共编码13个蛋白[1-3]。其中P7-2的功能未知。因此克隆SRBSDV基因并进行原核表达,可为南方水稻黑条矮缩病的诊断及P7-2功能的研究奠定基础。【前人研究进展】SRBSDV是斐济病毒属()的成员[1-3]。该病害广泛分布在东亚稻区的大部分国家[4]。在中国,SRBSDV的分布与爆发主要集中在南部稻区,包括江西等地[5-6]。SRBSDV田间主要的传毒介体为迁飞性昆虫白背飞虱[7-10],以持久性增殖型方式进行传毒[11-12]。该病毒除感染水稻、玉米、高粱等粮食作物外,还可以侵染牛筋草、稗草等多种禾本科杂草[7,13]。南方水稻黑条矮缩病的主要初侵染源是春季迁入的带毒白背飞虱,再由带毒白背飞虱传入稻田为害水稻,因此白背飞虱的带毒率及水稻的发病率是预测南方水稻黑条矮缩病发生程度的重要依据[14]。水稻病毒病的检测方法主要有RT-PCR[15-16]、血清学技术和核酸分子杂交等,其中较常用的方法是血清学技术[17]。如张玉阳等[18]利用大豆症青相关病毒的外壳蛋白制备多克隆抗体用于大豆症青的快速检测。林丽明等[19]利用水稻草状矮化病毒A蛋白酶联免疫吸附反应检测并比较了水稻不同品种、不同部位和不同发病时期的RGSV含量。Gao等[20]利用DAS-ELISA和Dot-ELISA检测植物中的番茄斑萎病毒。Sum等[21]利用间接ELISA和点印迹的方法检测水稻东格鲁病(RTD),该方法具有高灵敏度和特异性,可用于田间现场检测。【本研究切入点】以SRBSDV基因为主要研究对象,通过RT-PCR技术获取基因片段;利用Gateway重组技术将基因整合到原核表达载体pDEST17上,经IPTG诱导后获取该基因的原核表达蛋白。【拟解决的关键问题】获取完整的基因序列,并实现该基因在原核生物中的表达,为SRBSDV的田间检测与P7-2的功能研究奠定基础。
1 材料和方法
1.1 试验材料
感病水稻采自江西南昌。大肠杆菌DH5α、表达菌株入门载体pDONR221以及原核表达载体pDEST17均为本实验室保存;Gateway BP Clonase Enzyme Mix、LR Clonase Enzyme Mix购自Invitrogen;植物总RNA提取试剂盒、RNA反转录试剂盒购自天根生化科技(北京)有限公司;质粒提取试剂盒、2×PCR SuperMix购自北京全式金生物技术股份有限公司;植物总蛋白提取试剂盒购自生物工程(上海)股份有限工公司。
1.2 方法
1.2.1 SRBSDV基因的克隆 根据已发表的SRBSDV的基因序列(登录号:HM585273.1)设计引物,并加入Gateway重组序列,正向引物P7-2F:GGGGACAAGTTTGTACAAAAAAGCA GGCTTCATGAATTACAACGATGCCAATG,反向引物P7-2R:GGGGACCACTTTGTACAAGAAAGCTGGG TCTTACAAATTCAGAATGTTTTTCAAC。提取南方水稻黑条矮缩病病叶的总RNA,反转录合成cDNA;利用特异性引物P7-2F/P7-2R进行PCR扩增。PCR反应体系:cDNA 2 µL、P7-2F/P7-2R各2 µL(10 µmol/L)、2×SuperMix 25 µL、ddH2O 19 µL。PCR反应条件:94 ℃预变性2 min;94 ℃ 30 s,56 ℃ 30 s,72 ℃ 30 s,35个循环;72 ℃延伸5 min。所得产物电泳后回收纯化。
1.2.2 原核表达载体的构建 将回收纯化的目的条带与入门载体pDONR221在25 ℃条件下进行BP重组反应2 h,BP反应体系为:PCR产物1.2 µL,pDONR221载体0.4 µL,BP酶0.4 µL。将连接产物转化到大肠杆菌DH5a中并将其涂布在LB固体培养基(含卡那霉素,Kan,50 µg/mL)上,37 ℃培养12 h。挑取单菌落至LB液体培养基(含Kan)中震荡培养4 h。取2 µL菌液进行PCR鉴定,PCR反应条件同1.2.1。将PCR鉴定为阳性的菌液进行测序。扩大培养阳性菌液并提取质粒。用限制性核酸内切酶37 ℃下酶切阳性质粒30 min后进行琼脂糖凝胶电泳,并回收纯化其中分子量较大的DNA片段。将回收纯化的DNA与原核表达载体pDEST17在25 ℃下进行LR重组反应2 h,LR反应体系为:酶切产物1.2 µL,pDEST17载体0.4 µL,LR酶0.4 µL。将连接产物转化大肠杆菌DH5α;利用PCR鉴定阳性克隆,方法同上。提取质粒,即获得基因的原核表达载体pDEST17-。
1.2.3 SRBSDV的原核表达 用热激发将pDEST17-P7-2质粒转化到菌株中。复苏后将其涂布在含氨苄青霉素(AMP,100 µg/mL)与氯霉素(Chl,35 µg/mL)的LB固体培养基上,37 ℃恒温培养10 h。挑取若干单菌落震荡培养4 h,利用菌液PCR鉴定阳性菌株,方法同1.2.1。将阳性菌株接种于LB液体培养基(含AMP和Chl),37 ℃震荡培养12 h。以体积1﹕100的比例将阳性菌液进行扩大培养,当OD600达到0.4~0.6时加入IPTG(终浓度为0.1 mmol/L),温度调至28 ℃,继续培养。阴性对照为未诱导的阳性菌液及诱导的含pDEST17空载体的菌液。诱导培养8 h后离心收集菌体;加入100 µL无菌水重悬,随后加入100 µL 2×SDS凝胶上样缓冲液,100 ℃水浴5 min,离心后取15 µL上清进行12.5% SDS-PAGE电泳分析。
2 结果与分析
2.1 SRBSDV P7-2基因的克隆
提取南方水稻黑条矮缩病病叶总RNA,反转录合成cDNA。以cDNA为模板进行PCR扩增,获得的产物进行琼脂糖凝胶电泳。扩增到一条大小约为1 000 bp的条带,与目的条带大小一致(930 bp)(图1)。
2.2 SRBSDV P7-2原核表达载体的构建
回收纯化PCR产物,并通过BP连接酶将其构建到pDONR221载体中。测序结果表明成功获得pDONR221-重组子。利用进行酶切,得到两条DNA条带,其中分子量较大的片段为目标片段(图2)。

M为DNA Marker;1为SRBSDV P7-2基因。

M为DNA Marker;1为pDNOR221-P7-2酶切鉴定。
回收纯化目标片段。利用LR连接酶将其构建到pDEST17载体上。结果如图3所示,菌液PCR扩增出与预期大小一致的条带,表明重组质粒pDEST17-构建成功。
2.3 P7-2蛋白的原核表达分析
将含pDEST17-的质粒转化到菌株中。挑取阳性菌落于LB液体培养基(含AMP和Chl)中震荡培养,经IPTG诱导后进行SDS-PAGE电泳。结果如图4所示,成功诱导表达一条大小为42 kDa左右的蛋白,与预期大小一致,表明成功表达SRBSDV P7-2蛋白。

M为DNA Marker;1-6为pDEST17-P7-2 PCR鉴定。
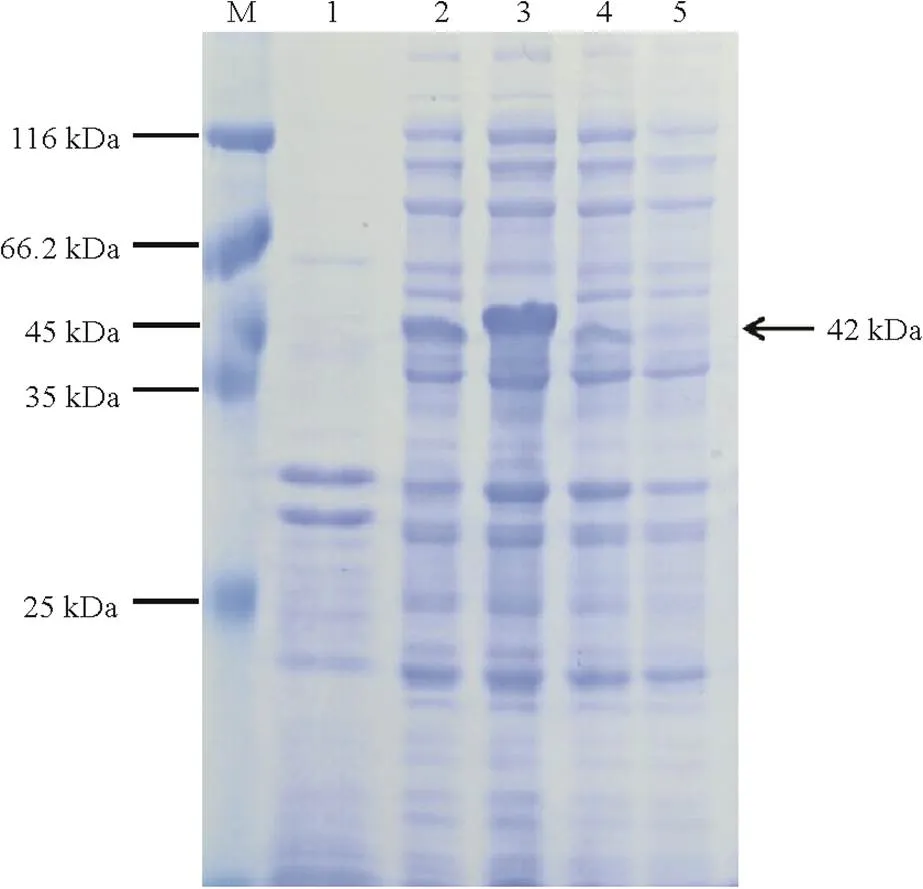
M为蛋白Marker;1为未加IPTG诱导的含pDEST17-P7-2的宿主菌;2-3为加IPTG诱导的含pDEST17-P7-2宿主菌;4-5为加IPTG诱导的含pDEST17空载体的宿主菌。
3 结论与讨论
南方水稻黑条矮缩病是影响我国水稻生产的严重病害之一[1]。水稻各个生育期都能感病,发病后,水稻植株矮缩、叶片深绿、叶尖卷曲,稻秆上会形成乳白色瘤状突起,高位分蘖以及倒生须根等典型症状,发病严重的植物不能正常抽穗,产量损失30%~50%[7,22-23]。2001年在广东阳江市首次发现南方水稻黑条矮缩病[1,7]。2009年该病害在我国南方多地晚稻上爆发,受害面积达30多万hm2[22];2010年南方水稻黑条矮缩病扩散至我国南部13个省区,包括江西、湖南、安徽等地,中晚稻受害总面积增至120多万hm2[22];近年南方水稻黑体矮缩病持续危害水稻生产,2020年被收录于我国一类农作物病虫害名录[23]。因此亟需南方水稻黑条矮缩病的科学防控措施。由于缺乏抗性水稻品种及高效的防治药剂,该病害至今尚未得到有效控制。
SRBSDV的传播介体是迁飞性害虫白背飞虱[4]。SRBSDV的主要初侵染源是春季带毒迁入的白背飞虱,再传播到中、晚稻或者田间杂草上,由此造成严重为害[4,22]。由于白背飞虱高效传毒特点以及广泛的取食范围,白背飞虱一旦带毒就可能造成水稻大面积发病[4,13]。因此对田间水稻植株发病率和白背飞虱带毒率的监测可为防治SRBSDV提供有效的依据。可靠的病原检测与鉴定是病毒病防治的基础。因此本论文拟扩增SRBSDV基因,构建其原核表达载体并表达蛋白,为SRBSDV抗血清的制备及病毒检测奠定基础。
目前SRBSDV编码的多个蛋白的功能已被验证。例如P5-1形成丝状包涵体,可能在病毒粒子的形成中具有重要作用[24];S6是病毒的一个沉默抑制子[25];S7-1编码小管蛋白,形成管状结构,参与病毒在细胞与细胞间的扩散[26];P9-1形成病毒基质[27]。但是P7-2的功能未知,因此通过体外诱导表达P7-2蛋白,可为P7-2的功能研究做准备。本研究利用原核表达载体pDEST17诱导表达了大量的带HIS标签的P7-2的融合蛋白,但该蛋白为无活性的沉淀蛋白。还需通过调整诱导温度、诱导时间及IPTG的浓度等获得可溶性蛋白。
本论文通过RT-PCR的方法从感染南方水稻黑条矮缩病毒的水稻叶片中扩增得到了SRBSDV基因。利用Gateway重组系统构建原核表达载体,并通过原核表达系统诱导得到大量的SRBSDV P7-2蛋白。本研究为SRBSDV的田间检测和防治提供靶标,也为进一步研究P7-2蛋白的功能奠定基础。
[1] ZHOU G H, WEN J J, CAI D J, et al. Southern rice black-streaked dwarf virus: a new proposed Fijivirus species in the family Reoviridae[J]. Chinese science bulletin, 2008, 53(23):3677-3685.
[2] ZHANG H M, YANG J, CHEN J P, et al. A black-streaked dwarf disease on rice in China is caused by a novel fijivirus[J]. Archives of virology, 2008, 153(10): 1893-1898.
[3] WANG Q, YANG J, ZHOU G H, et al.The complete genome sequence of two isolates of southern rice black-streaked dwarf virus, a New Member of the Genus Fijivirus[J]. Journal of phytopathology, 2010, 158(11-12): 733-737.
[4] ZHOU G H, XU D L, XU D G, et al. Southern rice black-streaked dwarf virus: a white-backed planthopper-transmitted fijivirus threatening rice production in Asia[J]. Frontiers in microbiology, 2013, 4(270): 1-9.
[5] CHENG Z B, LI S, GAO R Z, et al. Distribution and genetic diversity of Southern rice black-streaked dwarf virus in China[J]. Virology journal, 2013, 10: 307.
[6] HE M, WANG Z C, JIN L H, et al. Analysis of gene expression of southern rice black-streaked dwarf virus in rice planting regions of China[J].Research on crops, 2013, 14(4): 1032-1041.
[7] 周国辉, 温锦君, 蔡德江, 等.呼肠孤病毒科斐济病毒属一新种:南方水稻黑条矮缩病毒[J]. 科学通报, 2008, 53(20): 2500-2508.
[8] YIN X, XU F F, ZHENG F Q, et al. Molecular characterization of segments S7 to S10 of a Southern rice black-streaked dwarf virus isolate from maize in northern China[J]. Virologica Sinica, 2011, 26(1): 47-53.
[9] LI Y Z, CAO Y, ZHOU Q, et al. The efficiency of Southern rice black -streaked dwarf virus Transmission by the Vector Sogatella furcifera to Different host plant species[J]. Journal of integrative agriculture, 2012, 11(4): 621-627.
[10] PU L L, XIE G H, JI C Y, et al. Transmission characteristics of Southern rice black -streaked dwarf virus by rice planthoppers[J]. Crop protection, 2012, 41: 71-76.
[11] 周倩, 朱俊子,梁晋刚, 等. 南方水稻黑条矮缩病毒快速检测[J]. 基因组学与应用生物学, 2010, 29(5): 1009-1012.
[12] 曹杨,潘峰,周倩, 等. 南方水稻黑条矮缩病毒介体昆虫白背飞虱的传毒特性[J]. 应用昆虫学报, 2011, 48 (5): 1314-1320.
[13] 朱俊子, 周倩, 崔亚, 等. 南方水稻黑条矮缩病毒的新的自然寄主[J]. 湖南农业大学学报(自然科学版), 2012, 38(1): 58-60.
[14] 刘万才, 刘宇, 郭荣.南方水稻黑条矮缩病毒病发生现状以及防控对策[J]. 中国植保导刊, 2010, 30(3): 17-18.
[15] 胡昱颛, 宋水林, 宋东海, 等. 水稻草状矮化病毒和水稻锯齿叶矮缩病毒的分子检测[J]. 生物灾害科学, 2022, 45(4): 469-474.
[16] XU Y, YANG L, ZHOU J, et al. Multiplex RT-PCR to simultaneously detect three viruses that infect peach[J]. Letters in Applied microbiology, 2019, 69(5): 318-324.
[17] 陶源, 吴兴泉. 植物病毒检测方法的研究进展[J]. 分子植物育种, 2017, 15 (7): 2901-2906.
[18] 张玉阳, 李庆伦, 于连伟, 等. 大豆症青相关病毒CP蛋白的抗血清的制备及检测应用[J]. 植物病理学报, 2023. (doi: 10.13926/j.cnki.apps.001332)
[19] 林丽明, 吴祖建, 谢荔岩, 等. 水稻草矮病毒特异蛋白抗血清的制备及其应用[J]. 植物病理学报, 1999, 29 (2): 126-131.
[20] GAO S B,WU J X. Detection of tomato spotted wilt virus (TSWV) infection in plants using DAS-ELISA and Dot-ELISA[J]. Methods in molecular biology, 2022, 2400: 253-261.
[21] SUM M S H, YEE S F, ENG L, et al. Development of an Indirect ELISA and dot-blot assay for serological detection of rice tungro disease[J]. Biomed research international, 2017.(doi: 10.1155/2017/3608042)
[22] 周国辉,张曙光,邹寿发,等. 水稻新病害南方水稻黑条矮缩病发生特点及危害趋势分析[J]. 植物保护, 2010, 36(1): 144-146.
[23] 秦碧霞, 李战彪, 谢慧婷, 等. 水稻品种抗南方水稻黑条矮缩病人工接种鉴定技术规程[J]. 江苏农业科学, 2021, 49(18): 103-105.
[24] MAO Q Z, ZHENG S L, HAN Q M, et al. New model for the genesis and maturation of viroplasms induced by fijiviruses in insect vector cells[J]. Journal of virology, 2013,87(12): 6819-6828.
[25] 卢嫣红, 张金凤, 熊如意, 等.南方水稻黑条矮缩病毒S6编码一个沉默抑制子[J]. 中国农业科学, 2011, 44(14): 2909-2917.
[26] LIU Y, JIA D S, CHEN H Y, et al. The P7-1 protein of southern rice black-streaked dwarf virus, a fijivirus, induces the formation of tubular structures in insect cells[J]. Archives of virology, 2011, 156(10): 1729-1736.
[27] JIA D S, CHEN H Y, ZHENG A L, et al. Development of an insect vector cell culture and RNA interference system to investigate the functional role of Fijivirus replication protein[J]. Journal of virology, 2012, 86(10): 5800-5807.
Cloning and Prokaryotic Expression ofof
HU Yuzhuan1, WANG Quanxing1, ZHANG Jinyi1, SONG Shuilin1, JIANG Junxi1,2, XIONG Guihong1,2*
(1. School of Agronomy Sciences, Jiangxi Agricultural University, Nanchang 330045, China; 2. Jiangxi Provincial Key Laboratory of Root and Tuber Crops Biology, Jiangxi Agricultural University, Nanchang 330045, China)
To establish a method for rapid detection of(SRBSDV) and study the function ofgene, it is necessary to prepare specific antiserum of.Thegene was amplified by RT-PCR from the rice leaves infected with SRBSDV. The purified PCR fragment ofgene was subcloned into the prokaryotic expression vector pDEST17 to obtain the recombinant prokaryotic expression vector pDEST17-by Gateway recombinant technology. Then the recombinant vector was transformed intocells, which was induced by IPTG to express the protein and optimize the induced expression conditions.Sequence of the 930 bp SRBSDVwas amplified by RT PCR. The sequencing results showed that the prokaryotic expression vector pDEST17-was obtained. The positive prokaryotic expression ofstrains was identified by PCR. A large number of 42 kDa HIS6-tag fusion protein was obtained with the induction of 0.1 mmol/L IPTG fromcells for 8 h when the temperature was 28 ℃.SRBSDVgene was obtained and its protein was induced successfully under the optimal conditions, which laid a foundation for the detection and prediction of SRBSDV in the field as well as for the function study of SRBSDV.
SRBSDV; RT-PCR;gene; prokaryotic expression
10.3969/j.issn.2095-3704.2023.04.65
S432.1
A
2095-3704(2023)04-0432-06
2023-10-20
2023-11-06
国家自然科学基金项目(31960533)、江西省自然科学基金项目(20192BAB214004)和江西省教育厅科学技术研究项目(GJJ170293)
胡昱颛(1999—),男,硕士生,主要从事植物病理学研究,601018211@qq.com;*通信作者:熊桂红,讲师,博士,xiongguihong2009@163.com。
胡昱颛, 王全兴, 张金艺, 等. 南方水稻黑条矮缩病毒基因的克隆与原核表达[J]. 生物灾害科学, 2023, 46(4): 432-437.

