食品微生物检验中流式细胞术的研究进展
高惠敏,颜春荣,徐春祥,方 昕
食品微生物检验中流式细胞术的研究进展
高惠敏,颜春荣,徐春祥,方 昕*
(江苏省食品药品监督检验研究院,江苏 南京 210008)
食品微生物是影响食品安全的重要因素之一。采用新型快速检测方法及时发现食品安全隐患、迅速采取相应措施,有助于提高食品安全监管效率,确保食品安全。流式细胞术可用于食品微生物区分死活、计数、种群鉴定等多参数定性和定量分析,为解决平板检测方法时效性不足、难以区分死活、无法检测非培养性微生物等问题提供了新思路。笔者就流式细胞术在食品微生物检测领域的研究和应用做了概括总结,详细介绍了流式法检测的试验流程、关键影响因素和研究进展,并对该方法在应用中存在的问题做了探讨和分析,以期为流式法在食品微生物检测领域的广泛应用提供参考,确保食品安全。
流式细胞术;食品微生物;快检;监测
食品微生物污染一直是食品安全监测的重点方向。国家标准中对食品微生物的检测过程主要包括微生物的培养、分离和生化鉴定等。传统的检测方法费时费力,难以应用于要求快检的场景[1]。同时,该方法也不能快速检出不可常规培养的微生物,存在一定程度的漏检。为了防止病原微生物的传播,满足食品安全监管需要,对食品微生物新型快速检测方法的需求日益迫切。流式细胞术(flow cytometry,FCM)是一种同时通过散射光和荧光检测进行单细胞分析的技术,可用于食品微生物区分死活、计数、种群鉴定、分选等多参数定性和定量分析,且分选后的微生物能直接用于单细胞培养和生化鉴定[2]。对于解决方法时效性不足、难以区分死活、无法检测非培养性微生物等问题,提供了新手段。
流式细胞术起源于19世纪30年代。1934年,Moldaven最早使用流式细胞术光电法进行细胞计数。1940年,Davey等[3]将流式细胞术成功用于空气中细菌孢子的检测。1973年,BD公司(Becton,Dickinson and Company)研发并生产了世界上第一台商用流式细胞仪。之后随着光学技术进步、荧光染料的发展等,流式细胞术广泛应用于临床医学研究和疾病的诊断检测中[4-6]。相对于在医学检测研究中的重要地位,流式细胞术在食品安全检测领域的应用还不够成熟。笔者就流式细胞术在食品微生物检测中的应用现状进行归纳分析、厘清研究思路,以期为该技术在食品安全检测领域的广泛应用提供参考。
1 流式细胞术微生物检测原理和关键影响因素
理论上,流式细胞术可以分析任何悬浮单颗粒物质的理化性质[7]。流式细胞仪主要包括以下部分:液流系统、光源系统、检测系统、计算与分析系统[2]。流式细胞仪通常以激光作为发光源。经过聚焦整形后的光束,垂直照射在样品流上,被荧光染色的细胞在激光束的照射下,产生散射光和激发荧光。散射光信号分为前向散射(Forward scattering,FSC)和侧向散射(side scattering SSC),FSC反映细胞或微粒体积的大小,SSC反映细胞或微粒内部结构的复杂程度。荧光信号强度代表细胞表面抗原的浓度或细胞内物质(如核酸)的浓度。这些光学信号被光电倍增管(photomultiplier tube,PMT)接收并转换为电信号输入到分析系统中(图1)。不同类型的细胞直径、丰度、结构、性质不同,它们产生的荧光信号和散射光信号也不同。因此通过流式细胞仪结合特定的荧光标记可以实现对不同类型细胞的分析和分类[1,8-9]。
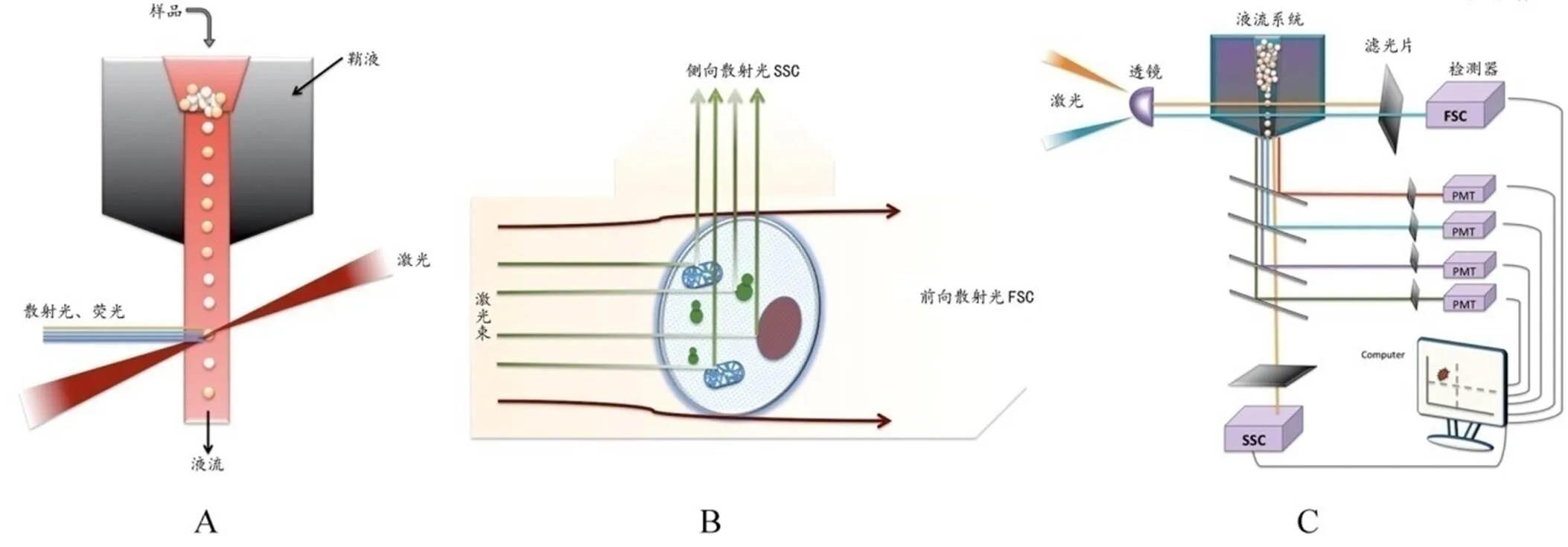
A:液流系统;B:光源系统;C:检测和计算、分析系统
1.1 食品样品制备
样品基质直接影响流式细胞术对微生物的检测结果。传统食品微生物检测无论是液体样品还是固体样品,多采用均质、混匀后稀释处理,随即进行平板培养等后续检测[10-11]。样品处理简单,但后续培养和鉴定耗时较长且检测通量受限。流式细胞术可以对微生物实现快速、多参数的精确测量,但对样品处理的要求较高。样品悬液在进入流动室前,需经过均质、过滤、离心等处理过程。根据食品基质的复杂程度和荧光标记原理的不同,有些还需进行酶解、微生物预富集等处理。经处理后的样品悬液一方面避免了流式细胞仪喷嘴堵塞,另一方面可以降低样品基质引起的背景干扰。
流式细胞术较早用于液体基质食品微生物检测,如对生乳中菌落总数的检测、发酵乳中乳酸菌的检测及发酵酒中酵母的实时监测等。葡萄酒中的碎屑、水样中的藻类和矿物质等具有高背景自发荧光,牛奶中的蛋白质胶束可能与所使用的荧光生物试剂非特异性结合,以上基质中的干扰物都会影响最终测定,造成结果的假阳性或假阴性。过滤器过滤可有效降低样品中大颗粒干扰。Maukonen等[12]将益生菌饮料依次过40 μm和20 μm过滤器过滤并悬浮在PBS缓冲液中,用以避免食品基质颗粒引起的检测偏差。De Bellis等[13]在验证一款适用于酒中酒香酵母监测的流式细胞快速检测试剂盒中发现,样品经PBS稀释后过30 μm过滤器且经过多次离心悬浮,可有效去除样品中的碎屑干扰,提高荧光标记的抗体结合率[13]。牛乳样品的前处理关键点是消除蛋白质、体细胞和脂肪的干扰[14]。使用蛋白酶(蛋白酶K、胰蛋白酶、碱性蛋白酶、savinase酶等)降解大分子蛋白,用Triton X-100裂解牛乳中的体细胞,通过离心完成脂肪的分离[15]。使用该方法对牛乳中大肠杆菌O157﹕H7进行流式定量检测,检测范围在104~108CFU/mL,与平板计数方法基本一致,但检测时间缩短至1 h内[16]。果汁中的果肉颗粒可能含有核酸分子,通过核酸染色的方法无法将果肉颗粒与细菌区分,造成流式检测结果不准确。He等[17]在样品前处理阶段使用纤维素酶水解植物细胞壁中的纤维素,再通过多次洗涤去除植物残留的细胞和碎屑片,实现了果汁样品中细菌的较高回收率[17]。茉莉绿茶饮料中含有大量的镁离子等许多矿物质,干扰PicoGreen荧光染料对DNA的染色。Yu等[18]在茉莉绿茶中加入1.0 mmol/L二价离子螯合剂EDTA,用于阻断镁离子对PicoGreen染色的干扰。结果表明,经EDTA处理后,PicoGreen染色结合FCM分析适用于茉莉绿茶饮料中细菌总数检测[18]。
相较于液体基质食品微生物检测,通过流式细胞术对固体基质中微生物的检测技术还不够成熟,这主要是因为难以排除固体基质中较高含量蛋白、碳水化合物等物质的干扰。固体样品中的碳水化合物、膳食纤维、蛋白等物质会引起特异性吸附干扰检测[19]。肉类和乳制品中的脂肪、高蛋白颗粒会干扰抗体识别结合。水果、蔬菜经均质处理后,可能会释放干扰检测的酶或抗菌成分。另外,生食样品中的原生菌群会干扰特定食源性致病菌的检测[20-21]。除液体样品中常用的均质、过滤和离心等分离手段外,采用一定的富集方式增加待测微生物浓度,可以提高流式细胞术分析法的检测灵敏度、降低检测下限[22]。研究者在乳粉中致病菌的流式细胞术检测中,优化了样品的富集时间。结果发现,将样品在相应培养基中分别预培养5 h和6 h后再加入蛋白酶K和Triton X-100处理样品,可以保证流式细胞仪检测到所有待检样品中单个活的沙门氏菌或金黄色葡萄球菌细胞[23-24]。样品预富集在荧光原位杂交-流式细胞术(Fluorescence in situ hybridization-Flow cytometry FISH-FCM)检测肉及肉制品中致病菌研究中尤其重要。预富集可以增加细胞内核糖体的丰度,提高荧光探针与靶rRNA的特异性结合。研究者分别在60份来源不同的猪肉香肠中添加107CFU/mL肠道沙门氏菌(),用于比较预富集和直接检测之间的灵敏度差异。结果发现,在预富集的新鲜样品和加标样品中,传统平板培养和FISH两种方法的检测灵敏度都高于非富集样品[25]。使用两步法对生肉和熟虾中的单增李斯特菌进行预富集(24 h+18 h),PNA-FISH(peptide nucleic acid fluorescence-FISH,肽核酸-FISH)法对食品中单增李斯特菌的检测限可降低到0.5 CFU/25 g[26]。以上预富集方法可为FISH-FCM快速定量检测肉中的致病菌提供技术参考。预富集也可以提高免疫荧光标记-FCM法在牛肉碎、生菜、草莓、菠菜等食品中致病菌特异性检测的灵敏度[22,27-28]。另外,磁分离技术也可用于捕获和富集食品中低丰度致病菌[29]。但是该方法无法排除死菌的干扰,同时对磁珠的特异性和质量稳定性要求较高,目前还未大范围使用。
综上所述,针对液体基质食品中微生物的检测多通过均质、酶解、过滤和离心即可实现定性或者定量分析(表1),而针对固体基质微生物尤其是致病菌的检测则需要经过预富集手段才能完成,这一方面是由于固体基质复杂成分对微生物的吸附和干扰较大,另一方面根据监测经验,样品中致病菌的量一般低于102CFU/mL,而目前市场上多数流式细胞仪在103CFU/mL以上具有更准确的检测结果。

表1 液体基质食品中常用样品前处理方法
1.2 荧光标记选择
与真核生物细胞相比,细菌等微生物的体积较小,其散射光难以与其他物质的颗粒区分。因此,通过流式细胞仪的检测依赖于与细胞结合的荧光染料,用于从背景中识别真正的目标物。根据荧光底物的不同,适用于流式检测法的荧光染料主要包括:结合核酸的染料,如SYTO系列、PI、PicoGreen等;标记抗体蛋白的染料,如FITC、PE、纳米半导体颗粒量子点等[30]。不同的荧光染料具有不同的激发波长和发射波长。流式细胞仪通常会配备多个激光器,如488 nm、633 nm和405 nm等。多激光器可实现多荧光通道分析,减少自发荧光干扰、减少荧光信号之间的补偿,提高检测灵敏度。食品微生物流式检测法中常用的荧光标记及特点见表2。

表2 食品微生物流式检测中常用的荧光染料信息[30]
荧光标记的选择与研究目的相关,如使用PI或7-AAD单染即可实现牛乳中细菌总数的快速检测[14-15]。7-AAD发射光谱比PI窄,更适用于多色荧光分析。为了进一步排除非生物干扰,提高检测灵敏度。目前常使用双染法用于活菌计数、细胞活性监测、细胞膜完整性监测等研究。郑亦舟等[31]使用核酸染料SYTO 24和PI双染法建立了发酵乳饮料中的保加利亚乳杆菌活性监测方法。荧光素类染料cFDA相对于SYTO染色更稳定、被标记后的荧光持续时间更长。姜凯等[32]利用cFDA和PI染料的细胞膜透性不同,建立了基于cFDA染色法的流式细胞术快速检测乳酸菌方法。流式细胞术中食源性致病菌的特异性检测多通过结合分子生物学(荧光原位杂交或核酸适配体)或免疫学技术实现。荧光原位杂交基于荧光标记的寡核苷酸探针识别细菌特异的16S rRNA,结合流式细胞术对细菌进行定量检测。核酸适配体具有特殊的三维结构能够特异性结合靶物质,是一类从寡核苷酸文库中筛选出的单链核酸小分子。用于寡核苷酸标记的染料通常包括罗丹明类(羧基四甲基罗丹明(TAMRA)、四甲基罗丹明-5-异硫氰酸(TRITC)等)、Texas red、菁染料Cy3和Cy5等[33-34]。新一代荧光标记还包括Alexa Fluor(Alexa488、Alexa Fluor 568、Alexa647等)染料和量子点(纳米晶体颗粒)[35-36]。荧光素类染料FITC则广泛用于抗体蛋白的标记,FAM、TET更侧重于核酸探针的标记[37]。
另外,流式细胞术荧光标记的选择还需考虑仪器配置的光源波长、染料的亮度与靶标表达量的匹配、染料光谱重叠和样本自发荧光等多重因素。
1.3 仪器主要参数设置
流式细胞仪参数的设置也是影响流式检测结果的重要方面[38]。在流式检测样品上机时,首先要调节每个通道的电压。电压调节准确既可以放大信号,又能区分信号强弱不同的细胞。通常使用空白管细胞调节电压,即FSC和SSC的电压。通过调节FSC/SSC电压,使待检细胞清晰聚集于流式图的中央或者靠近中央的位置。如目标细胞体积较小,则适当提高电压值,使目标细胞与碎片在流式图中能够完全分离;如目标细胞体积较大,则适当降低电压值,使所有的目标细胞群完整显示于流式图中。有些微生物(如酵母细胞)散射光强度较大,无法通过调节FSC电压完全聚集于流式图中,则需要增加衰减片,降低荧光强度,避免散点图中目标细胞“压边”现象导致的测量误差。另外还要调节每个荧光通道的电压,每个荧光的单染管分别上机调节,使阳性细胞群和阴性细胞群尽可能的分离。当使用两种或两种以上荧光标记时,由于某些荧光染料存在较宽的发射光谱,通过检测器检测时即使已经选择了合适的滤光片,不同荧光染料间仍可能存在发射光谱的重叠。因此在使用多荧光标记时还应注意调节各荧光通道的补偿。补偿值的大小受仪器型号、染料性质和微生物种类的影响。
多数流式细胞仪用于检测真核细胞,而细菌大小是细胞的千分之一或更小,更易受到杂质干扰,因此阈值(threshold)的设置对食品微生物的准确检测尤为重要。合理的阈值可以避免基质背景、细胞碎片和电子噪音的干扰。阈值太低,背景或者细胞碎片干扰太大;阈值太高,则会造成目标微生物部分丢失、检测不完全。流式细胞仪对微生物的检测主要通过设定FSC/SSC阈值实现目标菌的分群。阈值可以根据阴性对照管来调节。阈值的设置是一个经验数值,需根据实际实验情况调节。
圈门(gate)是流式数据分析的第一步,即在流式图中确定一个范围,通过逐级圈门对感兴趣的细胞进行单参数或多参数分析,获得门内细胞的百分比等参数。门的设定形状任意,常见的是根据阈值设门、散射光设门和荧光设门等。设门是主观行为,应尽量考虑到以下因素以减少主观判断带来的误差:(a)排除细胞碎片,(b)选择合适的荧光阴性对照,(c)排除死细胞。
由于食品微生物非常小,普遍在0.1 mm以下,难以与样品基质和细胞碎片等干扰区分,因此与细胞检测相比,通过流式细胞仪的微生物检测对仪器参数的设置要求更高。在对微生物定性或定量检测前,需仔细调节仪器电压、阈值和荧光补偿等参数,确保结果的一致性和准确性。
2 流式细胞术在食品安全领域的应用
流式细胞术在微生物分析中有着广泛应用,范围可从单细胞分析扩展到群落水平分析[39]。在食品微生物检测中,流式细胞术既能在一定浓度范围内替代平板培养法,对微生物进行快速数量测定、活性检测、特异性检测等,还可对活菌和死菌进行区分,对生长缓慢和活的非可培养状态微生物进行定量检测。
2.1 实时监控食品质量
基于流式细胞术的微生物计数和生存能力分析有助于快速检测食品微生物污染,加快食品生产过程中的质量评估以及对货架期食品进行品质监控。该技术已在发酵食品、乳制品等领域使用[12-13,40],用于指导实施质量控制。布鲁塞尔德克酵母()能对酒的风味产生影响,在酿酒生产中扮演着重要角色。Branco等[41]设计了1种新型的DNA-FISH探针,借助流式细胞仪对葡萄酒微生物以及葡萄酒环境中的布鲁塞尔德克酵母进行快速特异性检测和鉴定。该方法有助于生产者在葡萄酒变质前识别布鲁塞尔德克酵母、控制酒的风味,防止葡萄酒行业遭受经济损失[41]。基于流式细胞术的计数和细胞活力测定还能为益生菌产品的开发和质量评价提供有效的技术工具[42-43]。Chiron等[43]结合多克隆抗体,建立了基于流式细胞术的5种益生菌菌株的特异性定量检测方法,该方法可在极短的时间内(<2 h)对益生菌菌株进行定量分析。与经典平板培养技术相比,该方法不仅缩短了检验时间,还能对密切相关的菌株进行详细区分,提高了检验效率和分辨率。
2.2 特异性定量检测食源性病原微生物
食源性病原体每年在全球范围内导致数百万人感染,并造成相当大的经济损失。目前经典的平板培养技术仍是检测食品中细菌病原体的金标准,但这些方法耗时且不能快速提供有关食品污染的信息,不足以满足食品安全防控快速筛查需求。流式细胞术具有速度快、精度高、准确性好等优点适合食品中致病菌的快速检测[21-29,44]。Shepelyakovskaya等[45]开发了1种基于流式细胞术的葡萄球菌肠毒素快速检测方法。该方法使用磁珠可以同时捕获3种葡萄球菌肠毒素并进行多重检测,可用于同时检测和定量分析各种肉类和奶类产品以及煎蛋中的毒素。Xue等[46]通过设计靶向16S rRNA序列的荧光标记寡核苷酸探针,建立了1种改进的基于快速流式细胞术的大肠杆菌检测方法。该方法可在2 h内同时检测20多批样品,并能在大量沙门氏菌干扰的情况下,检测到30~40个/mL大肠杆菌细胞,具有较高的灵敏度和特异性。目前该方法已被Wiley实验室指南(Current Protocols)收录,用于指导食品中大肠杆菌的快速检测。
2.3 识别活的但不可培养(VBNC)微生物
流式细胞术还能克服微生物学研究的一大障碍,即分析活的但不可培养(viable but non-culturable,VBNC)微生物。食品加工过程的环境压力,如温度变化、pH值或营养素缺乏,会诱导细胞进入VBNC状态。处于VBNC状态的微生物通常具有新陈代谢活性,且具有致病性和毒性。VBNC状态的微生物在一定条件下可复苏并能再次培养,存在潜在的食品安全风险[47-48]。传统的基于培养的微生物分析可能导致对产品微生物状态的低估或误判。使用流式细胞术对微生物VBNC状态的快速、实时监测可为制订、跟踪和改进食品安全质量控制提供数据支持[49]。结合优化的染色方案,流式细胞术已成功用于监测细菌的生理状态,包括对不同状态下的细菌(活的不可培养、活的可培养、死细菌)进行分别计数和比例统计,该方法可快速、准确、无偏见评估生物体对环境压力的响应[50-51]。Yu等[18]通过使用高灵敏度流式细胞仪(HSFCM)进一步降低了杂质颗粒的背景信号,在30 min内即完成了对桶装饮用水和茉莉绿茶饮料中VBNC细菌、活细菌和死细菌的区分和定量分析。因此,在VBNC细菌的鉴别和定量上,流式细胞术能节省大量时间,较其他实验手段具有明显优势,值得在食品安全领域的研究中采用。
3 结 语
综上所述,流式细胞术克服了平板法检测周期长、检测复杂等缺点,同时能对微生物的活性进行鉴定,对于食品样品质量评估、微生物污染监测等都具有重要意义。但目前流式细胞术对食品微生物的检测还存在局限性,建立快速、便捷、可靠的流式检测方法建议从以下两方面进行优化:(1)建立不同基质食品样品前处理标准操作流程,降低食品基质对微生物的吸附及背景干扰;(2)开发微生物富集技术和用于特异性病原微生物标记的探针,进一步提高流式法对食源性致病菌的检测灵敏度。微生物富集技术如Pathatrix微生物富集纯化系统、用于食源性病原体传感的生物亲和性纳米探针[52]等新兴技术的快速发展将为可靠流式方法的建立提供助力。
通过流式细胞术对微生物的检测大大缩短了检测时间、提高了检测效率,为微生物快检提供了有效技术手段。但由于食品样品基质复杂,以及流式细胞术对微生物的检测多与分子生物学、免疫学等技术结合,在我国流式细胞术并未常规用于分析和监测液体和固体食品的微生物污染。但流式细胞术具有的检测速度快、可同时进行多参数定性和定量分析等优点,使其已成为食品微生物检测领域最有前途的工具,优化和推广该技术将为主动发现食品安全风险、有效预防和控制食品安全问题提供有力技术保障。
[1] 刘思渊. 流式分析技术快速定量检测牛乳中细菌总数与大肠杆菌O157: H7的研究[D]. 太谷: 山西农业大学, 2018.
[2] ADAN A, ALIZADA G, KIRAZ Y, et al. Flow cytometry: basic principles and applications[J]. Critical reviews in biotechnology, 2017, 37(2): 163-176.
[3] DAVEY H M, KELL D B. Flow cytometry and cell sorting of heterogeneous microbial populations: the importance of single-cell analyses[J]. Microbiological reviews, 1996, 60(4): 641-696.
[4] PANG K, DONG S H, ZHU Y X, et al. Advanced flow cytometry for biomedical applications[J]. Journal of biophotonics, 2023.
[5] ZHANG T, GAO M, CHEN X, et al. Demands and technical developments of clinical flow cytometry with emphasis in quantitative, spectral, and imaging capabilities[J]. Nanotechnology and precision engineering, 2022, 5(4): 46-55.
[6] BRESTOFF J R, FRATER J L. Contemporary challenges in clinical flow cytometry: small samples, big data, little time[J]. Journal of applied laboratory medicine, 2022, 7(4): 931-944.
[7] ROBINSON J P. Flow cytometry: past and future[J]. Biotechniques, 2022, 72(4): 159-169.
[8] WU L N, WANG S, SONG Y Y, et al. Applications and challenges for single-bacteria analysis by flow cytometry[J]. Science China-chemistry, 2016, 59(1): 30-39.
[9] HONG J K, KIM S B, AHN S H, et al. Flow cytometric monitoring of the bacterial phenotypic diversity in aquatic ecosystems[J]. Journal of microbiology, 2021, 59(10): 879-885.
[10] 中华人民共和国国家卫生健康委员会, 国家市场监督管理总局. GB 4789.2-2022 食品安全国家标准食品微生物学检验菌落总数测定[S].
[11] 中华人民共和国国家卫生和计划生育委员会, 国家食品药品监督管理总局. GB 4789.35-2016 食品安全国家标准食品微生物学检验乳酸菌检验[S].
[12] MAUKONEN J, ALAKOMI H L, NOHYNEK L, et al. Suitability of the fluorescent techniques for the enumeration of probiotic bacteria in commercial non-dairy drinks and in pharmaceutical products[J]. Food research international, 2006, 39(1): 22-32.
[13] DE BELLIS D, DI STEFANO A, SIMEONE P, et al. Rapid detection ofin wine by polychromatic flow cytometry[J]. International journal of molecular sciences, 2022, 23(23): 15091.
[14] 孙芝杨, 黄闯, 李新建, 等. 流式细胞法对乳制品中细菌总数的快速检测研究[J]. 食品工业, 2016, 37(11): 180-182.
[15] 杨莉婷, 何丽, 何海宁, 等. 流式细胞术对生乳中微生物检测的应用研究[J]. 广西师范大学学报(自然科学版), 2017, 35(2): 112-116.
[16] 刘思渊, 古少鹏, 隋志伟, 等. 流式分析技术快速定量检测牛乳中大肠杆菌O157: H7[J]. 食品科学, 2018, 39(6): 302-306.
[17] HE S B, HONG X Y, ZHANG M M, , et al. Label-free detection of bacteria in fruit juice by nano-flow cytometry[J]. Analytical chemistry, 2020, 92(3): 2393-2400.
[18] YU M X, WU L N, HUANG T X, et al. Rapid detection and enumeration of total bacteria in drinking water and tea beverages using a laboratory-built high-sensitivity flow cytometer[J]. Analytical methods, 2015, 7(7): 3072-3079.
[19] WANG Y X, YE Z Z, SI C Y, et al. Monitoring ofO157: H7 in food samples using lectin based surface plasmon resonance biosensor[J]. Food chemistry, 2013, 136(3-4): 1303-1308.
[20] 王紫璇, 孙洁芳, 邵兵. 食物中典型致病菌的快速检测研究进展[J]. 中国食品卫生杂志, 2022, 34(2): 382-389.
[21] 王斌, 隋志伟, 刘思渊, 等. 基于流式分析技术的奶粉中金黄色葡萄球菌活菌快速定量检测方法研究[J]. 计量学报, 2021, 42(2): 250-258.
[22] WILLIAMS A J, COOPER W M, RAMSAROOP S, et al. Rapid flow cytometry detection of a single viableO157: H7 cell in raw spinach using a simplified sample preparation technique[J]. Frontiers in microbiology, 2017, 8: 1493.
[23] WANG B, LIU S Y, SUI Z W, et al. Rapid flow cytometric detection of single viablecells in milk powder[J]. Foodborne pathogens and disease, 2020, 17(7): 447-458.
[24] Liu S Y, Wang B, Sui Z W, et al. Faster detection ofin milk and milk powder by flow cytometry[J]. Foodborne pathogens and disease, 2021, 18(5): 346-353.
[25] RATHNAYAKA R M U S K. Effect of sample pre-enrichment and characters of food samples on the examination for theby plate count method and fluorescent in-situ hybridization technique[J]. American journal of food technology, 2011, 6(9): 851-856.
[26] ROCHA R, SOUSA J M, CERQUEIRA L, et al. Development and application of peptide nucleic acid fluorescence in situ Hybridization for the specific detection of[J]. Food microbiology, 2019, 80: 1-8.
[27] WANG Z Q, WANG M, XU Q, et al. Rapid and multiplexed detection of single cells of,O157, andin ground beef by flow cytometry[J]. Foodborne pathogens and disease, 2022, 19(4): 272-280.
[28] WANG Z Q, LIU S Y, ZHEN X X, et al. Rapid detection of single viableO157 cells in fresh lettuce and strawberry by immunomagnetic flow cytometry in combination with pre-enrichment[J]. Foodborne pathogens and disease, 2022, 19(1): 36-44.
[29] 李静雯, 陈尔凝, 康福英, 等. 食品中志贺氏菌快速检测免疫磁分离样品前处理技术研究[J]. 计量学报, 2023, 44(3): 326-333.
[30] ZAND E, FROEHLING A, SCHOENHER C, et al. Potential of flow cytometric approaches for rapid microbial detection and characterization in the food industry-a review[J]. Foods, 2021, 10(12).
[31] 郑亦舟, 王杰, 刘洋, 等. 基于流式细胞术的保加利亚乳杆菌活性检测方法的应用研究[J]. 食品安全质量检测学报, 2019, 10(3): 589-592.
[32] 姜凯, 张娜娜, 刘洋, 等. 发酵乳制品中乳酸菌的流式检测方案探索与研究[J]. 食品安全质量检测学报, 2021, 12(13): 5106-5111.
[33] 吴超柱, 徐凡, 郜炎龙, 等. 荧光标记技术在生物学和医学研究中的应用[J]. 重庆理工大学学报(自然科学), 2014, 28(5): 55-62.
[34] ROHDE A, HAMMERL J A, APPEL B, et al. FISHing for bacteria in food-a promising tool for the reliable detection of pathogenic bacteria? [J]. Food microbiology, 2015, 46: 395-407.
[35] ROHDE A, HAMMERL J A, APPEL B, et al. Differential detection of pathogenicspp.by fluorescence in situ hybridization[J]. Food microbiology, 2017, 62: 39-45.
[36] DUAN N, WU S J, YU Y, et al. A dual-color flow cytometry protocol for the simultaneous detection ofandusing aptamer conjugated quantum dots as labels[J]. Analytica Chimica acta, 2013, 804: 151-158.
[37] 董晓琳, 李志萍, 高玮村, 等. 基于适配体的金黄色葡萄球菌流式细胞术检测方法[J]. 东北农业科学, 2016, 41(3): 81-86.
[38] 沈链链, 刘艳青, 管强东. FACS Aria Ⅲ细胞分选参数选择及条件优化[J]. 常州大学学报(自然科学版), 2022, 34(4): 75-81.
[39] MARCOS-FERNANDEZ R, SANCHEZ B, RUIZ L, et al. Convergence of flow cytometry and bacteriology. Current and future applications: a focus on food and clinical microbiology[J]. Critical reviews in microbiology, 2022, 24: 1-22.
[40] MA X B, WANG L N, DAI L X, et al. Rapid detection of the activity ofZhang by flow cytometry[J]. Foods, 2023, 12(6): 1208.
[41] BRANCO P, CANDEIAS A, CALDEIRA A T, et al. A simple procedure for detectingin wine environment by RNA-FISH using a novel probe[J]. International journal of food microbiology, 2020, , 314: 108415.
[42] 薛乘风, 王文婷, 毛翠萍, 等. 纳米流式检测技术用于益生菌产品的细菌活性及上消化道耐受性分析[J]. 分析化学, 2023, 51(4): 502-525.
[43] CHIRON C, TOMPKINS T A, BURGUIERE P. Flow cytometry: a versatile technology for specific quantification and viability assessment of micro-organisms in multistrain probiotic products[J]. Journal of applied microbiology, 2018, 124(2): 572-584.
[44] MENG X Y, YANG G T, LI F L, et al. Sensitive Detection ofwith vancomycin-conjugated magnetic beads as enrichment carriers combined with flow cytometry[J]. Acs applied materials & interfaces, 2017, 9(25): 21464-21472.
[45] SHEPELYAKOVSKAYA A, RUDENKO N, KARATOVSKAYA A, et al. Development of a bead-based multiplex assay for thequantification of three staphylococcal enterotoxins in food by flow cytometry[J]. Food analytical methods, 2020, 13(5): 1202-1210.
[46] XUE Y, WILKES J G, MOSKAL T J, et al. Flow-cytometry-based method to detectandSpp.using 16S rRNA-based probe[J]. Current protocols in toxicology, 2017, 71: 21-28.
[47] ZHAO X, ZHONG J, WEI C, et al. Current perspectives on viable but non-culturable state in foodborne pathogens[J]. Frontiers in microbiology, 2017, 8: 580.
[48] 赵青, 刘欣, 牛洪梅, 等. 食源性致病菌VBNC诱导、复苏及检测的研究进展[J]. 食品科学, 2023: 1-14.
[49] LI J, AHN J, LIU D H, et al. Evaluation of ultrasound-induced damage toandby flow cytometry and transmission electron microscopy[J]. Applied and environmental microbiology, 2016, 82(6): 1828-1837.
[50] KHAN M M T, PYLE B H, CAMPER A K. Specific and rapid enumeration of viable but nonculturable and viable-culturable gram-negative bacteria by using flow cytometry[J]. Applied and environmental microbiology, 2010, 76(15): 5088-5096.
[51] NISAR M A, ROSS K E, BROWN M H, et al. Detection and quantification of viable but non-culturablefrom water samples using flow cytometry-cell sorting and PCR[J]. Frontiers in microbiology, 2023, 14: 1094877.
[52] BRUCE-TAGOE T A, DANQUAH M K. Bioaffinity nanoprobes for foodborne pathogen sens[J]. Micromachines, 2023, 14(6) : 1122.
Research Progress of Flow Cytometry in Food Microbiology Detection
GAO Huimin, YAN Chunrong, XU Chunxiang, FANG Xin*
(Jiangsu Institute for Food and Drug Control, Nanjing 210008, China)
Food microorganisms are one of the important factors affecting food safety. The adoption of new rapid detection methods to promptly identify food safety hazards and then to take corresponding measures can help improve the efficiency of food safety supervision and ensure food safety. Flow cytometry can be used for multi-parameter qualitative and quantitative analyses of food microorganisms, such as distinguishing between the dead and alive, counting, and population identification. It provides a new approach to solve the problems of insufficient timeliness, difficulty in distinguishing between the dead and alive, and inability to detect non cultured microorganisms in the plate detection methods. This article provides a summary of the research and application of flow cytometry in the field of food microbiology detection. It also provides a detailed introduction to the experimental process, key influencing factors, and research progress of flow cytometry detection. Besides, it explores and analyzes the problems existing in the application of this method, in order to provide strategies for the widespread application of flow cytometry in the field of food microbiology detection, so as to ensure food safety.
flow cytometry; food microorganism; rapid detection; monitoring
10.3969/j.issn.2095-3704.2023.04.80
TS207.4
A
2095-3704(2023)04-0549-08
2023-11-02
2023-11-16
江苏省市场监督管理局科技计划项目(KJ21125094)
高惠敏(1985—),女,高级工程师,博士,主要从事食品安全方面的研究,ghmghm2003@163.com;*通信作者:方昕,高级工程师,硕士,nancy1924@163.com。
高惠敏, 颜春荣, 徐春祥, 等.食品微生物检验中流式细胞术的研究进展[J]. 生物灾害科学, 2023, 46(4): 549-556.

