真空冷冻干燥过程中升华温度对梨瓜细胞微观结构的影响
田津津 姚超阳 张志强 张 哲 计宏伟 吴金宇
(天津商业大学天津市制冷技术重点实验室,天津 300134)
随着科技的发展和进步,冷冻干燥技术在保持蛋白质大分子空间结构和稳定性,以及提高活性成分吸收率方面表现突出[1],成为了一种较为先进的干燥技术。经过冷冻干燥加工处理后,食品具有体积小、质量轻、保质期长、复水性能好[2]以及保持原有生化活性的特点,冻干食品的脱水率可高达97%[3],其较低的含水量有效地控制了细菌等微生物的繁殖,因此冷冻干燥技术被广泛用于食品加工行业[4]。但是由于冻干过程包含着传质传热和物料微观结构变化,其中微观结构的变化严重影响着食品的运输和营养价值[5],合适的升华温度在促进冰晶融化和降低对细胞的损伤方面起着重要作用。
关于升华温度对果蔬细胞形态结构的影响,国内外许多研究人员做了大量研究。王元春等[6]以芒果作为试验材料进行了真空冷冻干燥试验,得出适合的升华温度更好地保留了细胞蛋白质和维生素C含量以及使芒果细胞有更好的复水性。Sapkota等[7]探究了干燥方式对枣的影响,得出冷冻干燥下适当的升华温度能够减少细胞内部原花青素等营养物质流失及对细胞的损伤。Fissore等[8]研究了装载小瓶的微型冷冻干燥机,试验以产品温度和从初级干燥阶段开始6 h后的质量损失作为关键参数,研究得出合适的温度可以获得均匀的干燥条件。诸凯等[9]通过数字图像处理方法统计了细胞图像的灰度特征值,对脱水过程中细胞骨架的变化进行了定量分析,发现升华温度的变化会对细胞微观结构产生较大影响。经过单因素试验、响应面法及其正交试验,徐海龙等[10]成功探索出黑果腺肋花楸如采用过高的升华温度,会造成细胞内冰晶融化,使水分超标严重影响复水比。袁小峰等[11]利用正交试验,优化真空冷冻干燥工艺参数,研究得出升华干燥温度会对蜜柚细胞含水率、色差等带来影响。张艳红[12]在真空冷冻干燥红萝卜试验中得出,过高的升华温度会造成细胞体积形状受损,导致营养流失。王泽智[13]通过冻融循环预处理和冻干工艺,探究得出过高的升华温度会造成葱茎段细胞结构受损、组织收缩以及内外压的不平衡。罗洁莹等[14]在冷冻干燥蓝莓工艺研究中得出,过低和过高升华温度都会造成细胞塌陷和干缩现象。魏丽红等[15]在对软枣猕猴桃冷冻干燥研究中得出,合适的升华温度能够保持细胞饱满,且使细胞呈良好的蜂窝状结构。郭利琴[16]在蒜片冷冻干燥工艺研究中得出,升华温度过高会造成蒜片组织结构塌陷,最终使大蒜素流失。
梨瓜营养丰富,但采后贮藏时间短,不利于运输,此外用于果蔬微观结构,如细胞层面研究的果蔬较少,梨瓜满足细胞轮廓清晰的试验要求,可当作果蔬类的典型代表进行真空冷冻干燥微观研究。研究拟采用真空冷冻干燥显微冻干台,观察梨瓜细胞结构变化,并定性分析不同升华温度对组织细胞结构产生的影响,以获得梨瓜细胞冷冻干燥的最佳升华温度。
1 材料与方法
1.1 材料与仪器
试验材料为批发市场采购新鲜度较高、无病虫害且没有机械损伤的九成熟梨瓜(CucumismeloL.),其中每100 g梨瓜中基本营养成分为水分(91.99±1.99) g、蛋白质(0.72±0.07) g、可溶性固形物(9.5±0.4) g,其中包含有(5.19±0.17) g的糖类和少量的微量元素。将所有样品在冰箱冷藏,真空冷冻干燥试验前将样品从冰箱中取出,室温环境下静置1 h,以达到热稳定,试验前对其进行清洗、切片。
试验设备为真空冷冻干燥显微镜分析仪:BX-53型,日本奥林巴斯株式会社;该仪器主要由计算机、控制器、Linksys操作软件、显微镜、CCD相机、图像采集软件“TCapture”、FDSC196型冷热冻干台(英国Linkam Scientific Instruments公司)、Duo3M型高精度真空泵(德国PFEIFFER公司)、Leica VT1000型切片机(德国Leica Biosystems公司)、液氮罐、液氮泵、冷热台台芯组成。其基本原理:温度压力控制器与计算机相连,真空泵和冷热台与控制器相连,冷热台里封闭腔室的工况借助Linksys软件设置程序进行控制,显微镜观测冻干细胞动态过程,同时实时通过CCD相机传输至计算机,通过图像采集软件“TCapture”对动态图像进行拍摄,获取冻干全过程图像,最后使用Image Pro-plus6.0软件处理图像并评估由细胞内的冰晶导致的细胞变形程度。
1.2 试验方法
通过真空冷冻干燥显微镜技术,获得冻干过程的详细示意图,并利用图像处理技术,精准地确定梨瓜细胞形态特征参数。
1.2.1 真空冷冻干燥条件及显微镜观察 用LeicaVT1000切片机将梨瓜薄壁组织结构分割为200 μm的薄层,然后把梨瓜的薄层结构放到冻干台台芯。接着打开Linkam降温控制系统,设定过程控制程序,以25 ℃/min的降温速率进行冻结,设定真空压力为10 Pa,分别在温度为-10,-7,-4,0,5,10 ℃时进行升华,解析温度55 ℃,并使用CCD相机连续记录其冻干过程变化情况,将降温开始的时间设为冻结时间的开始。最后,利用图像处理软件处理梨瓜组织显微照片,获得结构特征参数,量化分析细胞变化情况。
1.2.2 细胞形态学参数计算 通过使用Image Pro-plus6.0图像处理软件,对梨瓜细胞组织在真空冷冻干燥过程中拍摄的显微图像进行处理、测量、分析后,得出细胞的周长和面积,然后探索不同条件下细胞形态学参数的变化情况,从而更好地了解梨瓜细胞受到的影响。根据文献[17],细胞形态学参数计算如下:
假设细胞均为圆形,则当量直径计算公式为:
(1)
式中:
A——细胞面积,μm2;
d——当量直径,m。
当量直径变化率计算公式:
(2)
式中:
δd——当量直径变化率,%;
Δd——当量直径变化量,m;
d——当量直径,m。
细胞周长变化率计算公式:
(3)
式中:
δL——细胞周长变化率,%;
ΔL——细胞周长变化量,m;
L——细胞周长,m。
细胞面积变化率计算公式:
(4)
式中:
δS——细胞面积变化率,%;
ΔS——细胞面积变化量,m2;
S——细胞面积,m2。
假设细胞形状为球形,各项载荷均匀分布,则体积和内压的计算公式为:
(5)
(6)
式中:
V——细胞体积,m3;
ΔP——细胞内压变化量,kPa;
L——细胞周长,m;
h——细胞壁厚度,取1.26×10-6m;
E——细胞壁性模量,2.67×107N/m2;
ΔL——细胞周长的变化量,m;
γ——细胞壁的Possion比,取0.33;
R——变形后果蔬细胞的半径,m。
细胞体积变化率计算公式:
(7)
式中:
δV——细胞面积变化率,%;
ΔV——细胞体积变化量,m3;
V——细胞体积,m3。
对于从空间上随机选一点,线、面积和体积孔隙率一般是相同的,文中孔隙率采用面积孔隙率,其计算公式为:
(8)
式中:
ε——孔隙率,%;
A1——孔隙面积,μm2;
A0——孔隙与非孔隙部位总面积,μm2。
1.3 数据处理
使用Image Pro-plus6.0软件记录试验数据并导入到origin2019中生成折线图,分析各组梨瓜细胞的特征参数的变化情况。
2 结果与分析
2.1 梨瓜细胞冻干过程形态演化分析
如图1(a)~图1(f)所示是真空冷冻干燥显微镜在放大100倍时,多个梨瓜细胞微观形貌结构变化图像。从梨瓜细胞整个过程来看,其微观照片的亮度由亮变暗再变亮,这是由于梨瓜细胞在冷冻干燥之前,组织细胞内外充满了大量组织液,光可以很容易地穿过组织细胞,使其轮廓能够清晰地显示出来,但随着温度降低,整体轮廓变得模糊和暗淡,这是由于细胞液逐渐结晶导致光的散射造成的[18]。在梨瓜细胞升华干燥时,冰晶界面会慢慢退却,细胞表面会变得粗糙,随着升华干燥完成,组织内开始出现多孔通道。解析干燥时,组织细胞微观结构不再发生变化,光只能通过固定通道,干燥后的物料表面发生皱缩,呈疏松多孔的龟甲状,有部分光线通过,冻干过程结束。

图1 梨瓜组织冻干过程中细胞结构的变化
较高或较低的升华温度,都会使细胞形态学参数发生较大改变。因为在升华阶段,真空度和降温速率一定时,较低的升华温度不能够及时提供应对冰晶升华所需的热量,不利于冰晶的快速升华[19],使得第一干燥阶段冰晶升华不够完全,剩余冰晶在解析干燥阶段的较高温度下融化,导致细胞出现软化、收缩和塌陷等现象,最终导致干制品出现表面硬化的情况。然而较高的升华温度会使干燥速率增加,干燥后发生表面硬化的情况,因为较高的温度会使干燥速率增加,细胞表面冰晶快速升华,而胞内冰晶升华较慢,这样易致清晰干燥面硬化皱缩[20],给后续解析干燥过程造成负面影响。在升华阶段包含着热量传递和质量传递,两者相互作用,所以要探究升华温度在此阶段产生的重要影响。
2.2 一维形态学参数变化
如图2、图3所示,随着升华温度的升高,干燥前后相比梨瓜细胞一维形态学参数变化率表现为先减小再增大的趋势,当量直径和周长的最大变化量分别为7.09%和8.60%,最小变化量分别为5.04%和5.10%。当以-10 ℃的升华温度干燥时,由于温度过低,会使冻干过程中自由水形成的冰晶升华不完全,存在剩余,在后续解析干燥时,自由水和结合水被同时除去,会造成细胞收缩塌陷,使当量直径和周长变化率变大。但随着升华温度的升高,变化率在0 ℃时达到最小,此温度下直径和周长变化率分别为5.05%和5.15%。温度过高,会使梨瓜内部冰晶融化,水分则以液态的形式蒸发,会对细胞结构产生不利影响,使得细胞皱缩,这与易丽等[21]和高续春等[22]关于升华温度对细胞影响的观点一致。
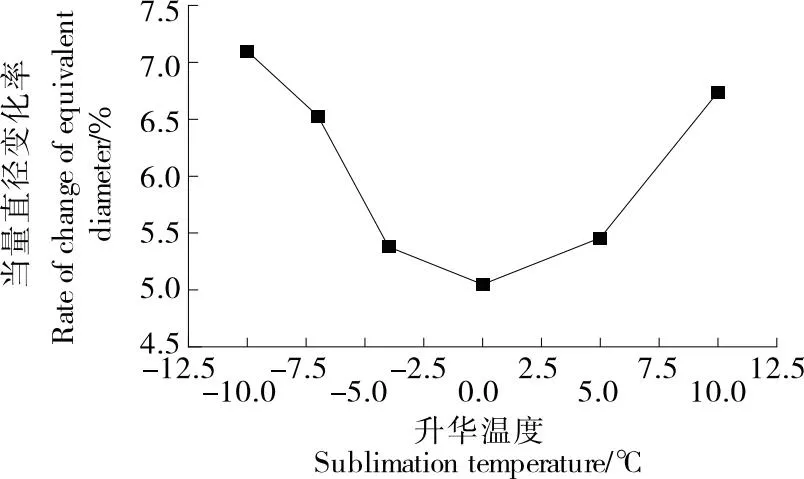
图2 当量直径变化率随升华温度的变化
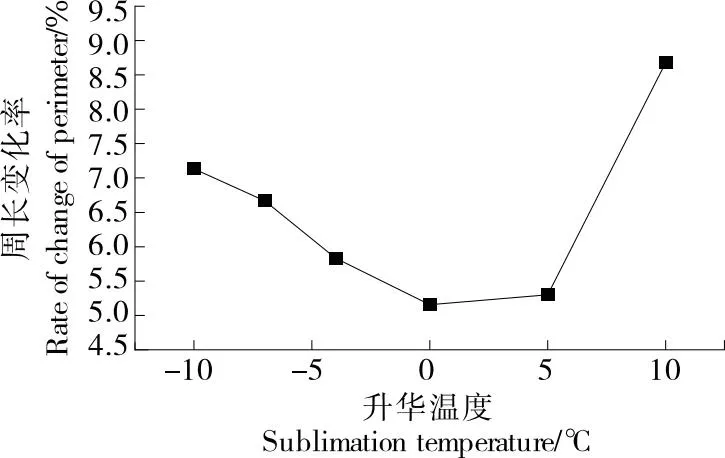
图3 细胞周长变化率随升华温度的变化
2.3 二维形态学参数变化
如图4所示,随着升华温度的升高,干燥前后相比梨瓜细胞二维形态学参数变化率表现为先减小再增大的趋势,与初始细胞状态相比,细胞面积最大变化率达13.70%,变化率最小为9.60%,0 ℃时面积变化率是最小的。当以-10 ℃的升华温度干燥时,由于温度较低,造成细胞塌陷,此时面积变化率较大,随着温度升高,面积变化率减小,在0 ℃时面积皱缩减少是最小的,此温度下对细胞结构的破坏和分离程度的影响较低。温度继续升高时,会造成细胞干缩,使细胞面积变化率增大,不利于保留细胞二维的初始微观结构,这与郭帅帅[23]在胡萝卜冷冻干燥试验和模拟中,对升华干燥阶段内部传热传质的结论一致。
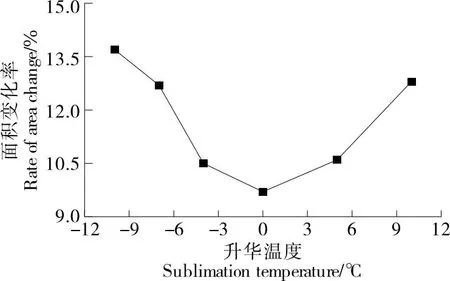
图4 细胞面积变化率随升华温度的变化
2.4 三维形态学参数变化
如图5所示,随着升华温度的升高先以较小的梯度减小然后大梯度增长,在所选温度下,最大和最小体积变化量分别为23.85%和14.68%,在0 ℃下最小。较高的升华温度会使升华界面处的温度超过其共熔点温度,在内部冰晶升华过程中,破坏了细胞结构,造成外部表面干缩[20];较低的升华温度,使细胞内固态冰难以升华,在解析干燥完成后造成细胞塌陷,这两种现象都会造成体积变化率增大。

图5 细胞体积变化率随升华温度的变化
2.5 细胞内压变化
如图6所示,在一定的温度范围内,随着升华温度的升高,内压变化先减小再增大,并且细胞内压和细胞体积呈正相关,在0 ℃的条件下升华时内压变化量最小为89.6 kPa,在所选温度范围内最大变化为357 kPa。较低和较高的升华温度都会使冻干后的细胞发生收缩,造成细胞内压变化量增大,使细胞体积缩小,所以细胞内压的变化会对细胞形状和结构产生直接影响[24]。

图6 内压随升华温度的变化
2.6 孔隙率变化
如图7所示,随着升华温度的升高,孔隙率先增大后减小,在-10,-7,-4,0,5,10 ℃ 6种升华温度下,干燥组织的孔隙率分别为49.63%,51.76%,53.15%,52.46%,51.16%,50.31%,可以发现孔隙率的变化范围较小,孔隙率普遍较高。随着升华温度的升高,孔隙率也逐渐升高,在-4 ℃达到最大,此时结构稳定性较高,升华温度对细胞结构破坏减小。随着温度继续升高,对细胞结构影响增大,孔隙率下降,但是从整体来看升华温度对孔隙率的影响较小[25],为了加快升华速率,在不影响物料品质和细胞结构的同时可以在允许的范围内适当提高升华温度。

图7 孔隙率随升华温度的变化
3 结论
(1) 较高的升华温度或较低的升华温度,都会使细胞形态学参数发生较大改变,在允许的范围内适当提高升华温度可以加快升华速率,使冻干效果更好。
(2) 细胞不同维度的形态学参数随升华温度的升高先减小再增大。随着维度的增加,在同一升华温度下的变化量也增加。
(3) 在最佳预冻降温速率25 ℃/min和真空压力10 Pa时,0 ℃的温度条件可以认为是最佳冻干条件,当量直径、细胞横截面积和体积的变化率分别为5.05%,9.60%,14.68%,此时细胞结构稳定性最高,所得产品品质最佳。
(4) 文中研究的是升华温度对梨瓜细胞微观结构的影响,可能会受到优化方法选择的降温速率和真空度数值的影响,后续可以将宏观与微观层面的冻干研究同步进行,设计正交试验,对工艺参数组合进一步优化,获得整个冻干周期的最佳工艺组合。

