基于TRM70303发酵产物硫藤黄菌素的乳油制备
宋迎,何沐昕,张阿郎,刘蕊琪,王丽君,夏占峰
(塔里木大学生命科学与技术学院/新疆生产建设兵团塔里木盆地生物资源保护利用重点实验室-省部共建国家重点实验室培育基地,新疆 阿拉尔 843300)
2022年新疆棉花种植面积约2.496 9×106hm2,产量5.391×106t,占全国的90.2%[1]。棉花已成为新疆农业经济的支柱,而棉花黄萎病自传入我国以来,发病率日益增加,每年造成棉区经济损失1.5×109~2.0×109元。棉花黄萎病是危害棉花生产的主要病害之一,经调查,新茬地块发病率较低,重茬地块发病率较高;长势强的棉田发病率较低,长势弱的棉田发病率较高。根据历年棉田生产经验可知,黄萎病对棉花的产量和品质影响很大,一般减产10%~30%,发病率严重的地块减产可达 80%以上,甚至绝收[2]。引起棉花黄萎病的大丽轮枝菌是一种土壤传播的病原体,抵抗恶劣环境的能力很强,可以存活 10 a以上,因此,黄萎病历来被视为棉花的“毒瘤”。对这类病害的可持续控制是植物保护领域的世界性难题,也是我国农业领域的重大战略需求。
随着国家“乡村振兴”战略的落地生根,国家对农业的投入力度增大,《“十四五”全国种植业发展规划》中提到,建设高品质棉花种植带,实施化肥农药绿色增效行动[3],推广高效低风险生物农药[4],集成推广农业防治、生物防治等绿色防控模式,构建绿色种植制度[5]。目前常规选育出的棉花品种对棉花黄萎病的控制效果尚不理想,且尚无杀菌剂可高效防治棉花黄萎病。因此利用拮抗微生物及其产生的活性产物来抑制或消灭有害生物是生物防治的主要发展方向,具有对环境友好、选择性强、不易产生抗药性等优势,发展前景广阔。
二硫吡咯酮类(DTPs)化合物是一类结构独特的天然抗生素,具有杂环戊二烯(4H-1,2-二硫-4,3-b-吡咯-5-酮)母核。硫藤黄菌素是DTPs 化合物最著名的代表,表现出广谱的抗生素活性、强大的抗血管生成作用和抗癌细胞活性[6]。二硫吡咯酮类抗生素对多种微生物,包括革兰氏阴性菌、革兰氏阳性菌以及寄生虫等都有很好的杀、灭活性,但由于其因溶解性较差,硫藤黄菌素及其衍生物目前还没有作为农用和医用抗生素商业使用。
本研究以塔里木盆地放线菌Streptomycessp.TRM70303分离的活性次生代谢产物硫藤黄菌素为研究原料,筛选溶剂与乳化剂的组合优化制备乳油,以期研制出一种对棉花黄萎病具有抑菌活性的生物源农药[7]。
1 材料与方法
1.1 试验材料
1.1.1 供试药剂与试剂
原药:硫藤黄菌素,从放线菌Streptomycessp.TRM70303发酵产物中分离提取。
溶剂:二甲基亚砜(DMSO)和无水乙醇(EA)均为分析纯,天津鑫宇精细化工有限公司;甲醇(MT)、甲苯(TL)及二甲苯(XY)均为分析纯,天津北联精细化学品开发有限公司。
乳化剂:农乳500#、农乳600#、1601、1602、OP-21、BY130、El-20(邢台鑫蓝星科技有限公司);吐温20、吐温40、吐温80(天津市致远化学试剂有限公司)。
大丽轮枝菌(VerticilliumdahliaeACCC 36211),由新疆生产建设兵团塔里木盆地生物资源保护利用重点实验室-省部共建国家重点实验室培育基地提供。
1.1.2 培养基
PDA培养基:马铃薯200 g,葡萄糖20 g,琼脂16 g,蒸馏水1 000 mL。
1.2 试验方法
1.2.1 硫藤黄菌素抑制大丽轮枝菌活性测定
将硫藤黄菌素设定5个质量浓度,采用菌丝生长速率法测定硫藤黄菌素对大丽轮枝菌皿内抑菌活性[8]。首先将不同质量的硫藤黄菌素(0.040 0 g、0.020 0 g、0.010 0 g、0.005 0 g、0.002 5 g)用1 mL的DMSO溶解,配制成浓度分别为40.0 mg/mL、20.0 mg/mL、10.0 mg/mL、5.0 mg/mL、2.5 mg/mL的硫藤黄菌素母液,分别将不同浓度的硫藤黄菌素母液与100 mL冷却灭菌后至40~50 ℃的PDA培养基混合,充分混匀后制成含不同剂量硫藤黄菌素培养基(DMSO终浓度为0.4%),此时硫藤黄菌素的浓度分别为0.400 mg/mL、0.200 mg/mL、0.100 mg/mL、0.050 mg/mL、0.025 mg/mL,分别以不添加硫藤黄菌素而添加同等浓度的DMSO及空白PDA培养基作为对照,每个质量浓度需设3个重复。待培养基冷却至室温后,接种生长旺盛、活力一致,直径为6 mm的供试大丽轮枝菌菌饼,于(28±1) ℃下培养。采用十字交叉法测量菌落直径,计算出硫藤黄菌素在不同质量浓度下对大丽轮枝菌的生长抑制率和硫藤黄菌素对大丽轮枝菌的生长抑制率。
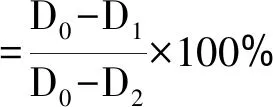
(1)
式(1)中,D0:对照组大丽轮枝菌生长直径,mm;D1:处理组大丽轮枝菌生长直径,mm;D2;供试大丽轮枝菌菌饼直径,mm。
1.2.2 硫藤黄菌素乳油溶剂的选择
取5个50 mL PA瓶,称取1 g硫藤黄菌素,取5种有机溶剂各1 mL分别加入到5个PA瓶中,在室温下轻微振荡促进溶解。如果不能全部溶解,再次滴加溶剂后微热溶解。如果始终无法全部溶解,继续加入溶剂重复上述步骤,当溶剂加至300 mL时,如仍不能够全部溶解,弃去,选择另一种溶剂进行上述试验[9]。考虑溶解性与成本因素,筛选出最适试剂作为乳油溶剂。
1.2.3 硫藤黄菌素乳油分散性测定
将99.5 mL蒸馏水置于100 mL的量筒中,并用移液管滴入0.5 mL乳油,观察其分散状态。如能呈云雾状自动分散,无可视粒子视为优;如呈絮状下沉视为合格[10]。
1.2.4 硫藤黄菌素乳油乳化稳定性评价方法
参照GB/T 1603—2001中的方法进行测定:在250 mL烧杯中,加入100 mL 2~30 ℃标准硬水,用移液管吸取0.5 mL乳油样品(稀释200倍),在不断搅拌的情况下缓缓加入标准硬水中,加完乳油后,继续用2~3 r/s的速度搅拌30 s,立即将乳状液移至清洁、干燥的100 mL量筒中,并将量筒置于恒温水浴锅中,在(30±2) ℃范围内,静置1 h,观察乳状液的分离情况,如在量筒中无浮油(膏)、沉淀和沉油析出,视为乳液稳定性合格[11]。
1.2.5 硫藤黄菌素乳油贮存稳定性测定
热贮稳定性参照 GB/T 19136:(54±2) ℃贮存14 d,同时乳油外观、乳液稳定性、乳化分散性等物理性质在贮存前后基本不变或变化不大,满足各项指标要求;乳油的低温稳定性测定参照GB/T 19137:(-20±2) ℃贮存7 d或14 d后进行观察,不分层、无结晶为合格。
1.2.6 硫藤黄菌素乳油挥发性测定
取直径11 cm的定性滤纸一张,用天平称重后,用滴管在滤纸上均匀滴加1 mL乳油,使其全部湿透,加药液量以滤纸下端无药液滴下为宜。加药后立即称重,将滤纸悬挂在30 ℃室内,20 min后再次称重。计算乳油挥发率,不超过30%为宜。
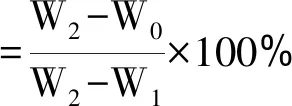
(2)
式(2)中,W0:农药乳油挥发后的滤纸质量,g;W1:滤纸质量,g;W2:滴上农药乳油后立即称出的滤纸质量,g。
1.2.7 硫藤黄菌素乳油的抑菌活性测定
在96孔板每个孔中加入无菌PDA培养基100 μL。在A、B、C三排的第一孔加100 μL配好的硫藤黄菌素乳油(乳油初始浓度为1 024 μg/mL),然后对药物进行二倍稀释。即第一孔中加入药液后用移液器充分吹打混匀,然后吸取100 μL加入第二孔再充分混匀,照此重复直至此排最后一孔,吸取100 μL弃去。在D、E、F三排的第一孔加100 μL配好的乙蒜素乳油(浓度为1 024 μg/mL),然后对药物进行二倍稀释[12]。此时每孔药物浓度从左到右依次为512.00 μg/mL、256.00 μg/mL、128.00 μg/mL、64.00 μg/mL、32.00 μg/mL、16.00 μg/mL、8.00 μg/mL、4.00 μg/mL、2.00 μg/mL、1.00 μg/mL、0.50 μg/mL、0.25 μg/mL。并在每一孔中加入稀释好的大丽轮枝菌菌液100 μL(约含1×107CFU/mL)[13]。这样就形成测定一个药物MIC值的三次重复(A、B、C三排)。此时每孔药物浓度从左到右依次为256.000 μg/mL、128.000 μg/mL、64.000 μg/mL、32.000 μg/mL、16.000 μg/mL、8.000 μg/mL、4.000 μg/mL、2.000 μg/mL、1.000 μg/mL、0.500 μg/mL、0.250 μg/mL、0.125 μg/mL。在同一块96孔板上的G排做阴性对照(仅加空白培养基,不加菌液),在H排做阳性对照(加菌液,不加药液),将96孔板放入28 ℃培养箱中培养4 d。
2 结果与分析
2.1 硫藤黄菌素对大丽轮枝菌的拮抗效果
不同浓度的硫藤黄菌素抑制大丽轮枝菌活性测定结果如表1所示,通过硫藤黄菌素对大丽轮枝菌的抑菌活性试验得出,在相同质量的培养基中,加入硫藤黄菌素浓度越大对大丽轮枝菌的抑菌活性越显著[14]。且DMSO对大丽轮枝菌的抑菌效果并不显著。
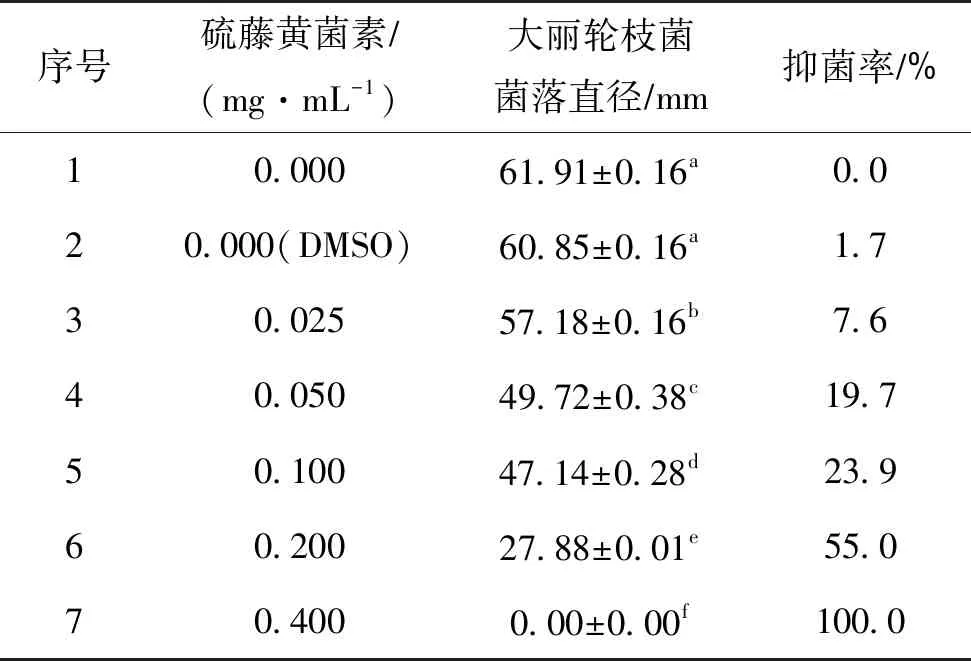
表1 硫藤黄菌素抑制大丽轮枝菌活性测定结果
由表1分析可知,未添加硫藤黄菌素的DMSO的抑菌率为1.7%,且与硫藤黄菌素乳油的抑菌结果并无显著性差异,说明DMSO对大丽轮枝菌并无明显活性,其余添加不同浓度的硫藤黄菌素对大丽轮枝菌的抑菌作用都具有显著性差异,所以硫藤黄菌素乳油对大丽轮枝菌的抑菌作用主要来自于硫藤黄菌素。
2.2 硫藤黄菌素乳油的制备
2.2.1 溶剂的筛选
制备硫藤黄菌素乳油中溶剂的筛选需注意2个指标,即所筛选得到的溶剂加入硫藤黄菌素是否稳定和硫藤黄菌素是否能够在溶剂中充分溶解[15]。
不同溶剂对硫藤黄菌素的溶解性如表2所示。经检测,DMSO对硫藤黄菌素的溶解性最好,TL、XY、MT、EA对硫藤黄菌素的溶解性较差,不适合作为其溶剂。根据该试验结果,选取溶解性最好的DMSO作为制备乳油的最佳溶剂,用来溶解原药硫藤黄菌素。

表2 硫藤黄菌素在5种不同溶剂中的溶解性测试结果
2.2.2 不同种乳化剂对硫藤黄菌素乳油的影响
在室温下,选取农乳500#、农乳600#、1601、1602、OP-21、BY130、El-20、吐温20、吐温40、吐温80共10种不同乳化剂与溶解性最好的溶剂进行乳油的乳化分散性与稳定性测试。通过观察制备的乳油样品的外观以及其滴入标准硬水中的乳化情况来判断所制备乳油的乳化分散性以及稳定性。其中硫藤黄菌素乳油按照原药1.0 g/mL、乳化剂0.8 g/mL、1.2 g/mL、1.5 g/mL,溶剂DMSO补足至1 mL的配方来进行配制。
以硫藤黄菌素作为原药来配制乳油,在含有硫藤黄菌素的溶剂中分别加入不同质量的10种乳化剂制得的乳油基本符合乳油一般性能,乳油外观均呈现半透明状态(图1)。
利用农乳500#制备的乳油分散性较强,其余9种乳化剂制备出的乳油分散性较差,即在滴入水中未能呈云雾状分散(图2)。10种乳化剂制得的乳油稳定性均为合格(图3)。将其倒入平皿中,28 ℃下静置1 h能保持乳液稳定(图4)。静置24 h后仍为透明,未见上层浮油和底部沉淀(图5)。1号(农乳500#)从乳油外观、乳化分散性及稳定性方面都完全符合乳油的要求。在1号乳油中添加1.2 g/mL和1.5 g/mL农乳500#能使乳油达到最优效果,如表3所示。

图2 不同种乳油分散性效果

图3 不同种乳油搅拌后稳定性效果

图4 不同种乳油静置1 h后状态

图5 不同种乳油静置24 h后状态

表3 乳油乳化分散性及稳定性测试结果
2.2.3 热贮稳定性及低温稳定性结果分析
通过对乳化分散性和稳定性测试为“优”的乳油样品进行热贮稳定性和低温稳定性试验,热贮乳油无结晶(图6a);在标准硬水中呈云雾状分散(图6e);乳油在水中搅拌后呈鹅黄色半透明液体(图6g);室温下放置24 h后上无浮油下无沉淀(图6c),所有指标均为合格,冷贮乳油恢复室温后无结晶(图6b);在标准硬水中呈云雾状分散(图6f);乳油在水中搅拌后呈鹅黄色半透明液体状(图6h);室温下放置24 h后上无浮油下无沉淀(图6d),所有指标均为合格,达到了制作乳油的一般标准。

a:乳油热贮14 d形态;b:乳油冷贮14 d恢复室温后形态;c:热贮乳油放置24 h后状态;d:冷贮乳油放置24 h后状态;e:热贮后乳油分散性;f:冷贮后乳油分散性;g:热贮乳油搅拌后状态;h:冷贮乳油搅拌后状态。
2.2.4 硫藤黄菌素乳油挥发性试验结果评价
通过硫藤黄菌素乳油挥发性试验,测得硫藤黄菌素乳油挥发率为1.8%,符合乳油挥发性标准,硫藤黄菌素乳油挥发性测试结果如表4所示。

表4 硫藤黄菌素乳油挥发性测试结果
2.2.5 硫藤黄菌素乳油对大丽轮枝菌最小抑菌活性
硫藤黄菌素乳油的抑菌活性测定结果(图7),可得硫藤黄菌素最小抑菌浓度为2.000 μg/mL,乙蒜素乳油的最小抑菌浓度为8.000 μg/mL,说明硫藤黄菌素乳油与市面上的化学合成乳油乙蒜素对比,对大丽轮枝菌具有较好的抑菌活性。

图7 硫藤黄菌素乳油对大丽轮枝菌抑菌活性(MIC)测试
3 讨论
为了便于保存和使用活性药物成分,通常需要加工成合适的剂型,如粉剂、乳油、膏剂等。目前农用药物的发展方向为高效、安全、多功能,尽量少用有机溶剂以节约成本和降低毒性[16]。硫藤黄菌素原药水溶性不好,DMSO对其具有较好的溶解性,DMSO毒性相对较小,在医药工业中可以直接用作某些药物的原料及载体,本研究采用DMSO作为原药的溶剂具有较好的安全性。
合成杀菌剂一直是植物病原真菌的主要防治手段。然而,它们会对人类、动物和环境造成危害,并在植物病原真菌中产生抗性。在过去的几十年中,使用微生物作为植物病原真菌的生物防治剂已成为合成杀菌剂的替代方法。从陆地、海洋、湿地等环境中分离的放线菌已被用于植物病原真菌的生物防治。目前需要寻找不同分离来源新的放线菌次级代谢产物。然而,关于那些作为农业生物防治剂与其他环境隔离的物质的信息较少。因此,本研究通过分离出的具有抗真菌活性的放线菌,得出其次级代谢产物,将其制备成生物制剂。以期对植物病害具有防治作用。尽管放线菌具有作为植物病原真菌生物防治剂的潜力,但对来自海洋、盐碱地和湿地环境的放线菌的研究很少,这些放线菌作为生物防治剂的潜力与来自陆地环境的分离株具有同等或更大的潜力。
在后续的研究中,可以采用结构修饰方法提高硫藤黄菌素的水溶性,例如糖基化修饰方法可提高天然化合物的溶解性[17],也可以采用向非核心结构区域引入羧基或氨基等极性基团的方法提高溶解性[18]。
4 结论
硫藤黄菌素对大丽轮枝菌表现出显著的抑菌活性。通过比较不同乳化剂、溶剂、热贮稳定性及低温稳定性对硫藤黄菌素制备乳油制剂的影响,最终筛选出硫藤黄菌素原药最适溶剂为DMSO,最适乳化剂为农乳500#(1.2 g/mL),确定了基于原药硫藤黄菌素制备乳油的最佳配方。硫藤黄菌素乳油最佳配方为硫藤黄菌素10%(1.0 g/mL),农乳500#12%(1.2 g/mL),DMSO补足至100%。

