新斯的明联合大黄灌肠对重症急性胰腺炎腹内高压患者的作用
赵瑞雪 崔娟 曹丽林 王磊
河北北方学院附属第一医院重症医学科,张家口 075000
资料与方法
一、一般资料和分组
回顾性分析2018年1月至2022年6月间河北北方学院附属第一医院ICU收治的89例给予CRRT治疗的SAP患者临床资料。纳入标准:(1)符合《中国急性胰腺炎诊治指南(2021)》[11]中SAP的诊断标准和CRRT治疗指征[12];(2)SAP患者处于急性反应期(病程早期)[11];(3)腹内压≥12 mmHg(1 mmHg=0.133 Kpa);(4)年龄18~80岁;(5)临床资料完整。排除标准:(1)存在新斯的明禁忌证如心绞痛、心肌梗死、支气管哮喘、癫痫、甲状腺功能亢进或对其过敏者;(2)脑出血或半年内有出血疾病、严重出血倾向、活动性消化性溃疡的患者;(3)重度低氧血症合并肝功能不全的患者;(4)肺、肝、肾慢性疾病病史的患者;(5)消化道肿瘤及机械性肠梗阻的患者;(6)尿路感染或既往膀胱手术病史患者;(7)怀孕或哺乳患者;(8)72 h内放弃治疗及早期因SAP已入ICU的患者。根据治疗方案不同将患者分为对照组(44例)和研究组(45例),对照组常规治疗外,给予大黄(生大黄粉20 g浸泡于石蜡油和200 ml生理盐水)高位灌肠和芒硝盐外敷[13],2次/d,持续7 d;研究组为常规治疗基础上,加用肌肉注射新斯的明(上海信谊金朱药业有限公司,国字准字H31021570) 0.5 mg,2次/d,持续7 d。本研究经医院伦理委员会批准(K2020125),家属及患者均签署同意书。
二、腹内压的监测
所有患者入ICU后置尿管连接传感器,接入膀胱压监测仪(OT-UD-II,广州恒爱医疗)监测腹内压。腹内压≥12 mmHg,则连续给药7 d;若腹内压≥25 mmHg或持续>20 mmHg并伴有器官功能衰竭(有或无腹腔灌注压<60 mmHg)即为腹腔间隔室综合征(abdominal compartment syndrome,ACS),则多学科会诊决定是否进行手术减压。腹内压的监测为首次3 h测1次,之后每6 h测1次,连续3 d。此后,根据临床指征进行监测:腹内压>12 mmHg者,每6 h测1次;腹内压正常者每天测1次,直到分组后7 d。腹内压分级标准:Ⅰ级为12~15 mmHg,Ⅱ级为16~20 mmHg,Ⅲ级为21~25 mmHg,Ⅳ级为>25 mmHg;腹内压恶化定义为分组7 d内腹内压反弹≥5 mmHg或持续升高≥20 mmHg[8]。
三、CRRT治疗
所有患者均禁食,给予吸氧、胃肠减压、抑酸抑酶(奥美拉唑和奥曲肽)、消炎、补液、肠外营养等常规治疗。实施CRRT的时间点主要依据病情的需要,所有患者在局部麻醉下行中心静脉穿刺置入双腔深静脉导管,建立体外循环。使用Prismaflex床旁连续血滤系统及配套的管道过滤器(Fresenius FX80膜型血过滤器,膜面积1.6 m2,德国费森尤斯公司),连续性静脉-静脉血液滤过(continuous veno-venous hemofiltration,CVVH)模式为2 000~3 000 ml/h(35 ml·kg-1·h-1),血流量(130~150)ml/min,温度维持在37.0~37.5℃,每次持续10~16 h,连续至少72 h[14]。
四、观察指标
1.一般资料:年龄、性别、体重指数、病因、基础疾病、CRRT开始时间和总时间、腹内压等。
2.临床诊断资料:记录患者入ICU 48 h内的急性生理和慢性健康评估(acute physiology and chronic health evaluation Ⅱ,APACHEⅡ)评分、改善肾脏整体预后分级(kidney disease: improving global outcome stage,KDIGO)评分、肺损伤(lung injury score,LIS)评分以评估病情的严重程度[15-16];有无并发多器官功能障碍、不良事件(药疹、共济失调、抽搐、昏迷、焦虑、心脏骤停或其他非SAP特征或预期的不良事件)。测量粪便量,包括灌肠便和偶尔的自然排便量,其中灌肠便采用含刻度的尿壶测量便量,自然排便采用估算。
3.生物化学指标:所有患者于治疗前后空腹条件下抽取静脉血3~5 ml,离心收集血清。采用ELISA法检测血清IL-6、IL-8、肿瘤坏死因子(tumor necrosis factor,TNF)-ɑ、降钙素原(procalcitonin,PCT),所有试剂盒均购自美国Arigo公司。
五、结果判定
所有患者出院后1、3、6个月通过门诊或电话随访。主要研究终点:治疗后24 h患者腹内压变化量[8];次要终点:治疗后1~7 d粪便增加量、新出现ACS、新出现的器官功能障碍、血管并发症、ICU住院时间、总住院时间、存活率及治疗结束6个月后的治疗干预、并发症的发生。
六、统计学处理
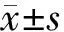
结 果
一、两组患者临床资料比较
两组患者的年龄、性别、体重指数、病因、基础疾病、CRRT开始时间和总时间、器官功能衰竭、腹内压及其分级、粪便量及APACHEⅡ、KDIGO、LIS评分差异均无统计学意义(表1),具有可比性。
式(2)中的相互作用参数αij对于DPD模拟至关重要.根据著名的Flory-Huggins理论[30]可以表示为

表1 两组重症急性胰腺炎患者临床资料的比较
二、两组SAP患者治疗期间腹内压的比较
由图1A可见,在基线腹内压相同的基础上,不同时间点研究组腹内压显著低于对照组,差异有统计学意义(F=17.980,P<0.001)。治疗前研究组与对照组腹内压分别为(16.7±2.3)、(16.4±2.1)mmHg,治疗后9 h开始下降,分别为(14.6±2.0)、(15.9±3.0)mmHg,18 h为(13.3±1.4)、(14.7±2.4)mmHg。治疗7 d(168 h)后,两组腹内压分别为(11.2±1.2)、(12.6±2.0)mmHg,与治疗前基线比较,下降显著(F值分别为5.028、7.396、23.190,P值分别为0.026、0.007、<0.001),且研究组腹内压7 d间的下降幅度显著高于对照组(F=1.757,P=0.036)。由图1B可见,腹内压>15 mmHg(Ⅱ级)时,不同时间点研究组腹内压显著低于对照组(F=11.340,P<0.001);与治疗前基线相比,两组治疗7 d后腹内压也显著下降(F=32.260,P<0.001);研究组腹内压从治疗前基线至治疗7 d间的下降差值也显著高于对照组(F=1.776,P=0.034),差异均有统计学意义。提示新斯的明联合大黄灌肠可以有效降低SAP患者的腹内压。
注:1 mmHg=0.133 kPa
三、两组SAP患者治疗前后病情严重程度评价及生物化学指标的比较
较治疗前,对照组和研究组在治疗后APACHEⅡ、KDIGO和LIS评分均显著下降,但研究组比对照组下降更明显。治疗后研究组患者血清WBC计数及炎症因子CRP、PCT、IL-6、IL-8、TNF-ɑ水平均低于对照组,差异有统计学意义(表2)。提示新斯的明联合大黄灌肠不仅改善SAP的病情,而且改善SAP相关肾、肺损伤,这种改善可能与降低炎症因子有关。

表2 两组重症急性胰腺炎患者治疗前后病情严重程度和生物化学指标比较
四、两组患者主要终点和次要终点的比较
与对照组比较,研究组在治疗24 h后腹内压变化量显著增加,在治疗1、2、3、5、7 d后粪便量也显著增加(P值均<0.05);但两组患者腹内压加重、新出现ACS、新出现的器官功能衰竭、血管并发症、ICU住院和总住院时间及存活率比较差异均无统计学意义。随访6个月后,胰腺炎再发及其治疗干预比较差异也无统计学意义(表3)。提示新斯的明的应用可明显减轻IAH,增加肠蠕动和改善肠道功能,而对患者存活率和ICU住院时间、总住院时间等作用不大。
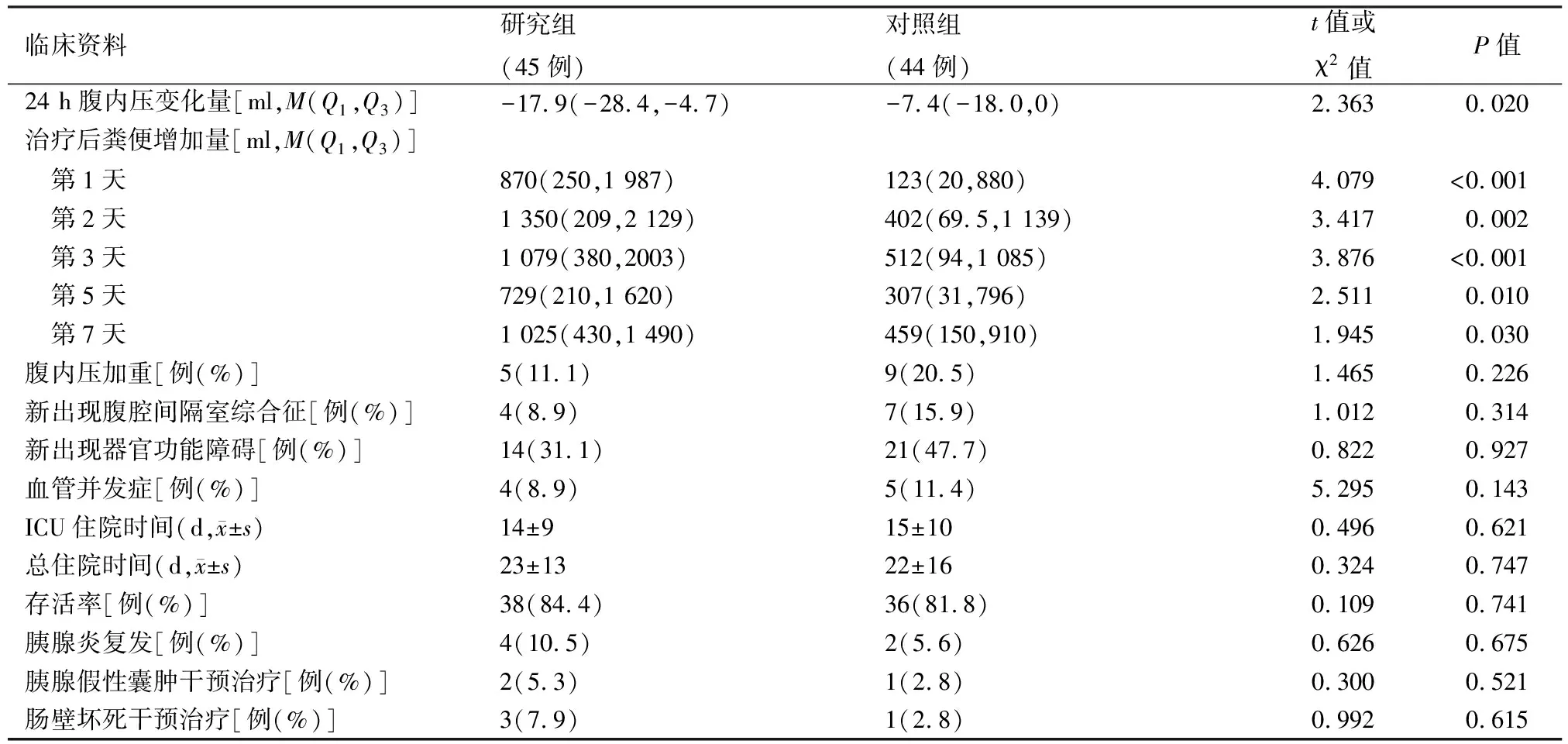
表3 两组重症急性胰腺炎患者主要终点和次要终点的比较
讨 论
新斯的明可增加胃肠动力,已被用于治疗术后胃肠动力障碍,而关于其治疗SAP胃肠动力障碍尚无证据[9]。本研究将新斯的明联合大黄灌肠用于SAP合并IAH患者,结果表明,与对照组比较,研究组在治疗24 h后腹内压变化量显著增加,且新斯的明治疗后各时间点粪便量亦显著增加,提示新斯的明有益于腹内高压的改善。这可能与其可逆性抑制胆碱酯酶有关,表现为乙酰胆碱的蕈毒碱样作用,通过增加胃肠道平滑肌的收缩频率、幅度,促进肠腔内容物的排出,从而减少腹腔内容物积聚[17]。
在评估新斯的明治疗非轻度急性胰腺炎的荟萃分析中,研究者发现,与常规治疗相比,新斯的明起效更迅速,在其给药3 h后可明显降低腹内压,24 h内腹内压下降更明显[18]。本研究结果显示,新斯的明治疗3 h后,两组患者腹内压下降不明显,治疗9 h后腹内压开始下降,治疗7 d后腹内压下降显著。一项单中心随机对照研究结果显示,在常规治疗的基础上联合新斯的明不仅能快速降低24 h内的腹内压,而且对改善Ⅱ级以上IAH的SAP患者更具优势[10]。本研究入组SAP患者的腹内压多波动在Ⅰ~Ⅱ级,其中Ⅱ级IAP患者占比为48.31%。通过比较两组Ⅱ级腹内压的SAP患者,发现与治疗前基线相比,两组治疗7 d后腹内压显著下降;与对照组相比,研究组腹内压7 d间的下降幅度明显增加。提示新斯的明联合大黄灌肠对于伴有腹内压15~20 mmHg的SAP患者降低腹内压的作用明显。
本研究还发现,与对照组相比,研究组患者的APACHE、KDIGO和LIS评分显著下降,提示新斯的明的协助治疗可间接改善SAP患者的病情程度、肾脏损伤和肺损伤。已知新斯的明通过阻断抗胆碱酯酶的活性位点,增加乙酰胆碱结合烟碱离子通道受体和毒蕈碱G蛋白受体,从而引发第二信使级联反应,作用于迷走副交感神经节前纤维,后者可发挥运动、分泌、胆碱能抗炎途径和上皮细胞修复等功能[19-20]。动物实验发现,新斯的明的应用可明显减少手术后小鼠体内炎症细胞的浸润及降低血清TNF-ɑ、CRP的水平[21]。本研究结果也显示,研究组患者血清IL-6、IL-8和TNF-ɑ的水平较对照组显著下降,提示新斯的明协助治疗可能通过减轻炎症反应减少肠道损伤,进而间接缓解SAP病情。
除肠梗阻、腹胀、炎症和肠壁水肿外,体内液体增多还可促进IAH的发生。有研究发现,新斯的明在增加粪便排出体内水分的同时,CRRT治疗中液体出入量的平衡可协助降低SAP患者的腹内压[22]。除此之外,CRRT本身可通过清除炎症递质机制改善腹内压[23]。虽然本研究采用CRRT协助调节体内液体平衡,但是仍有ACS的发生,这可能与补液类型的选择有关。乳酸林格液的应用可降低SAP的病情严重程度[24]。有研究认为,当腹内压≥20 mmHg时,SAP患者可从CRRT中受益,而当腹内压<20 mmHg时,SAP患者在CRRT治疗中的疗效尚不明确,提示腹内压的监测可能是判定CRRT治疗的指标之一[25]。
本研究样本量相对较小,可能存在选择偏倚,在今后的研究中应严格设计大样本、多中心、前瞻性研究,进而更深层次更细致地分析新斯的明的治疗效果及机制。
利益冲突所有作者声明无利益冲突
作者贡献声明赵瑞雪、王磊:参与文章的设计和构思、具体的方法;王磊:分析数据、方法总结及编辑初稿;赵瑞雪、崔娟、曹丽林:进行数据的收集及整理;赵瑞雪、曹丽林:书写初稿

