枕神经电刺激对慢性偏头痛模型大鼠疼痛相关行为的影响 *
毛静瑞 李 扬 刘颖璐 孟凡超 刘若卓 韩 珣△ 于生元△
(1 解放军医学院,北京 100853;2 中国人民解放军总医院第一医学中心神经内科医学部,北京 100853)
偏头痛是一种持续4~72 小时的中重度单侧搏动性头痛,常伴恶心呕吐、畏光畏声,以及自主神经、精神、感觉和运动功能的障碍,我国偏头痛发病率高达9.3%[1]。慢性偏头痛(chronic migraine,CM)在一般人群中的患病率为1%~3%,每年有2.5%的偏头痛病人发展为CM,CM 发作至少15 天并持续不少于3 个月,且每月头痛性质为偏头痛的天数不少于8 天,严重影响病人的生活和工作[2]。目前临床上治疗偏头痛主要是药物治疗,在最近对8500多名慢性偏头痛病人的研究中,坚持口服药物6 个月预防治疗的病人仅为25%,能坚持口服药物12个月的病人不到14%[3]。因此亟待发展有效、安全和持久的CM 非药物治疗方法。
枕神经电刺激(occipital nerve stimulation, ONS)是一种备受关注的非药物治疗方法,本团队[4]前期的一项纳入110 名受试者进行关于评估经皮ONS治疗偏头痛的研究中发现其可显著减少偏头痛病人的头痛持续时间,证实ONS 是治疗偏头痛的有效办法。植入式ONS 是一种安全而相对有效治疗慢性疼痛的方法,其植入技术难度不高,易于开展,因其长期持续治疗对慢性顽固性疼痛的治疗比经皮神经电刺激更为有效[5]。张德仁等[6]曾报道1 例植入式ONS 成功治疗顽固性枕神经痛。多项国外临床试验探究了植入式ONS 治疗CM 病人的有效性及安全性。Schwedt 等[7]提出ONS 对慢性头痛的缓解率大于50%。Saper 等[8]发表了ONS 治疗CM的前瞻性多中心随机单盲对照研究,结果表明ONS缓解CM 病人头痛发作有效率为39%。Silberstein等[9]进行ONS 治疗CM 的多中心随机双盲对照研究结果发现治疗组和对照组比较无差异。关于ONS治疗CM 长期效应的研究发现其可降低头痛发作天数和缓解头痛强度[10]。目前的临床研究对ONS 治疗CM 的有效性存在争议,且ONS 治疗的机制尚不清楚。本研究采用经证实的CM 模型来探究ONS是否改变了大鼠头面部疼痛阈值及伴随哪些相关行为学的改变,为进一步探究ONS 治疗CM 的临床实用性及ONS 作用机制探索提供思路。
方 法
1.实验材料
实验动物:雄性SPF 级Sprague-Dawley (SD)大鼠21 只,体重180~220 g,购自北京斯贝福生物技术有限公司 [许可证号SCXZ(京2019-0010)],饲养于中国人民解放军总医院SPF 级动物房,温度22~25℃、湿度40%~60%、12 h/12 h 明暗光照周期、食物和水充足。本实验过程通过中国人民解放军总医院医学伦理委员会审核,严格遵守动物实验伦理相关规定(伦审第S2021-349-02 号)。
主要实验仪器设备及耗材:vonFrey 针刺痛觉测试套件(Anesthesio,美国);在体多通道神经数据采集系统(Plexon,美国);25 μl 微量注射器(上海高鸽,平头);给药套管套装(瑞沃德,62001、62101、62201、62501)。
主要试剂及配制:5-HT (Sigma-Aldrich,H9523);前列腺素E2(麦克林,P860711);组胺 (Sigma-Aldrich);缓激肽(麦克林,B860429);PBS 磷酸盐缓冲液 (Solarbio,P1010)。用PBS 溶液溶解5-HT、前列腺素E2、组胺、缓激肽粉末,其终浓度分别为2 mM、0.2 mM、2 mM、2 mM,配制成炎症汤(inflammatory soup, IS)溶液。
2.实验方法
实验分组及流程:21 只SD 大鼠采用随机数字表法分成慢性偏头痛模型大鼠组(CM 组)、枕神经电刺激干预慢性偏头痛模型大鼠组(ONS + CM组)、对照组(Con 组),每组7 只。待大鼠适应环境1 周后制备CM 模型,在置管术恢复7 天后首先测定基线痛阈,再用Cineplex®行为分析系统采集大鼠基线行为数据15 min。第1、5、9、14 次IS输注后24 h 先进行头面部机械痛阈测定及采集大鼠15 min 行为数据,再进行下次IS 输注。于第14 次IS 输注后24 h 进行ONS 术,术后恢复24 h 后测定大鼠头面部机械痛阈及采集大鼠行为数据15 min。
CM 模型制备:三组大鼠均以3%戊巴比妥钠50 mg/kg 腹腔注射麻醉。备皮、固定及消毒。做颅顶部切口,暴露颅骨。于距前囟 + 1.5 mm、横向 + 1.5 mm 处钻一直径为0.9 mm 圆孔(避免划破硬脑膜)。将给药导管置于孔上,用牙科水泥固定(见图1),缝合切口,碘伏消毒。术后给予头孢地尼分散片(10 mg/kg)灌胃3 日,以预防术后感染发生。每只大鼠在同等条件下单笼饲养,自由进食水。术后恢复7 天后,CM 组和ONS + CM 组大鼠开始每日通过给药导管输注10 μl IS刺激硬脑膜,连续输注14 天,Con 组给予等量PBS 缓冲液。

图1 输注IS 导管置管术Fig.1 Implantation of the cannula used to infuse IS
ONS:IS 输注14 天后,ONS + CM 组大鼠禁食过夜,次日手术。刺激电极灭菌消毒。大鼠以4%异氟烷吸入麻醉成功后固定于操作台,备皮、消毒。于枕骨上缘至第3 颈椎做正中切口,暴露手术视野,使用眼科镊钝性分离肌肉,暴露枕神经。将刺激电极分别放置于两侧枕神经(见图2),切口敷以矿物油保持组织湿润。ONS:2/100 Hz,1 mA,刺激5 min,间隔1 min,共刺激3 次(15 min),电流强度以引起大鼠枕部局部肌肉收缩最小强度值为上限。缝合及术后同前。CM 组和Con 组均进行同样的手术且将电极放置于枕神经上但未进行通电。

图2 枕神经刺激电极放置术Fig.2 Electrode implantation to produce ONS
多部位分析头面部机械痛阈:疼痛阈值检测均在IS 输注后24 h 和ONS 后24 h 测定,由vonFrey纤维丝测试大鼠双侧眼眶周围、前额及枕部皮肤。纤维丝刻度范围为0.16~26 g (0.16 g、0.4 g、0.6g、1.0 g、1.4 g、2 g、4.0 g、6.0 g、8.0 g、10.0 g、15.0 g、26 g)。阳性反应为出现前爪强烈的拨去纤维丝、头部快速回缩、甩头或尖叫中任意一种。数据采用up-and-down 法计算疼痛阈值记为此次测试的疼痛阈值。无论检测疼痛阈值还是硬脑膜给药,均需要大鼠充分适应环境平静的状态下进行。
其他疼痛相关行为分析:本实验需在正常光线且安静的环境中进行,于每次IS 输注后24 h 以及ONS干预后24 h 测定,采用CinePles studio V3 记录大鼠行为15 min,采用CinePles Editor V3 分析视频数据。
观察指标:①水平运动总距离(moving distance,MD);②探索行为 (exploration behavior, EB):两后爪着地,两前爪向上或趴于笼壁,触须及口有嗅探动作;③冻结行为(freezing episode, FE):四只爪子与地板接触,触须不动;④面部梳理行为 (facial grooming):两前爪轻柔快速接触面部区域的行为模式;⑤身体梳理行为 (body grooming):两前爪、舌头或门牙接触到面部以外的身体区域;⑥同侧后爪面部梳理:置管同侧后爪强烈抓挠头面部或置管处;⑦同侧后爪身体梳理:置管同侧后爪强烈抓挠头面部以外的身体其他区域。
3.统计学分析
本研究数据使用SPSS 26.0 (IBM, Armonk, New York, USA) 统计软件进行数据分析,对数据进行正态性检验;对服从或近似服从正态分布的计量资料,采用均数±标准差进行描述,对前后测量资料,使用重复测量方差分析法,事先进行球形检验,未通过球形检验时使用Green-House 矫正法分别分析组别、时间的主效应及交互效应,后使用组单因素方差分析进行差异分析(两两比较使用LSD 法)和单因素重复测量方差分析、配对样本t检验分析组别及时间的简单效应。对未服从正态分布的计量资料,使用中位数(上四分位数、下四分位数)进行描述,使用广义估计方程分析法分析组别、时间的主效应及交互效应,后使用非参数Kruskal-Wallis 检验和Frideman 检验、符号秩检验分析组别及时间的简单效应。P< 0.05 为差异具有统计学意义,本研究均为双侧检验。图片用Graphpad prism (ver.8.0.1) 软件绘制。
结 果
1.三组大鼠不同时间点头面部机械痛阈的变化
眶周机械痛阈的变化:基线、第1 次、第5 次IS 输注后三组大鼠的眶周机械痛阈无显著差异。第9 次、第14 次IS 输注后三组大鼠间出现显著差异(P< 0.001),ONS + CM 组和CM 组机械痛阈分别较Con 组显著下降。给予ONS 后24 h,ONS + CM 组较CM 组机械痛阈显著升高(P< 0.05),但两组仍显著小于Con 组(见图3)。
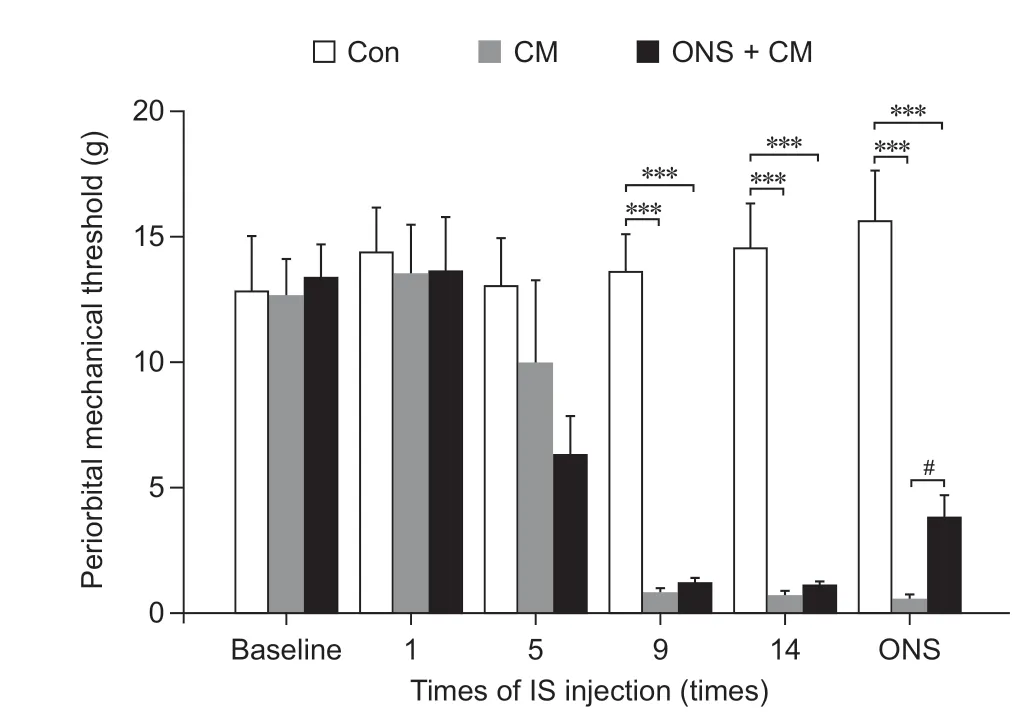
图3 三组大鼠不同时间点眶周机械痛阈比较***P < 0.001,与Con 组相比;#P < 0.05,与CM 组相比Fig.3 Comparison of periorbital mechanical threshold among three groups of rats at different time***P < 0.001, compared with group Con; #P < 0.05,compared with group CM.
前额机械痛阈的变化:基线、第1 次IS 输注后三组大鼠前额机械痛阈无显著差异,第5 次IS 输注后CM 组较Con 组显著下降(P< 0.05),第9 次、第14 次IS 输注后三组大鼠出现显著差异(P< 0.001),ONS + CM 组和CM 组分别较Con 组显著下降。给予ONS后24 h,ONS + CM组较CM组显著升高(P< 0.01),与Con 组无显著差异(见图4)。
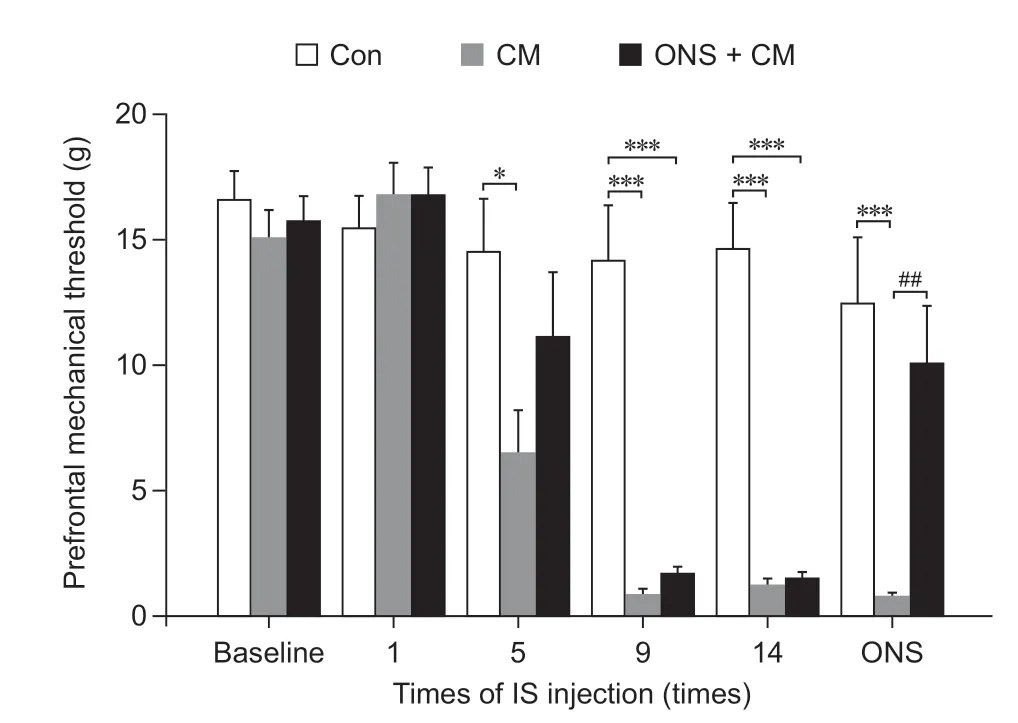
图4 三组大鼠不同时间点前额机械痛阈比较*P < 0.05,***P < 0.001,与Con 组相比;##P < 0.01,与CM 组相比Fig.4 Comparison of prefrontal mechanical threshold among three groups of rats at different time*P < 0.05, ***P < 0.001, compared with group Con;##P < 0.01, compared with group CM.
枕部机械痛阈的变化:基线、第1 次、第5 次IS 输注后三组大鼠的枕部机械痛阈无显著差异。第9 次、第14 次IS 输注后三组大鼠间出现显著差异,ONS + CM 组和CM 组分别较Con 组显著下降(P<0.01,P< 0.001)。给予ONS 后24 h,三组间无显著差异(见图5)。
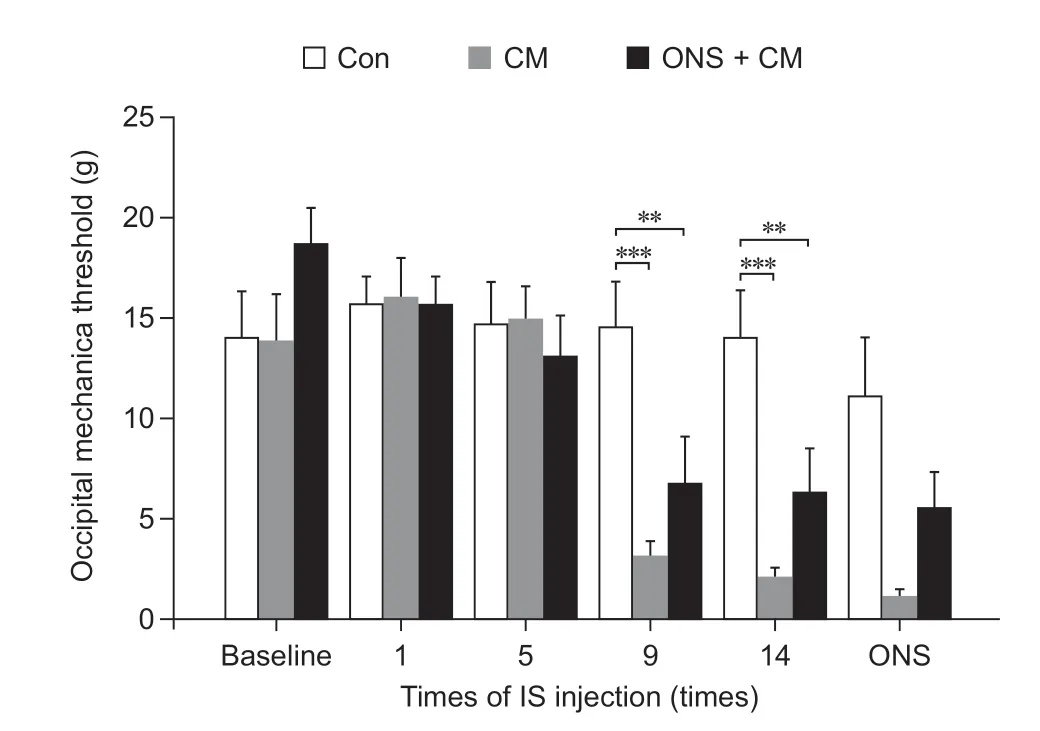
图5 三组大鼠不同时间点枕部机械痛阈比较**P < 0.01,***P < 0.001, 与Con 组相比Fig.5 Comparison of occipital mechanical threshold among three groups of rats at different time**P < 0.01, ***P < 0.001, compared with group Con.
2.三组大鼠不同时间点水平运动总距离变化
时间和组别均对大鼠MD 有显著影响且两者之间相互影响(F组别= 5.095;F时间= 53.555;F交互=5.095;P组别= 0.001;P时间= 0.001;P交互= 0.001,均成立)。①基线、第1 次IS 输注后三组大鼠的MD 差异无统计学意义;第5 次、第9 次、第14 次IS 输注后ONS + CM 组和CM 组均较Con 组显著下降;ONS 干预后,ONS + CM 组较CM 组显著增加,但显著低于Con组,CM组仍显著低于Con组(见表1、图6)。②ONS + CM 组和CM 组MD 均随IS 输注次数增加而减少,在第5 次输注后出现显著下降且持续至第14 次输注后,ONS 后ONS + CM 组MD 较ONS 前显著增加,但处于第5 次和第9 次IS 输注期间水平,未恢复至基线水平;CM 在假手术前后MD 无明显差异。Con 组大鼠MD 在第5、9、14 次输注IS 后均较基线明显下降,但其两两之间无显著差异,且假手术前后该组大鼠MD 也无明显差异(见补充表1)。
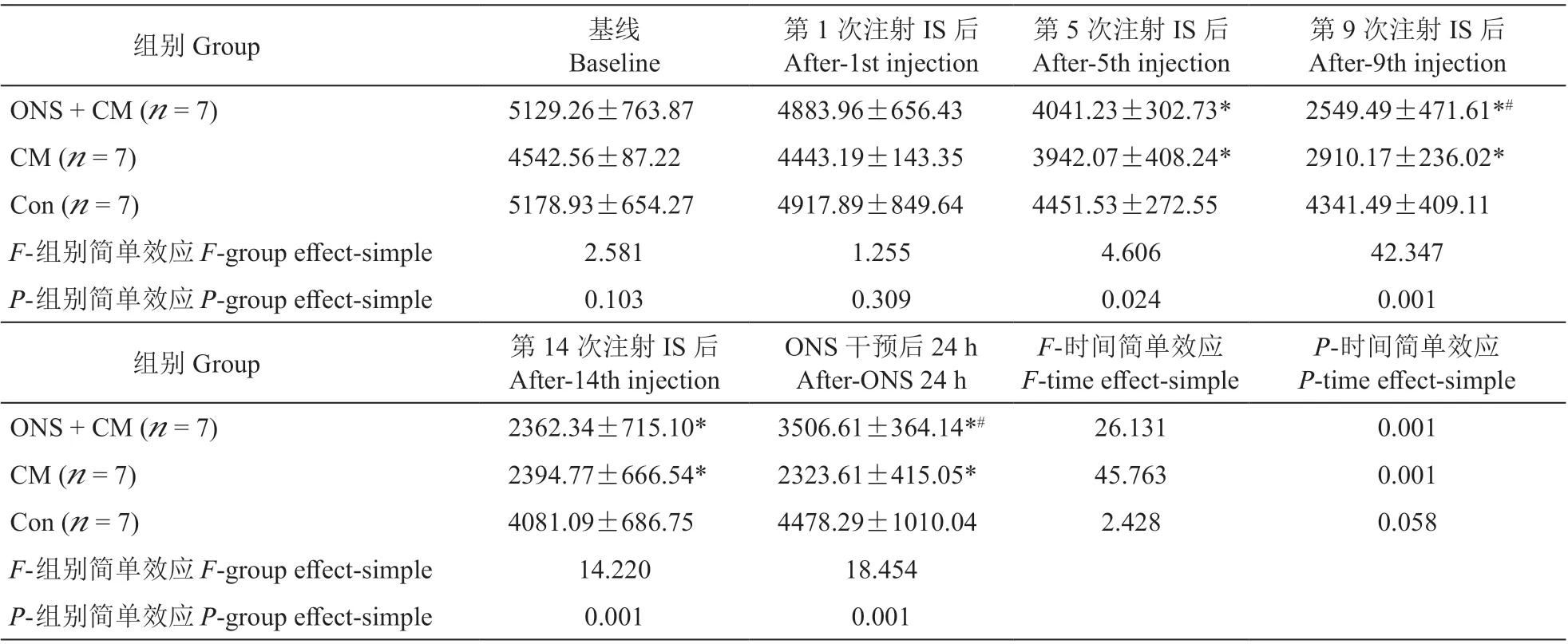
表1 三组大鼠不同时间点水平运动总距离比较Table 1 Comparison of moving distance (MD) among three groups of rats at different time
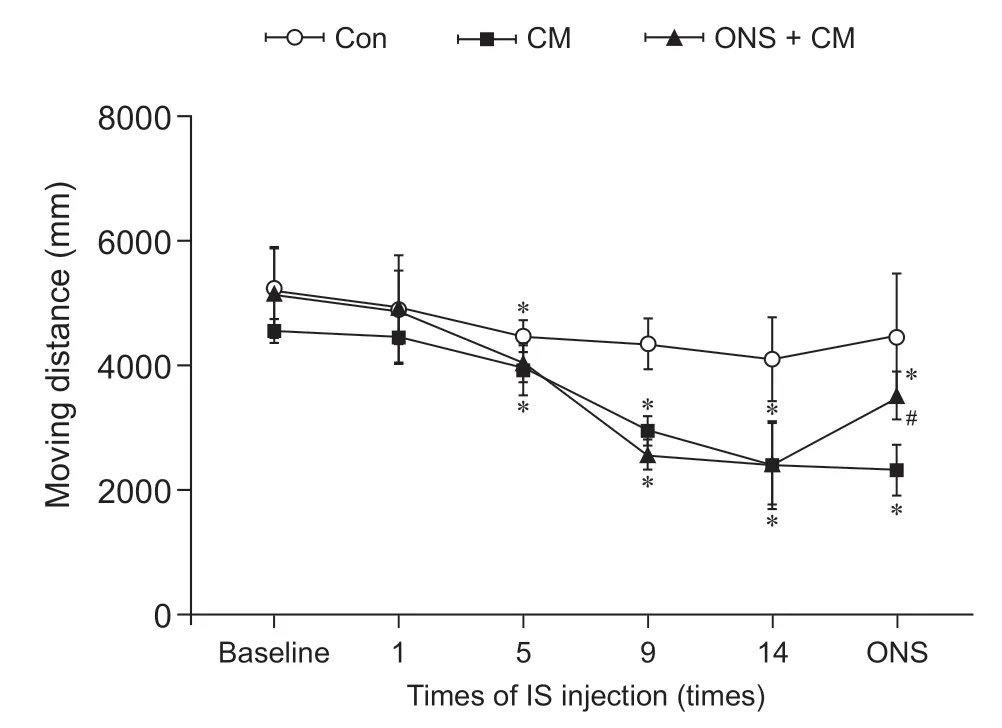
图6 三组大鼠不同时间点水平运动总距离变化*P < 0.05,与Con 组相比;#P < 0.05,与CM 组相比Fig.6 Comparison of moving distance among three groups of rats at different time*P < 0.05, compared with group Con; #P < 0.05, compared with group CM.
3.三组大鼠不同时间点探索行为变化
时间和组别均对大鼠EB 有显著影响且两者之间相互影响(F组别= 37.458;F时间= 38.718;F交互=4.266;P组别= 0.001;P时间= 0.001;P交互= 0.001,均成立)。①基线、第1 次、第5 次IS 输注后三组大鼠的EB 差异无统计学意义;第9 次、第14 次IS输注后ONS + CM 组和CM 组均较Con 组显著下降;ONS 干预后,ONS + CM 组较CM 组显著增加,但显著低于Con 组,CM 大鼠仍显著低于Con 组(见表2、图7)。②ONS + CM 组和CM 组大鼠EB 随IS 输注次数增加而减少,在第9 次IS 输注后出现差异性下降且持续至第14 次输注后,ONS 后ONS + CM 组EB 较ONS 前显著增加,但处于第5次和第9 次IS 输注期间水平,未恢复至基线水平;CM 在假手术前后EB 无明显差异。Con 组大鼠EB在第9、14 次输注IS 后均较基线明显下降,但其两两之间比较无明显差异,且假手术前后该组大鼠EB 也无明显差异(见补充表2)。
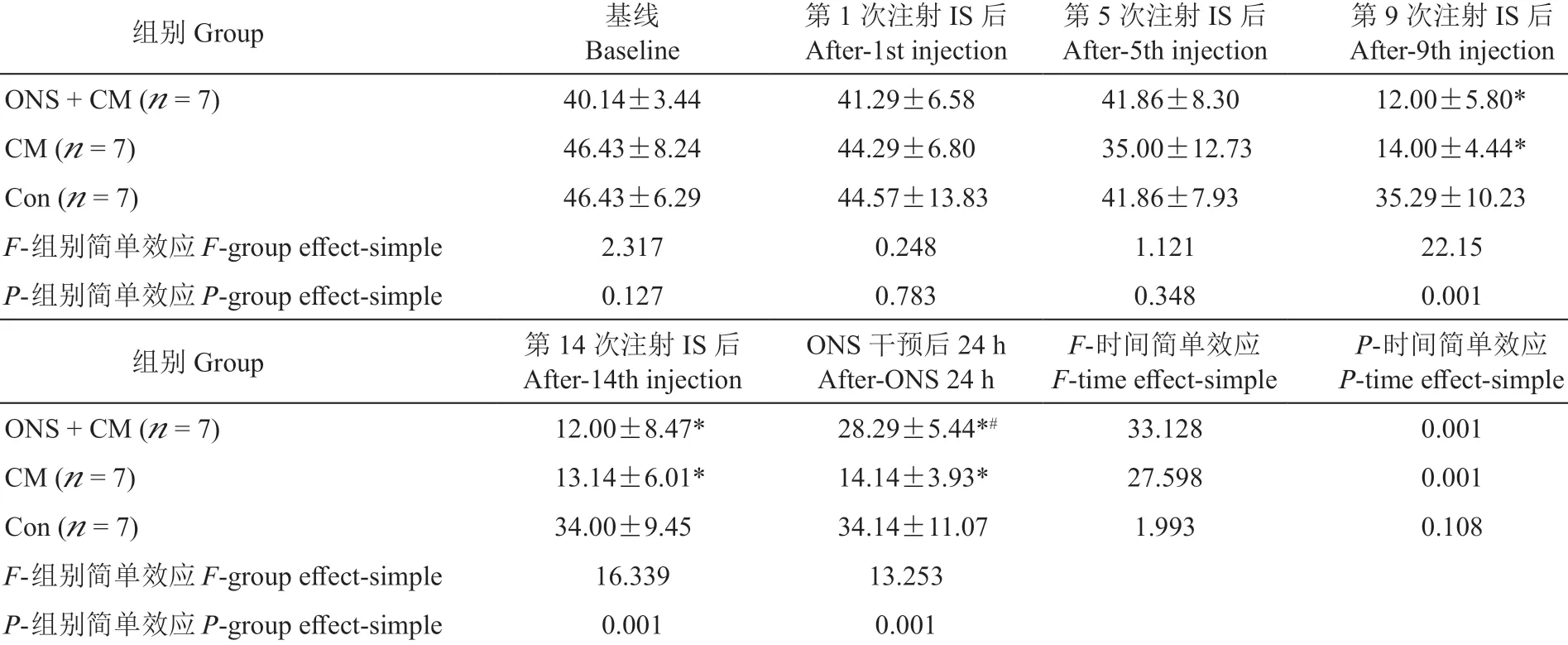
表2 三组大鼠不同时间点探索行为比较Table 2 Comparison of exploration behavior (EB) among three groups of rats at different time
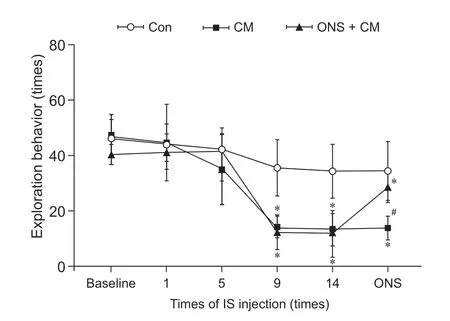
图7 三组大鼠不同时间点探索行为变化*P < 0.05,与Con 组相比;#P < 0.05,与CM 组相比Fig.7 Comparison of exploration behavior among three groups of rats at different time*P < 0.05, compared with group Con; #P < 0.05,compared with group CM.
4.三组大鼠不同时间点冻结行为变化
时间和组别均对大鼠FE 有显著影响且两者之间存在相互作用(对主效应和交互效应:=183.339;X2时间 = 554.776;= 558.831;P组别=0.001;P时间= 0.001;P交互= 0.001,均成立)。①基线、第1 次、第5 次IS 输注后三组大鼠的FE 差异无统计学意义;第9 次、第14 次IS 输注后ONS + CM组和CM 组均较Con 组显著增加;ONS 干预后,ONS + CM组较CM组显著减少,但显著高于Con组,CM 大鼠FE 仍显著高于Con 组(见表3、图8)。②ONS + CM 组和CM 组大鼠FE 随IS 输注次数增加而增加,在第9 次IS 输注后出现显著增加且持续至第14 次IS 输注后,ONS 后ONS + CM 组FE 较ONS 前显著减少,但处于第5 次和第9 次IS 输注期间水平,未恢复至基线水平;CM 在假手术前后FE 无明显差异。Con 组大鼠FE 在第9、14 次输注IS 后均较基线明显增加,但其两两之间比较无明显差异,且假手术前后该组大鼠FE 也无明显差异(见补充表3)。
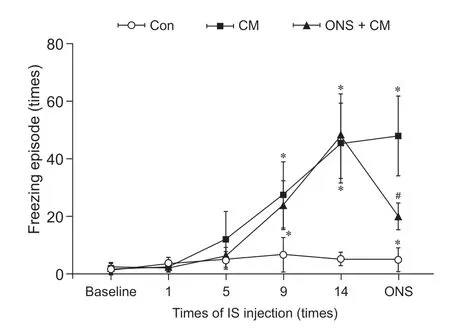
图8 三组大鼠不同时间点冻结行为变化*P < 0.05,与Con 组相比;#P < 0.05,与CM 组相比Fig.8 Comparison of freezing episode among three groups of rats at different time*P < 0.05, compared with group Con; #P < 0.05,compared with group CM.
5.三组大鼠不同时间点面部梳理行为、身体梳理行为均无显著差异(P> 0.05,见表4、5)。三组大鼠不同时间点同侧后爪面部梳理、同侧后爪身体梳理均无显著差异(P> 0.05,见表6、7)。

表4 三组大鼠不同时间点面部梳理行为比较Table 4 Comparison of facial grooming behavior among three groups of rats at different time
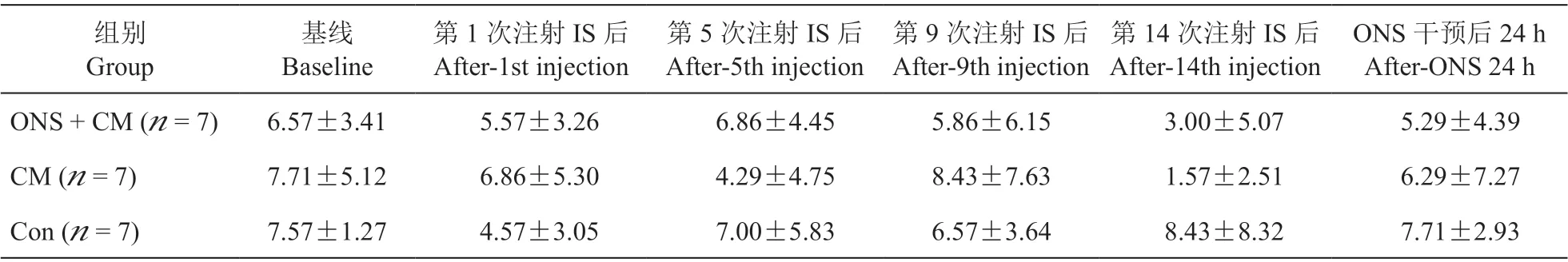
表5 三组大鼠不同时间点身体梳理行为比较Table 5 Comparison of body grooming behavior among three groups of rats at different time

表6 三组大鼠不同时间点同侧后爪面部梳理行为比较Table 6 Comparison of ipsilateral hindpaw facial grooming among three groups of rats at different time

表7 三组大鼠不同时间点同侧后爪身体梳理行为比较Table 7 Comparison of ipsilateral hindpaw body grooming among three groups of rats at different time
讨 论
本研究通过重复IS 刺激硬脑膜建立了CM 模型,探讨了ONS 对CM 模型大鼠疼痛相关行为的影响。本研究结果表明,ONS 能够逆转CM 模型大鼠头面部多部位机械痛阈降低、水平运动总距离及探索行为减少、冻结行为增多的改变。在第1 次、第5 次IS 输注后24 h 大鼠头面部机械痛阈未下降,第9 次IS 输注后24 h 大鼠头面部机械痛阈降低且可维持在较低阈值。
偏头痛的发病目前认为主要涉及三叉神经血管系统(trigemino-vascular system, TVS)激活的神经源炎症[11]。重复IS 输注刺激硬脑膜可以作用于脑膜及血管伤害性感受器,进而三叉神经通路激活,模拟头痛发作。随着头痛慢性化,TVS 外周和中枢神经元兴奋性及敏感度增强,产生痛觉敏化。临床中也观察到高达79%的偏头痛病人常在日常活动(如梳头、剃须、洗脸、戴眼镜或耳环)时感觉疼痛,尤其是头痛同侧的头皮和眶周,该现象称为痛觉超敏[12]。痛觉敏化的机制尚未清楚,涉及外周敏化和中枢敏化,外周敏化的产生主要是支配硬脑膜和颅内血管的三叉神经周围突的敏化,在偏头痛发作期间降钙素基因相关肽(calcitonin gene-related peptide, CGRP)、前列腺素E2(PGE2)、一氧化氮等炎症介质持续刺激硬脑膜及血管伤害性感受器,改变伤害感受器的细胞膜静息电位水平,使得感受器对平时无反应或者轻微反应的机械刺激产生强烈应答导致痛觉超敏现象[11]。中枢敏化主要涉及三叉神经脊束核尾侧亚核(trigeminal nucleus caudalis, TNC)、丘脑后核及丘脑腹后内侧核等脑区,该脑区敏化的神经元自发放电增多,导致皮肤感受野扩大,对头面部以外皮肤的日常活动或非伤害性刺激均会产生响应[11],此时可能出现痛觉超敏现象。另外中枢敏化与突触可塑性相关,涉及中央导水管周围灰质、岛叶、前额叶皮质等脑区神经元突触发生功能及结构可塑性改变,而使痛觉超敏现象持续存在且感受野扩大。
偏头痛病人不同的临床症状可以反映痛觉敏化的不同:①偏头痛发作时病人需避免咳嗽、弯腰等使颅内压增高的活动,可引起头痛一过性加剧(外周敏化);②偏头痛发作时非伤害性碰触头面部皮肤可引起头面部痛觉超敏现象,病人常拒绝佩戴首饰、口罩、帽子等(TNC 区敏化)[13];③偏头痛发作间期触摸躯干四肢皮肤引起该处痛觉超敏现象,病人常避免他人接触或穿紧身衣裤(丘脑敏化)[13]。本研究表明,对已经出现痛觉超敏现象的大鼠行ONS 后头面部的机械痛阈下降有所改善。ONS 是一种用于治疗慢性疼痛的神经调制方法[4],但ONS治疗偏头痛的临床疗效存在差异。药物治疗方法通常在偏头痛病人出现痛觉超敏现象前使用效果更好[12],当偏头痛病人出现痛觉超敏现象后治疗效果欠佳。ONS 治疗CM 的机制尚不清楚,但可能与周围神经、上段颈髓及与三叉神经脊束核复合体(trigeminocervical complex, TCC)有关,TCC 由三叉神经脊束核尾侧亚核和上颈段脊髓背侧角组成,收集来自不同皮肤、肌肉、硬脑膜和内脏三叉神经和枕神经分布区的传入冲动[14]。朱品欢等[15]在偏头痛模型大鼠中观察到C1~C2后角小胶质细胞明显被激活。姚军等[16]通过临床观察发现C2和C1脊神经节阻滞治疗颈源性头痛时可以改善以枕部、顶部、颞部疼痛为主病人的疼痛程度。ONS 是否能通过枕神经传入影响C2后角小胶质细胞而发挥镇痛作用将是一个研究热点。在一项临床研究中,对8 例正在进行ONS干预的病人进行PET 扫描发现TCC 区神经元明显被激活[8]。考虑可能是ONS 暂时干扰TNC 区敏化,这将有助于我们在下一步实验中对ONS 作用机制进一步研究。目前最为认可的ONS 作用理论是疼痛闸门控制机制,传导外周触压觉的Aβ纤维兴奋能抑制传导痛温觉的C 纤维传递兴奋信号,这两类纤维都可把兴奋性刺激传至脊髓后角的T 细胞,同时也与其周围胶质细胞发生突触联系。胶质细胞能抑制传入T 细胞的疼痛刺激向上传递,而从Aβ纤维或C 纤维而来的刺激分别增强或抑制胶质细胞对疼痛传导的抑制作用[17]。Vincent 等[18]研究证明与未受ONS 干预的大鼠相比,ONS 干预后大鼠颈静脉血和眼球血中的CGRP 表达显著降低,因此ONS作用是否与GGRP 有关,待进一步研究。
本研究结果证明,CM 模型大鼠水平运动总距离和探索行为减少而冻结行为增加的改变,在前期IS 输注后24 h 大鼠的上述行为无明显改变,后期多次IS 输注后24 h 大鼠水平运动总距离和探索行为减少,冻结行为增加,该种行为改变发生在大鼠头面部机械痛阈维持于较低阈值,即痛觉超敏现象持续存在时,这可能是CM 组及ONS + CM 组大鼠因痛觉超敏现象而产生回避运动行为。同样临床上病人偏头痛发作时也伴有“不愿活动、喜休息、喜保持固定姿势”的行为样改变,仅低头或转头等日常活动就会加剧偏头痛,因此,在偏头痛发作时病人可因回避头部活动而出现回避运动的行为[19]。运动回避尤其是头部运动回避的机制涉及脑膜、颅内血管或前庭器官,已知脑膜血管周围神经源性炎症是偏头痛发作的一部分,脑膜刺激通常会导致运动不耐受,特别是引起头部颠簸的活动,这可能是由于痛觉超敏结构的易感性增加所致[19]。CM 病人活动度降低,这可能导致长期运动回避行为的迹象,类似于本研究的实验结果。病人因害怕而避免引起或加重疼痛的运动因素,长期回避运动会导致慢性肌肉骨骼痛、慢性腰痛和纤维肌痛[20],而疼痛反过来又维持和加剧慢性疼痛,这又是一个全新的研究领域。
本研究结果表明,Con 组大鼠也出现水平运动总距离和探索行为减少而冻结行为增加的改变。实际操作中,Con 组大鼠每日也受到了导管给药操作的应激,只是在应激后没有持续的头痛,这种温和的应激对于大鼠产生了一定程度的影响,并且由于给药管的固定问题,需要大鼠孤笼饲养,这种缺乏社交的饲养环境对于大鼠来说也是一种负面事件。另外,在大鼠抑郁行为检测的实验中也发现抑郁会导致运动总距离缩短,探索行为减少[21]。有关情绪障碍的研究高度一致地报道了在偏头痛人群中重症抑郁的患病率增高。情感障碍是偏头痛慢性化转变的一项危险因素[22]。在本研究中大鼠水平运动总距离、探索行为改变出现在痛觉超敏现象持续存在即大鼠发生偏头痛慢性化之后,因此大鼠行为结果变化的影响因素是否涉及抑郁等情绪障碍有待进一步探索。本研究表明,ONS 不仅可以改善CM 模型大鼠的痛觉超敏现象,还可以逆转其他疼痛相关行为的改变,其中常用于评价动物模型抑郁行为的探索行为、运动距离也发生变化。近年来偏头痛逐渐被认为是一种脑功能障碍疾病,基于全脑体素的形态测量研究显示偏头痛病人皮质体积显著减少[23],与情绪障碍相关的脑区常涉及前额叶皮质、岛叶、海马等大脑皮质。因此,ONS 是否可通过影响大脑皮质而引起CM 大鼠疼痛相关行为改变有待进一步研究。
本研究不足之处:本研究表明单次ONS 可以改善CM 模型大鼠疼痛相关行为改变,但单次ONS效果的持续时间及多次ONS 是否会更有效仍待研究。下一步将采用植入式电极来探究不同模式ONS的治疗效果。另外,三组大鼠不同时间点同侧后爪面部梳理行为、同侧后爪身体梳理行为无显著差异,但Melo-Carrillo 等[24]的研究表明输注IS 后45 min内该组大鼠较对照组大鼠同侧后爪梳理行为显著增加。分析本研究与此不一致的原因:①本团队前期实验表明单次给予IS 后30 min,面部机械痛阈显著下降,3 h 降至最低,5~6 h 恢复至初始水平,则每次输注IS 相当于CM 背景上的更剧烈的急性发作,所以IS 注射后即刻单侧梳理行为增加,而在IS 注射后的24 h 该行为在三组间无明显差异;②考虑多次重复IS 注射后大鼠冻结行为增加活动度减少,单侧梳理行为受影响。因此我们将在后续实验中增加检测行为的时间点,进一步探究出现不同实验结果的原因。
综上所述,目前临床研究提示ONS 是一种治疗CM 的可行方法,但ONS 治疗CM 的机制未明。本研究表明ONS 可改善CM 大鼠头面部机械痛阈降低、水平运动总距离和探索行为减少、冻结行为增加的现象,进一步证实了ONS 改善CM 的有效性,可采用该动物模型进一步探索ONS 发挥作用的机制。
利益冲突声明:作者声明本文无利益冲突。

