猪繁殖与呼吸综合征病毒的检测方法
文│李兴帅 张兴林 牛建蕊(临沂大学)
左海莉(内蒙古自治区包头市九原区畜牧水产服务中心)
臧京帅(北京森康生物技术开发有限公司)
猪繁殖与呼吸综合征(Porcine reproductive and respiratory syndrome,PRRS)是危害当今养猪业的主要疫病之一,给世界养猪业造成巨大的经济损失。自1995年传入至今,我国几乎所有的省市都有PRRS的发生。流行病学和血清学调查结果表明,我国猪繁殖与呼吸综合征病毒(PRRSV)的感染率非常高。PRRSV还是猪呼吸道疾病综合征(PRDC)的一个主要原发性病原。在饲养管理水平低、卫生条件差的猪场常与PCV2、猪肺炎支原体、副猪嗜血杆菌、巴氏杆菌、猪伪狂犬病毒、猪附红细胞体、链球菌等混合或继发感染,这样的猪群死亡率高,且多数猪场伴发母猪繁殖障碍。PRRSV感染后引起的病理及组织学变化往往不易与其他传染病区分,所以PRRS的确诊必须依赖于实验室手段。与传统诊断方法相比,荧光定量PCR检测技术具有很多突出的优点,引物与探针可以大量合成并长期保存,检测速度快(仅需2~4小时),结果可靠,不易污染,避免散毒,而且敏感性要高于常规的PCR检测方法,通过探针设计还能区分不同的毒株亚型,因而具有广阔的应用前景。因此,本研究拟采用TaqMan荧光RT-PCR方法建立敏感性、特异性较好的PRRSV(美洲型)的检测方法。
一、材料与方法
1.材料和主要试剂。
(1)菌毒株和质粒。PRRSV美洲经典毒株VR-2332、PRRSV欧洲型毒株LV、猪伪狂犬病毒(PRV)、猪瘟病毒(HCV)、猪圆环病毒2型(PCV2)、猪链球菌(SS-2)、猪弓形体(TOX)、pGEM-T载体和TOP10感受态细胞均由本实验室保存。
(2)病料来源。采集某发病猪场6头病死猪不同组织脏器(包括肺、淋巴结、肝、肾、脾和猪肉等)。
(3)主要试剂。Taq DNA聚合酶、反转录酶M-MLV、RNA酶抑制剂、病毒RNA提取试剂盒、基因组提取试剂盒、体外转录试剂盒、DEPC水等试剂为南京诺唯赞公司产品;DTT为sigma公司产品。
2.引物和探针设计。选择PRRSV(美洲型)N基因和3'端非编码区的特定序列作为靶区域,在多重序列比对的基础上,进行引物和探针设计,序列如下:
上游引物:5'-GCATGATGGGCT GGYATTC-3';
下游引物:5'-CCCACACGGTCG CCCTAAT-3';
探针:5'-[FAM]-ATGTGTGG TKAAYGGCACTGATTGACA-[TAM RA]-3'。
3.阴性对照和阳性对照的制备。
(1)阴性对照。阴性对照为PRRSV(美洲型)阴性猪组织样品。用0.01摩尔/升的pH=7.2 PBS缓冲盐水制成20%悬液,高压灭菌后分装用作阴性对照。
(2)阳性对照。阳性对照为体外转录的非感染性RNA片段。将RTPCR扩增获得的PRRSV美洲经典毒株VR-2332长度为1640bp的ORF5-3'UTR基因克隆于pGEM-T载体,转化TOP10感受态细胞,提取质粒DNA,经PCR鉴定后获得阳性重组质粒。酶切线性化之后,进行体外转录;将体外转录产物用DNase除去DNA模板后经病毒RNA试剂盒提取并测定,即得到制备PRRSV(美洲型)阳性对照品所需的母液,阳性对照的浓度约为106拷贝数。

◎图1 灵敏度检测结果和标准曲线
4.菌毒株、病料中病毒核酸的提取。使用病毒DNA/RNA提取试剂盒分别提取PRRSV美洲型经典毒株VR-2332、PRRSV欧洲型毒株LV、PRV、HCV、PCV2的病毒核酸;使用细菌DNA提取试剂盒提取SS-2、TOX的核酸。核酸溶于20微升DEPC水中,-20℃冻存备用。
5.荧光RT-PCR反应体系和扩增条件。本研究建立25微升的反应体积,使用的模板为1.3.2阳性对照品母液,并根据试验具体需要进行101~106的10倍稀释。引物浓度从0.2~0.8微米以0.2微米为间距递增,探针浓度0.2微米和0.1微米两个梯度进行优化,扩增条件为42℃/30分钟;92℃/3分钟;92℃/10秒,55℃/10秒,72℃/30秒,40个循环,每次循环的退火延伸时收集荧光。
6.灵敏度和特异性试验。将灭活的PRRSV VR-2332(10-4.75TCID50/0.1毫升)作10倍稀释后,提取病毒核酸后进行荧光RT-PCR的检测,评价检测方法的灵敏度,为实现对临床样品中病毒RNA量的相对定量,我们进一步对连续10倍稀释的病毒RNA样品进行检测,采用荧光PCR仪软件对Ct值和样品中病毒RNA的量进行线性回归分析,建立标准曲线,计算相关系数;对PRRSV(美洲型)、PRRSV(欧洲型)和PRV、HCV、PCV2、SS-2、TOX等常见猪病原进行荧光RT-PCR的检测,评价其特异性。
7.临床样品的检测。使用PRRSV(美洲型)RT-PCR检测某发病猪场6头病死猪(标记为1、2、3、4、5、6)不同的组织脏器(肺、淋巴结、肝、肾、脾和猪肉等)载毒量情况并进行分析。
二、结果
1.荧光RT-PCR反应体系的优化。最优荧光RT-PCR反应体系为2.5毫米dNTP2微升、上游引物(10微米)0.5微升、下游引物(10微米)0.5微升、探针(10微米)0.25微升、5×缓冲液(pH=9)5微升、25毫米MgCl2 2微升、Taq酶(5单位/微升)0.5微升、MLV反转录酶(200单位/微升)0.5微升、RNA酶抑制剂(40单位/微升)0.25微升、模板10微升,补DEPC处理水至25微升。
2.灵敏度分析。对灭活的P R R S V V R-2 3 3 2 细胞毒培养物(10-4.75TCID50/0.1毫升)作10倍系列稀释后进行检测,检测极限为105倍稀释,近1个TCID50;对Ct值和样品中病毒RNA的量进行线性回归分析,建立标准曲线,结果显示病毒RNA的量与试验测得的Ct值呈线性相关,R2=1,表明建立的方法可用于病毒RNA相对定量。结果数据详见图1。
3.特异性分析。对PRRSV(美洲型)、PRRSV(欧洲型)和PRV、HCV、PCV2、SS-2、TOX等常见猪病原进行荧光RT-PCR的检测,由图2可知,建立的方法与欧洲型PRRSV和其他细菌病毒均无交叉反应,特异性良好。
4.临床样品的检测结果。病死猪的检测结果详见表1。由于本方法可以对病毒RNA进行相对定量,根据标准曲线Y=-3.659X+35.08(X代表Ct值,Y代表病毒RNA的相对含量),可知Ct值越小,病毒含量相对越高。由表1可知,感染PRRSV(美洲型)后,同一头猪的不同组织脏器中的含毒量不同。综合分析发现,各组织中含毒量由高到低排序为肺、脾、肾、淋巴结、肝、猪肉。
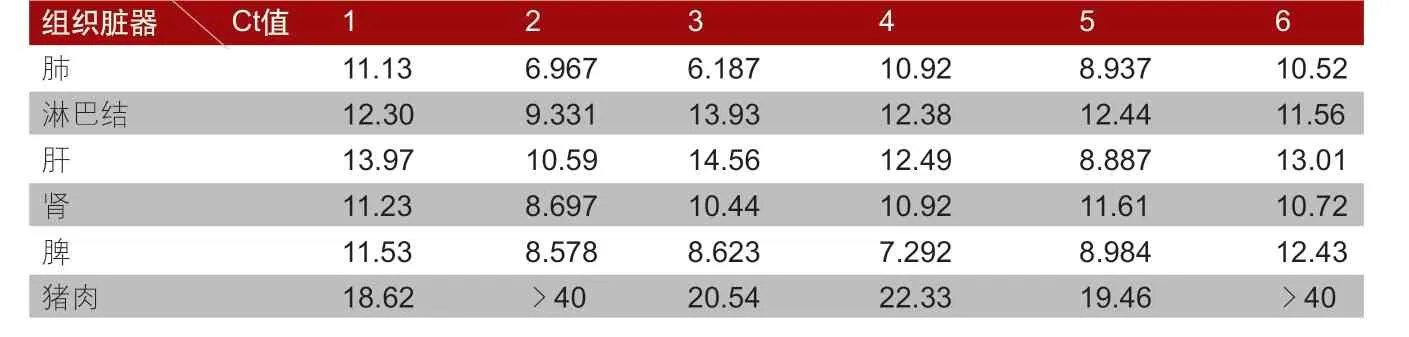
表1 临床样品的检测结果
三、讨论
PRRSV分为美洲型和欧洲型两种亚型,其核酸序列中最保守的区域是ORF1b和ORF7序列,很多学者根据这两段保守性序列进行引物设计,建立了荧光RT-PCR检测方法,并且通过设计不同的引物进行通用型检测(同时检测美洲型PRRSV和欧洲型PRRSV)或者特异性检测(仅检测其中一种病毒)。我国目前流行的PRRSV主要是美洲型病毒,因此,我们建立了特异性检测美洲型PRRSV的荧光RT-PCR快速检测技术。
在本研究中,通过对30多株在我国流行美洲型PRRSV序列的比对,在保守性核酸片段PRRSV N基因(ORF5)和3'UTR为靶序列基础上设计合成了一对引物和探针,发现这对引物和探针扩增效率佳。使用建立的方法对常见的猪呼吸道疾病和繁殖障碍类疾病病原进行特异性试验,检测结果显示,建立的PRRSV美洲型荧光RT-PCR方法检测PRRSV(欧洲型)和PRV、HCV、PCV2、SS-2、TOX等猪常见的病毒细菌病均为阴性,说明该方法与其他病原无交叉反应,特异性良好。对PRRSV美洲型毒株VR-2332,应用建立的方法通过对倍比稀释的细胞毒培养物进行检测,结果表明,本方法的灵敏度可达1个TCID50。对临床已知样品的检测结果也表明,荧光RTPCR方法检测效果好,并且能检测出猪肉中的微量RNA病毒。
本研究建立了特异性检测美洲型PRRSV的荧光RT-PCR快速检测技术,其引物探针保守性很高,能快速、准确、特异性地检测临床样本中的PRRSV,还可以检测病死猪肉中的微量PRRSV,在疫病防控和猪肉产品安全执法检验中具有重要意义。同时可对猪场实时监测,并有助于我国控制和净化PRRS。

