脑卒中后昼间嗜睡与患者睡眠呼吸障碍的相关性研究
王文熠,陈光
昼间嗜睡(excessive daytime sleepiness,EDS)是脑卒中患者常见的睡眠障碍,脑卒中后继发EDS 会显著影响患者认知功能和神经功能,降低患者生活质量[1]。研究显示,原发性EDS 是脑卒中的独立危险因素,与大动脉卒中风险呈正相关[2]。脑卒中患者如合并EDS 会增加卒中复发风险,不利于患者的康复和远期预后。睡眠呼吸障碍(sleep disordered breathing,SDB)为脑卒中患者另一种常见的睡眠障碍类型,也是脑卒中的独立危险因素,其往往与EDS伴随出现,但二者关系尚不明确。部分研究显示,SDB 和EDS 在脑卒中人群中相互影响,且SDB 是导致脑卒中患者发生EDS的主要因素之一[3-4];而另一部分研究者则认为SDB 和EDS 相对独立、无明显相关性[5-6]。既往有关SDB 和EDS 的研究多以SDB 严重程度作为分组依据,鲜见以EDS 为分组依据的研究。本研究探讨脑卒中后合并EDS患者昼间嗜睡症状和睡眠呼吸障碍情况,分析两者之间的相关性,以期明确卒中后EDS的临床特点和相关影响因素。
1 对象与方法
1.1 研究对象 回顾性分析2020 年6 月—2022 年6 月于天津中医药大学第一附属医院针灸临床部诊治的脑卒中患者148 例,男112 例,女36 例,年龄32~82 岁,平均(60.28±11.06)岁。脑卒中符合《中国各类主要脑血管病诊断要点2019》的诊断标准,EDS 及SDB 的诊断依据美国睡眠协会标准[7-8]。纳入标准:首次脑卒中发作,或既往有脑卒中病史但未遗留睡眠障碍的新发脑卒中患者;无智力、语言理解和表达障碍,能独立完成量表测评,接受多导睡眠呼吸监测(polysomnography,PSG)检查,且临床病历资料完整者。排除标准:既往有睡眠障碍、焦虑、抑郁或精神障碍者;过敏体质者,伴有严重肺部感染,心、肝、肾功能衰竭,肿瘤,造血系统或内分泌系统等严重原发性疾病者;入院前已应用抗抑郁药、抗焦虑药或安眠药治疗者。本研究已经天津中医药大学第一附属医院医学伦理委员会批准(批件号:TYLL2022[K]字006)。因本研究为回顾性研究,所有患者免除知情同意。
1.2 分组 参照文献[7-8],以Epworth嗜睡量表(ESS)对嗜睡程度进行评估,量表评分0~24分。根据得分将患者分为EDS组(ESS>7分)69例和非EDS组(ESS≤7分)79例。
1.3 观察指标 (1)一般资料。所有患者记录病史与基本资料,包括性别、年龄、体质量指数(BMI)、脑卒中病程、脑卒中类型、高血压病史等。(2)实验室检查。空腹8 h 抽取上肢静脉血5 mL,采用日立7600 全自动生化分析仪。总胆固醇检测试剂盒(CHOD-PAP)检测血清总胆固醇(TC)、胆固醇氧化酶(HMMPS)法检测三酰甘油(TG)、过氧化氢酶清除法检测低密度脂蛋白胆固醇(LDL-C)、直接检测法检测高密度脂蛋白胆固醇(HDL-C)。(3)多导睡眠呼吸监测。仪器采用德国SOMNOmedics Gmbh 公司生产的睡眠记录仪(型号:SOMNOtouch RESP;医疗器械注册证编号:国械注进20172215048)。所有患者进行13导联多导睡眠呼吸监测(包括3 个EEG 通道,2 个眼电图和双腿胫骨前部肌电图),于受试者日常夜间睡眠开始前30 min测量,持续时间常规设定为8 h,不足8 h者以受试者次日早晨起床时间为准。收集并计算受试者睡眠相关数据:血压指标包括夜间平均收缩压及舒张压,睡眠呼吸障碍指标包括低通气指数(AHI)、氧减指数(ODI)、氧饱和度<90%的睡眠时间(T90)、夜间最低血氧饱和度、觉醒指数(RAI)、打鼾指数(打鼾次数/睡眠时数),睡眠结构指标包括睡眠效率(总睡眠时间/卧床时间)、不同睡眠分期(N1、N2、N3、REM)比例、睡眠潜伏期、快速动眼睡眠(REM)潜伏期。其中AHI=(呼吸暂停次数+呼吸减弱次数)/睡眠时数,ODI=氧减次数(SPO2下降≥3%的次数)/睡眠小时数,RAI=觉醒次数/睡眠小时数。
1.4 统计学方法 采用SPSS 20.0软件进行数据分析。符合正态分布的计量资料以±s表示,2组间比较采用2独立样本t检验;非正态分布的计量资料采用中位数与四分位数M(P25,P75)表示,2组间比较采用Mann-WhitneyU检验;计数资料以例或例(%)表示,组间比较采用χ2检验;采用Spearman 相关分析EDS 与SDB 发病率的相关性;采用二元Logistic 回归模型分析脑卒中患者发生EDS的影响因素。以P<0.05为差异有统计学意义。
2 结果
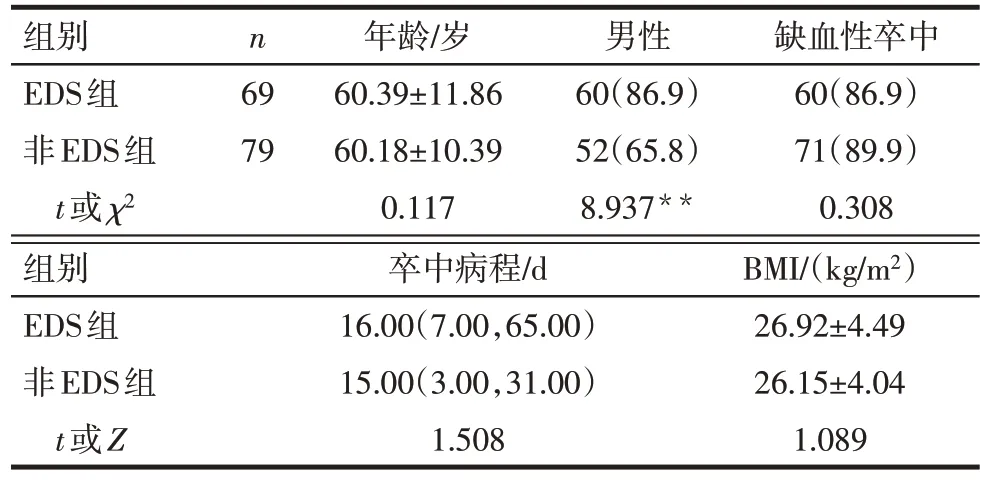
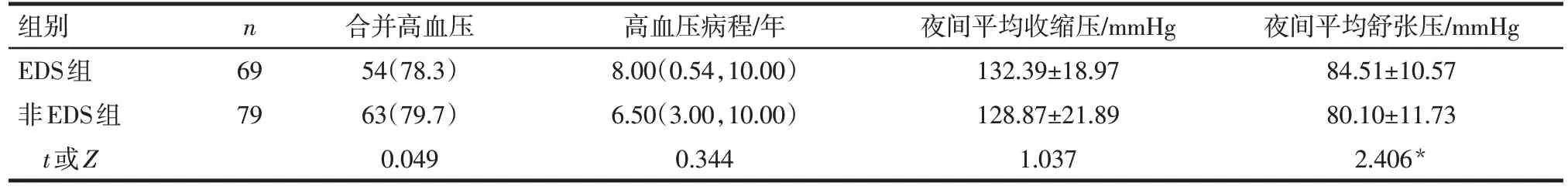
2.1 脑卒中后影响EDS 的单因素分析 EDS 组男性比例、夜间平均舒张压、AHI、ODI、N1睡眠期比例高于非EDS组(P<0.05),其他指标差异无统计学意义,见表1—5。
Tab.1 Comparison of general information between two groups表1 2组一般资料比较

Tab. 2 Comparison of biochemical indicators between two groups表2 2组生化指标比较
Tab.3 Comparison of blood pressure indicators between two groups表3 2组血压指标比较

Tab.4 Comparison of SDB indicators between two groups表4 2组睡眠呼吸障碍指标比较

Tab.5 Comparison of sleep structure between two groups表5 2组睡眠结构比较
2.2 卒中患者EDS和SDB发病的关联度分析 EDS和SDB呈正相关性,差异有统计学意义,见表6。

Tab.6 Correlation analysis of EDS and SDB in stroke patients表6 卒中患者EDS和SDB发病的关联度分析
2.3 脑卒中后EDS 影响因素的多因素分析 以是否合并EDS(是=1,否=0)为因变量,以性别(女=0,男=1)、AHI、ODI、N1 睡眠期比例、夜间平均舒张压为自变量,多因素Logistic回归分析结果显示,男性、较高水平的AHI和夜间平均舒张压是卒中后EDS的独立危险因素(P<0.05),见表7。

Tab.7 Logistic regression analysis of influencing factors of EDS after stroke表7 脑卒中后EDS影响因素的多因素Logistic回归分析
3 讨论
研究显示,脑卒中急性期患者EDS 发病率为28%~49.5%,其中约34%的患者会遗留EDS 超过6个月以上[3,9]。一项纳入了17项研究、共纳入13 909例受试者、平均随访5.4 年的荟萃分析[10]显示,EDS是脑卒中、心血管疾病死亡和成年人群心脑血管疾病全因死亡的独立预测因子。一项针对我国东部农村老年人口的流行病学研究[11]也显示,合并EDS 会使脑卒中风险上升0.32 倍(OR:1.32,95%CI:1.01~1.72)。EDS 与脑卒中的关系是双向的,EDS 既是脑卒中发病的危险因素,也可由脑卒中所引起。脑卒中后继发EDS 会显著影响患者认知功能和神经功能,降低生活质量,增加卒中复发风险[1]。本研究结果显示,脑卒中患者中EDS 的发生率为46.6%(69/148),卒中后EDS组男性比例较非EDS组高,且男性是脑卒中后EDS 发病的独立危险因素,与文献[12]研究结论相近,证实了EDS存在性别差异。
人体昼夜血压的“非杓形”节律,特别是夜间血压升高是心脑血管疾病的危险因素。笔者既往研究显示,与单纯脑卒中相比,合并EDS的卒中患者夜间收缩压及舒张压均升高,脑卒中合并EDS 患者的ESS评分与其收缩压节律及舒张压节律的非杓形程度呈正相关[13]。本研究因监测时间段仅限于睡眠时间,无法计算昼夜血压节律,但EDS组患者的夜间平均舒张压亦高于非EDS 组,且夜间平均舒张压升高是卒中后EDS 的独立危险因素,证实了卒中后EDS与夜间血压异常有关。
SDB作为另一种临床常见的睡眠障碍和脑卒中影响因素,经常与EDS伴随出现[14-15]。长期以来,多数相关研究的重点都放在如何治疗SDB以改善脑卒中患者预后及预防复发上。然而,相关研究显示,与常规治疗相比,作为SDB 一线治疗手段的持续气道正压通气治疗(CPAP)对卒中患者的认知能力、嗜睡、抑郁症状和日常生活能力等并无明显改善[16]。鉴于脑卒中后并发的非SDB睡眠障碍对于脑卒中预后的不良影响,有关SDB与其他睡眠障碍,特别是与EDS 的相互作用研究成为热点。大部分研究认为,在一般人群中EDS 与SDB 密切相关[17],SDB 所导致的发作性、间歇性缺氧对EDS发病有重要影响[18-19]。但在脑卒中人群中,不同的研究得出的结论却存在矛盾[3-6]。究其原因,可能与各个研究之间纳入及分组标准不同,以及对EDS 的定义和评估方法尚无一致性共识有关。本研究采用目前国际上应用广泛、认可度高的ESS嗜睡量表和多导睡眠呼吸监测作为诊断和评估手段,以求对EDS 和SDB 诊断与评估的规范化。既往研究多依据SDB严重程度对患者进行分组,并限定脑卒中急性期患者,或将一般人群作为对照组。而本研究纳入病例皆为脑卒中患者,依据是否合并EDS 对患者分组,且考虑到EDS 在脑卒中急性期及后遗症期均可出现,并未限制脑卒中病程(2组病程差异并无统计学意义)。作为诊断和评估SDB最主要临床表现(睡眠呼吸暂停和低氧血症)的指标,AHI 和ODI 是衡量SDB 严重程度的重要客观依据[8]。本研究结果显示,与非EDS组相比,EDS组患者的SDB 病情更为严重(AHI、ODI 上升),脑卒中患者EDS 和SDB 的发病率呈正相关性,AHI 升高是脑卒中后EDS 的独立危险因素,再次证实脑卒中后EDS 与SDB 的严重程度存在相关性,考虑作用机制可能是卒中导致脑灌注减少和大脑呼吸中枢受损,进而出现了节律性呼吸和夜间低血氧为主要症状的SDB。相关研究亦证实,SDB可造成睡眠破碎、夜间觉醒增多和交感神经亢进,对卒中后EDS 的产生有重要影响[20]。
脑卒中会对睡眠结构造成不良影响。研究显示,脑卒中急性期患者会出现总睡眠时间和REM睡眠时间减少、REM 潜伏期延长及睡眠效率下降现象,且REM潜伏期延长是脑卒中不良预后的独立危险因素[21]。本研究显示,EDS组患者较非EDS组N1睡眠期增加,提示脑卒中合并EDS 患者的睡眠结构受损程度较非EDS者更大。而另外一项针对非卒中SDB人群的研究却显示是否合并EDS对睡眠结构的各项参数没有影响[18]。这说明在有脑卒中是原发病时,EDS与SDB的相互作用可能有着不同的特点,可能是因为脑卒中与SDB 对睡眠结构的影响相互叠加,从而导致EDS 患者睡眠-觉醒稳态进一步紊乱。动物研究显示,缺血性卒中小鼠模型的睡眠稳态遭到破坏,在常规活跃时间段表现为过度嗜睡,非REM 睡眠增加、睡眠潜伏期和REM 睡眠时间减少,而在非活跃时间段则表现为睡眠潜伏期增加和睡眠效率的下降[22]。本研究显示,脑卒中后EDS 患者较之单纯脑卒中患者,其睡眠潜伏期呈增加趋势,REM睡眠比例及睡眠效率呈下降趋势。虽然2组上述指标的比较差异无统计学意义,但其变化趋势与动物实验具有一致性。
综上所述,脑卒中后合并EDS 患者较单纯脑卒中患者夜间睡眠期间低通气/呼吸暂停与低血氧事件增加,并存在睡眠结构的改变和夜间舒张压的上升,男性、高AHI值及夜间平均舒张压升高是卒中后EDS 的独立危险因素。然而,本研究纳入患者的脑卒中病程总体偏短,可能无法反映后遗症期卒中患者的EDS 发病特点;PSG 检查仅能收集患者夜间血压数据,缺乏24 h动态血压数据,无法判断患者昼夜血压节律是否存在异常。

