表达GⅡ.4型诺如病毒VP1复制缺陷型腺病毒构建与鉴定
施 鹏,林晓晨,周 艳,李娇春,宋泽鑫,鲁辰星,谭银珍,胡晓青,陈 蓉,李鸿钧
(中国医学科学院北京协和医学院 医学生物学研究所 云南省重大传染病疫苗研发重点实验室,昆明 650118)
人诺如病毒引起的胃肠炎是一种典型的急性疾病。在感染人群中,儿童和老人是高危人群,另外,免疫功能低下者的慢性诺如病毒长期感染会使人衰弱,是目前一个难以解决的问题[1]。长期无症状的诺如病毒感染和脱落也会导致病毒传播。在动物模型中研究发现,诺如病毒感染后,可以与宿主等位基因组相互作用变异以诱导炎症性肠病样表型[2],提示了诺如病毒感染在急性症状消退后很长一段时间内在肠道中引发持久影响的可能性。
诺如病毒(norovirus,NoV)属于杯状病毒科(Caliciviridae)诺如病毒属(Norovirus),是一类无包膜的单正链RNA病毒。诺如病毒通常被分类成5个或6个基因群(基因群I~VI),其中引起人类胃肠炎的主要是基因群I、II和IV[3],NoV基因群根据遗传相似性进一步细分为基因型或簇。具体的每一株病毒按其基因群和基因型来共同命名(例如,基因群II和基因型4,命名为NoVGII.4株)。病毒基因组的全长为7.4~7.7 kb,组成3个或4个开放阅读框(ORF)[4](图1)。5′近端ORF1编码一个大的多蛋白,该多蛋白被病毒编码的蛋白酶(Pro;NS6)分解为至少6种成熟的非结构蛋白,包括病毒RNA依赖性RNA聚合酶(NS7;RdRp)。NoV的ORF2编码病毒的主要结构蛋白VP1,VP1由一个保守的内壳(S)结构域和一个突出的(P)结构域组成,为二聚体形态;P结构域可以进一步细分为P1子域和超可变表面暴露的P2子域[5]。ORF3编码次要结构蛋白VP2。NoV基因组和亚基因组mRNA的5′末端与被称为VPg的小病毒编码蛋白共价连接,并且3′末端被多角化。
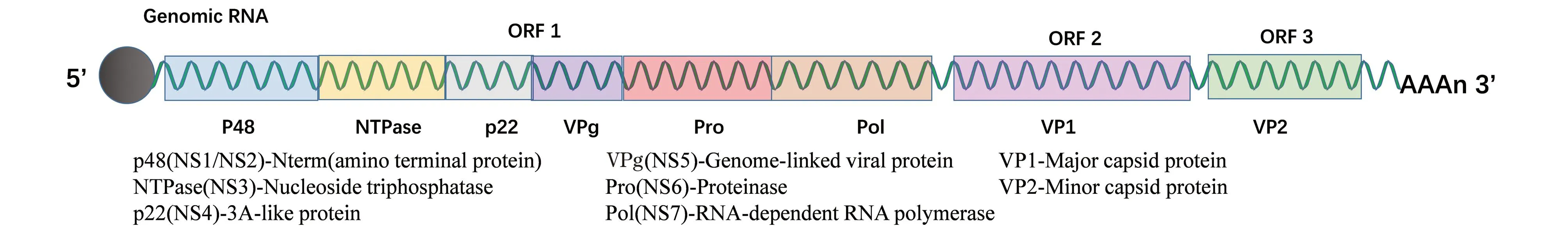
图1 诺如病毒基因组
由于无法在体外培养诺如病毒,诺如病毒的免疫学研究和全病毒疫苗研究受到很大阻碍,因此,大多数诺如病毒疫苗开发都集中在使用VLP作为免疫原的基因工程疫苗[6],这些亚单位疫苗免疫途径单一,需要依赖佐剂使用,研究表明,GⅡ.4P颗粒在小鼠中具有免疫原性[7-8],但有证据表明GⅡ.4VLP优于同源P颗粒[9],所以本研究选用GⅡ.4诺如病毒VP1基因,腺病毒作为载体可以诱导机体的黏膜免疫促进机体的免疫反应,增强免疫效果,更加有效防治由粪口途径传播的诺如病毒,对诺如病毒这种不能体外培养的病原体是一种非常好的免疫途径。腺病毒是双链DNA病毒,感染的宿主广泛,在人类中已经发现50多种血清型。腺病毒自被发现以来已经进行了深入研究,由于其高效的感染特性,主要用作基因转移的载体[10-13]。利用缺失了编码腺病毒早期蛋白的E1区和E3区基因的复制缺陷型腺病毒作为载体,转基因插入外源基因片段,导入体内可以表达外源蛋白从而诱导机体免疫[14]。本研究选择复制缺陷型人5型腺病毒作为基因递送载体,拟获得能够表达诺如病毒VP1的重组腺病毒rAd-VP1,作为将来可能的诺如病毒重组活疫苗的候选疫苗株。
1 材料与方法
1.1 材料
1.1.1 病毒、菌株和细胞
人胚胎肾细胞293(HEK293细胞)、腺病毒穿梭载体质粒、大肠埃希菌 (DH5α)、BJ5183感受态细胞由中国医学科学院医学生物学研究所分子生物学研究室保存并提供。
1.1.2 试剂与设备
小牛血清、DMEM购自美国Gibco公司;磷酸盐缓冲液(PBS)、胰酶均由中国医学科学院医学生物学研究所提供;质粒小提试剂盒(Plasmid Mini Kit I)购自OMEGA公司;限制性内切酶购自美国NEB公司;T4 DNA连接酶购自美国Thermo公司;KOD OneTMPCR Master Mix购自日本TOYOBO公司;诺如病毒VP1抗体购自英国Biobyt公司;鼠抗β-actin 抗体购自Abcam公司;腺病毒抗体购自英国Abcam公司;带HRP的山羊抗鼠二抗购自美国Signalway Antibody公司;GⅡ.4诺如病毒VP1蛋白(ab256447)购自Abcam公司;引物由北京擎科生物科技有限公司合成;转染试剂Lipofectamine 3000购自美国Thermo公司;电转仪为美国Bio-Rad公司,型号是GENE PULSER XCELL。
1.2 方法
1.2.1 目的基因克隆
GⅡ.4人诺如病毒VP1序列来自GenBank ID KF306214.1。根据穿梭载体质粒pshuttle-CMV多克隆位点和VP1序列设计引物,使用Primer premier 5.0软件设计引物,引物见表1,VP1 F引物在起始密码子前加入BglⅡ 内切酶序列和保护碱基,VP1 R引物在起始密码子前加入NotⅠ 内切酶序列和保护碱基,其中,小写为内切酶序列。引物由北京擎科生物科技有限公司合成。
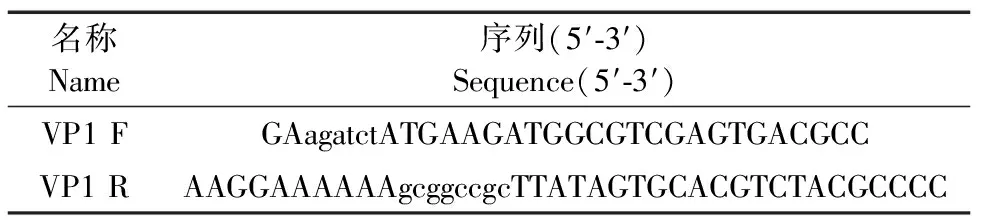
表1 诺如病毒VP1引物
利用PCR方法将合成的基因序列扩增,反应程序:98 ℃预变性3 min;98 ℃变性5 s,62 ℃退火10 s,72 ℃延伸15 s,共40个循环;72 ℃再延伸7 min,4 ℃保存。PCR产物使用1%的琼脂糖凝胶进行电泳,观察是否正确后回收,电泳条件90 V恒压1 h。
1.2.2 重组腺病毒构建
构建重组腺病毒使用的是Pad-Easy1系统,把扩增得到的VP1 PCR产物和pshuttle-CMV穿梭载体质粒分别使用BglⅡ和NotⅠ内切酶酶切,酶切后进行1%的琼脂糖凝胶电泳,酶切体系50 μL,电泳条件90 V恒压1 h,电泳后根据条带大小进行胶回收,回收1 600 bp和7 000 bp两条带。回收后的产物利用T4 DNA连接酶进行连接,连接体系共10 μL,载体和片段摩尔比值1∶7,16 ℃过夜连接。连接产物转化至大肠埃希菌 (DH5α),过夜培养扩增后提取质粒,使用BglⅡ和NotⅠ酶切鉴定条带大小。接着对连接产物使用PmeⅠ 内切酶酶切线性化,线性化后的穿梭质粒为line-pshuttle-CMV-VP1,使用电转化把该线性化质粒转进含有腺病毒骨架质粒的感受态细胞BJ5183中,通过该菌带有的同源重组酶进行同源重组,电转化电压条件为2 200 V,转化后涂布具有kana抗性的平板。重组后的大肠埃希菌培养扩增后提取腺病毒质粒用PacⅠ 酶切鉴定大小。
1.2.3 重组腺病毒包装
将HEK293细胞铺至6孔板,VP1重组腺病毒质粒按照Lipofectamine 3000 试剂说明书转染至HEK293细胞,HEK293细胞能表达重组腺病毒质粒所缺失基因的蛋白,让腺病毒完成包装。转染后6 h换液,替换为含1%血清DMEM培养基的维持液,每3 d补充无血清DMEM培养基1 mL,第9天细胞出现明显的细胞病变效应(cytopathic effect,CPE),病变细胞呈葡萄串状浮起但未全部脱落。这时取出6孔板-20 ℃冻融3次,6 000 r/min离心10 min,取上清液即重组腺病毒P0代,命名为rAd-VP1。继续用收集的上清液感染HEK293细胞,使用无血清的DMEM为培养基,扩增病毒至P3代。收集培养液,-20 ℃冻融3次,8 000 r/min离心20 min去除细胞碎片,收集上清液即为病毒收获液。
1.2.4 重组腺病毒滴度测定
将腺病毒收获液用超滤管(30K)浓缩,再用无血清的DMEM培养基进行10倍梯度倍比稀释(101~1013),取稀释后不同稀释度的病毒液以每孔100 μL加至铺种好HEK293细胞的96孔板,每个稀释度设置10个孔重复,再设置2个孔为正常细胞作为阴性对照,置于37 ℃,5% CO2培养箱中培养7 d后记录细胞病变情况,发生50%细胞病变效应的孔记为阳性,没有病变或者CPE<50%的记为阴性。使用Reed和Muench公式计算病毒滴度即细胞培养半数感染量CCID50。
距离比例=(高于50%病变率的百分数-50)/(高于50%病变率的百分数-低于50%病变率的百分数)
lgCCID50=距离比例×稀释度对数之间的差+高于50%病变率的稀释度对数
CCID50=10lgCCID50/100 μL
1.2.5 重组腺病毒Western Blot鉴定
HEK293细胞接种至T25培养瓶中,细胞密度达到80%~90%时,感染病毒rAd-VP1 P3代100 μL,48 h后当细胞发生病变但是没有完全脱落时,6 000 r/min离心10 min,去除上清液,使用RIPA裂解液在冰上裂解细胞,BCA方法测定蛋白浓度,进行SDS-PAGE电泳,每个孔的蛋白上样量为20 μg,电泳条件是180 V,30 min,电泳后转膜至PVDF膜,使用诺如VP1抗体1∶1 000稀释,β-actin抗体1∶5 000稀释,4 ℃孵育过夜。使用山羊抗鼠带HRP的二抗孵育1 h,显影曝光拍照。
2 结果与分析
2.1 目的基因克隆
PCR 扩增VP1片段,大小为1 623 bp(图2),连接后的pshuttle-CMV-VP1酶切结果为1 600 bp和7 000 bp两条带(图3),表明含诺如病毒VP1基因的穿梭质粒构建成功。经过测序结果显示插入的VP1序列与诺如病毒VP1序列一致,目的条带大小为1 623 bp。
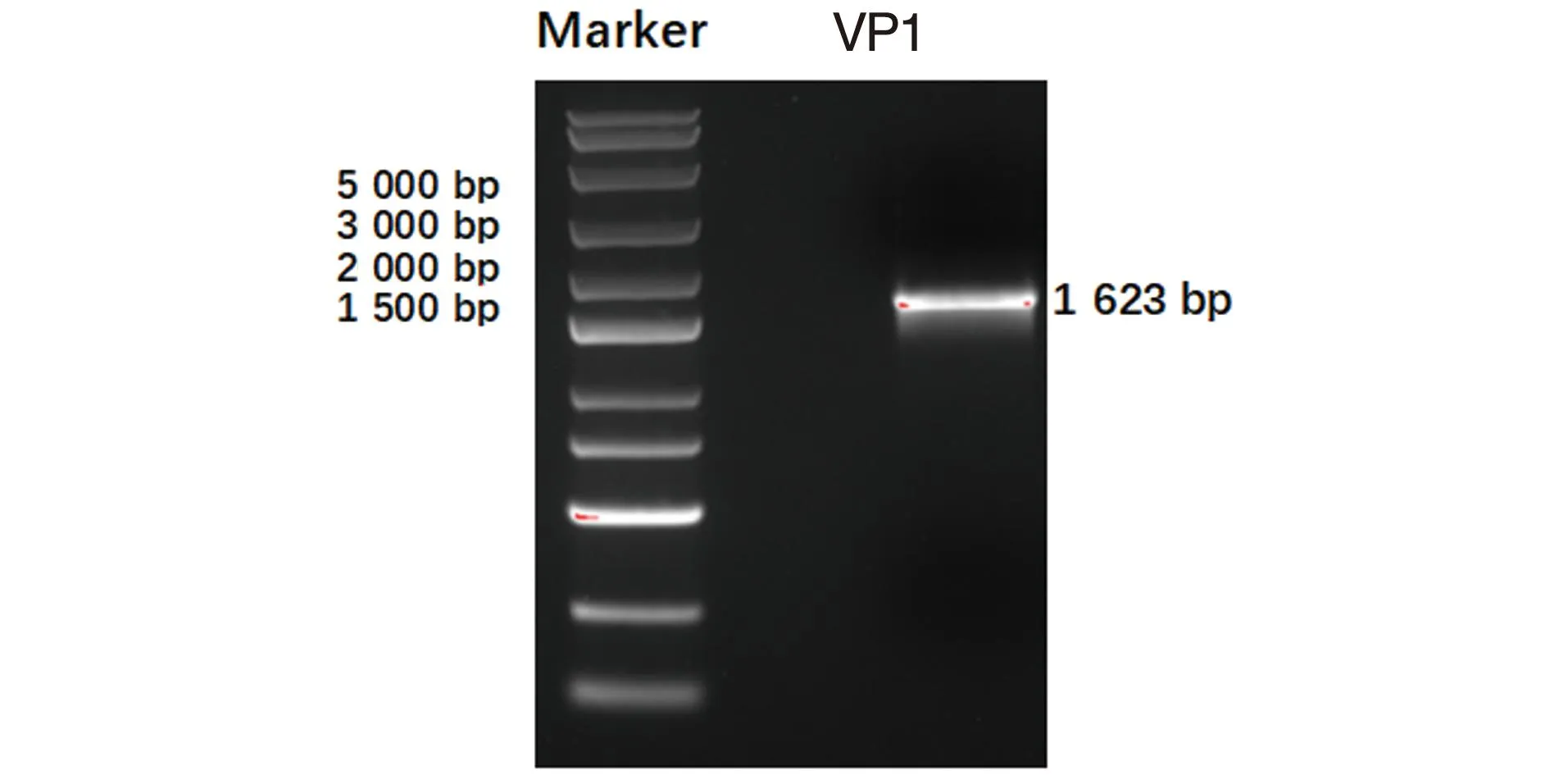
图2 诺如病毒VP1 PCR结果
2.2 重组腺病毒构建
重组腺病毒质粒经过PacⅠ内切酶酶切,结果显示为30 000 bp和4 500 bp两条带(图4),表明同源重组成功,将携带该质粒的菌扩增培养,提取质粒后PacⅠ内切酶酶切,然后用试剂盒进行纯化,为转染做准备。
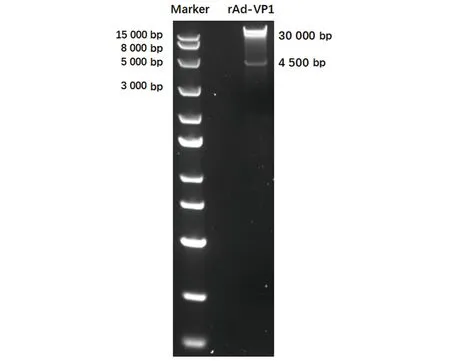
图4 诺如病毒VP1重组腺病毒质粒PacⅠ酶切鉴定结果
2.3 重组腺病毒包装
用Lipofectamine 3000 试剂将PacⅠ内切酶线性化的重组腺病毒质粒转染至HEK293细胞,转染后9 d,细胞变圆,呈念珠状或葡萄状浮起,是典型的细胞病变效应(图5)。表明重组腺病毒包装成功。
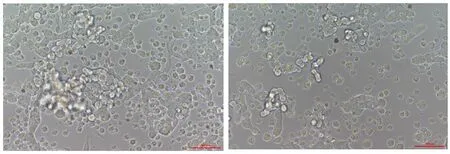
图5 重组腺病毒质粒转染后细胞病变结果
2.4 重组腺病毒滴度测定
腺病毒收获液浓缩后,用无血清的DMED培养基以10为倍数梯度稀释,7 d后统计阳性孔数和阴性孔数,统计结果见表2,其中,细胞病变大于50%的孔记为阳性,其余为阴性,按照稀释梯度计算累计的阳性和阴性孔数,计算阳性孔数所占比例,通过Reed和Muench公式计算病毒CCID50为5×109/mL。将滴度测定的96孔板使用结晶紫染色(图6),可以很明显看出细胞病变的情况。
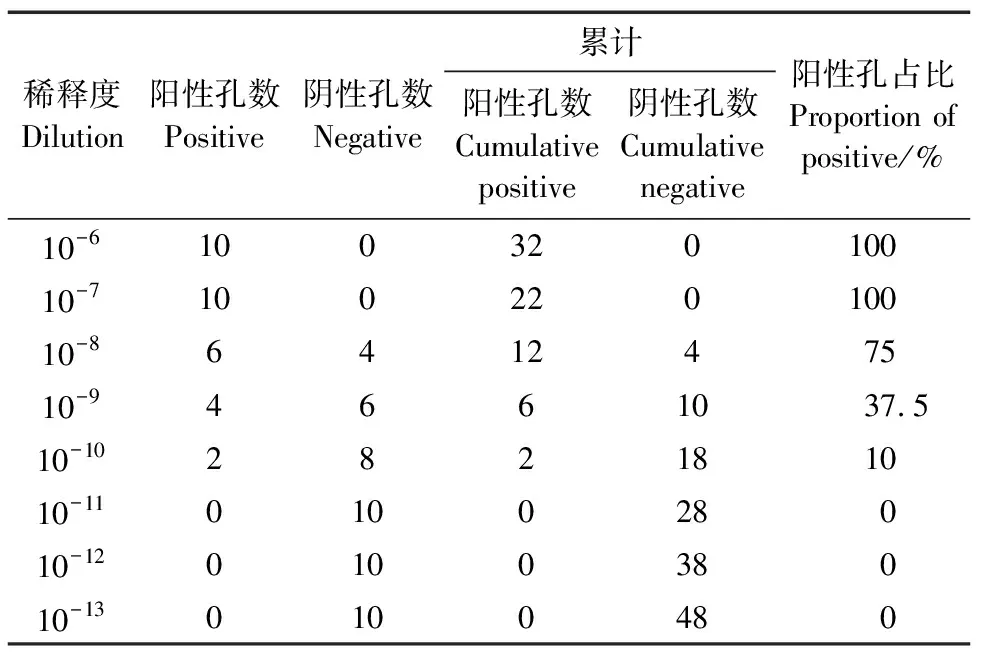
表2 滴度测定阳性孔统计表

左右两列为阴性对照孔。
距离比例=(75-50)/(75-37.5)=25/37.5=0.67
lgCCID50=0.67×1+8=8.67
CCID50=108.67/100 μL=5×109/mL
2.5 重组腺病毒Western Blot
鼠抗诺如VP1为一抗,带HRP山羊抗鼠为二抗,Western Blot鉴定结果如图7,结果显示,VP1特异性条带大小为59 ku,符合诺如病毒VP1大小,空白对照为未感染病毒的HEK293细胞蛋白,无VP1特异性条带,阳性对照组是VP1蛋白(ab256447),与重组腺病毒表达的VP1条带大小一致,证明携带诺如病毒VP1基因的重组腺病毒感染HEK293细胞后有效表达了诺如病毒VP1蛋白。
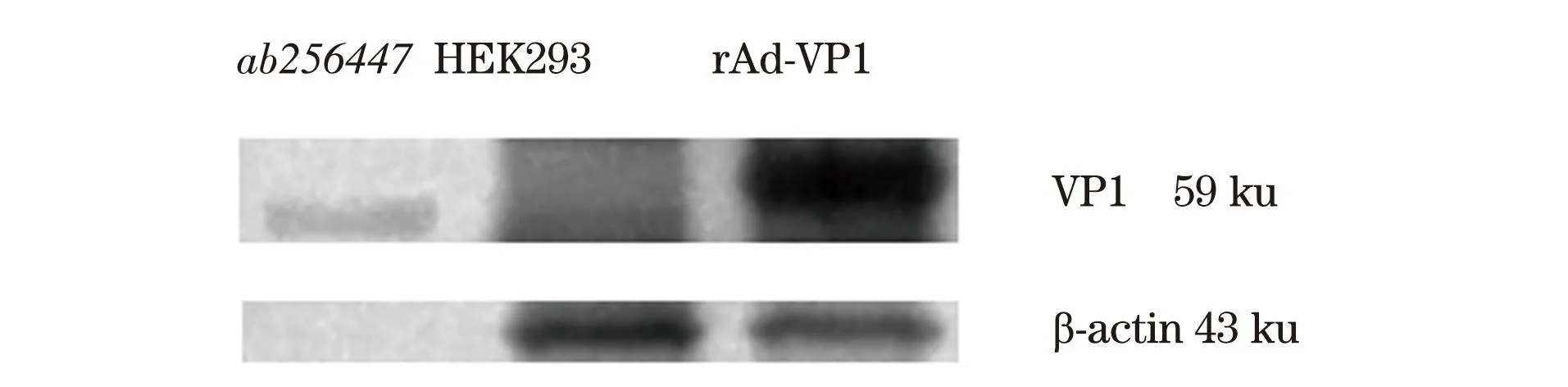
图7 rAd-VP1 感染HEK293细胞后 Western Blot结果
3 讨论
本研究采用复制缺陷型人5型腺病毒作为载体,选择国内主要流行株GⅡ.4型诺如病毒的VP1基因,构建重组腺病毒,提供一种新的诺如病毒疫苗研发路线作为选择,为诺如病毒的公共卫生防疫问题的解决提供方案。诺如病毒是在腹泻患者中检测到的主要病毒病原体,GⅡ.4毒株是疾病暴发地区的最常见毒株[15],中国是腹泻高发的15个国家之一[16],因此,诺如病毒疫苗的研究是公共卫生疾病预防控制所迫切需要的,一种好的疫苗需要有良好的免疫原性和较高的安全性。
目前诺如病毒疫苗的研究主要集中在病毒样颗粒等亚单位疫苗,疫苗来自诺如病毒主要的衣壳蛋白VP1,诺如病毒VP1表达后可以自发地自组装成VLP,VLP在抗原上与全病毒颗粒相似[17],诺如病毒VP1的表达常用的是毕赤酵母表达系统,但是表达产物复杂且纯化非常困难。亚单位疫苗在使用时免疫原性较低,需要配合好的免疫佐剂,并且需要较大的剂量才能诱导较好的免疫反应[18]。以腺病毒为载体的重组腺病毒疫苗可以有效刺激小鼠全身和黏膜特异性免疫反应,可以在血清、粪便、肠道和呼吸道黏膜中检测到特异性IgA和IgG,腺病毒作为一种成熟的基因递送载体,具有安全性高、易于构建与生产、插入的外源基因容量大[19]、可以与其他疫苗联合免疫、制剂种类丰富、可以刺激先天性免疫以增强疫苗的免疫原性[20-21]等优点,是一种良好的疫苗载体。美国Vaxart,Inc.公司开发了一种口服NoV单价疫苗,使用复制缺陷腺病毒5载体表达来自GI.1诺如病毒的VP1,在给予健康成年人免疫后,发现它具有良好的免疫效果及较高的安全性[22]。
诺如病毒GⅡ.4是目前国内主要的流行株,诺如病毒由于各型别之间免疫交叉反应较低,导致交叉保护效果差[23],在疫苗研发时需要充分考虑针对广泛流行株的疫苗。本研究构建重组腺病毒质粒转染HEK293细胞后成功获得重组腺病毒。经过扩增培养后获得的重组腺病毒滴度较高,Western Blot鉴定表明重组腺病毒能够较好表达外源蛋白诺如病毒VP1。鉴于目前诺如病毒的全病毒疫苗研究困难,本研究为诺如病毒疫苗的研发提供了另一种技术路线选择。接下来可以进一步进行动物实验以评估其安全性和免疫原性,为将来新型诺如病毒疫苗的研发提供良好的疫苗候选株。

