基于QCT分析维持性血液透析患者体质成分变化及骨密度的影响因素⋆
詹 昊 陈其春 刘田田 王龙胜,*
1.安徽医科大学第二附属医院放射科(安徽 合肥 230601)
2.安徽医科大学医学影像研究中心(安徽 合肥 230601)
慢性肾病(chronic kidney disease,CKD)是一种全球性的疾病负担,中国CKD患病率男性8758.42/10万,女性12474.69/10万[1]。随着CKD的进展,患者会出现调节激素和骨矿物质、骨周转和矿化以及血管或软组织钙化等一系列代谢异常,甲状旁腺激素是骨骼重塑的主要启动因子,较高的甲状旁腺激素水平与更复杂的松质骨形态有关[2]。透析可以有效去除CKD患者毒素,维持体内平衡,延长其预期寿命。然而,透析患者会出现蛋白质流失、炎症和分解代谢增强,所有这些都可能导致肥胖和肌肉萎缩,在透析开始的第一年最为明显[3-4]。身体成分的这些纵向变化不仅会导致代谢问题,还会影响患者的生存质量。已有研究报道定量CT(quantitative computed tomography,QCT)能够测量骨密度、腹部脂肪等体质成分并有效应用于临床[5]。因此,本研究的主要目的是应用QCT探讨维持性血液透析患者腰椎体积骨密度(volumetric bone mineral density,vBMD)等体质成分变化以及vBMD的影响因素。
1 资料与方法
1.1 一般资料回顾性分析2022年3月至11月在我院就诊的156例慢性肾病5期维持性血液透析患者,收集其一般资料(性别、年龄及透析龄),骨代谢相关实验室指标包括血钙、血磷、全段甲状旁腺激素(intact parathyroid hormone,iPTH)、碱性磷酸酶(alkaline phosphatase,ALP)。
纳入标准:临床资料完善且行CT检查;年龄≥18岁;透析龄≥3个月;排除标准:恶性肿瘤;甲状旁腺切除术后。血透组根据临床诊断分为继发性甲状旁腺功能亢进(secondary hyperparathyroidism,SHPT)和非继发性甲状旁腺功能亢进(nonsecondary hyperparathyroidism,N-SHPT)。另选取我院150例健康体检人员作为对照组,年龄性别与维持性透析患者相匹配。本研究获安徽医科大学第二附属医院伦理委员会批准(伦理编号:YX2022-172)。
1.2 实验室指标检测利用全自动血液生化分析仪(Cobas e601)检测血钙、血磷、ALP等指标;利用化学免疫发光法(IMMULITE 2000 XPi)检测iPTH。
1.3 QCT检查利用西门子双源Force CT扫描仪获取胸腰段QCT原始图像。每月一次体模扫描进行QCT校准。QCT扫描参数如下:扫描床高150cm;电子管电压100kVp;电子管电流150mA;旋转时间:0.5s/转;重建层厚度1mm;矩阵是512×512。原始的CT数据被发送到QCT Pro6.1工作站(Mindways,USA)进行vBMD和体质成分分析。vBMD测量:在L1、L2、L3椎体的正中层面自动勾画感兴趣区(ROI),适当进行手动调整以避开椎体周围的皮质骨和沿椎体背部走行的椎基底静脉。取L1、L2、L3椎体的vBMD值,计算其平均值作为最终的vBMD值(图1)。体质成分测量:进入QCT Pro工作站的“body composition”功能区,选取L2/3椎间盘层面自动获取皮下脂肪含量(subcutaneous adipose tissue,SAT)和内脏脂肪含量(visceral adipose tissue,VAT)(图2);在 L3椎体中间层面勾画出椎旁肌(竖脊肌和多裂肌),绘制ROI时尽可能覆盖该层面的椎旁肌,同时不超过肌肉轮廓,系统自动计算出椎旁肌面积及脂肪面积(图3)。所有测量均由两名经培训的放射医生独立完成,取两组数据的平均值作为最终测量结果。根据中华健康管理学分会中国骨质疏松杂志同期发布QCT指南,QCT骨质疏松诊断标准[6]:腰椎vBMD>120mg/cm3骨量正常,80120mg/cm3低骨量,<80mg/cm3骨质疏松。
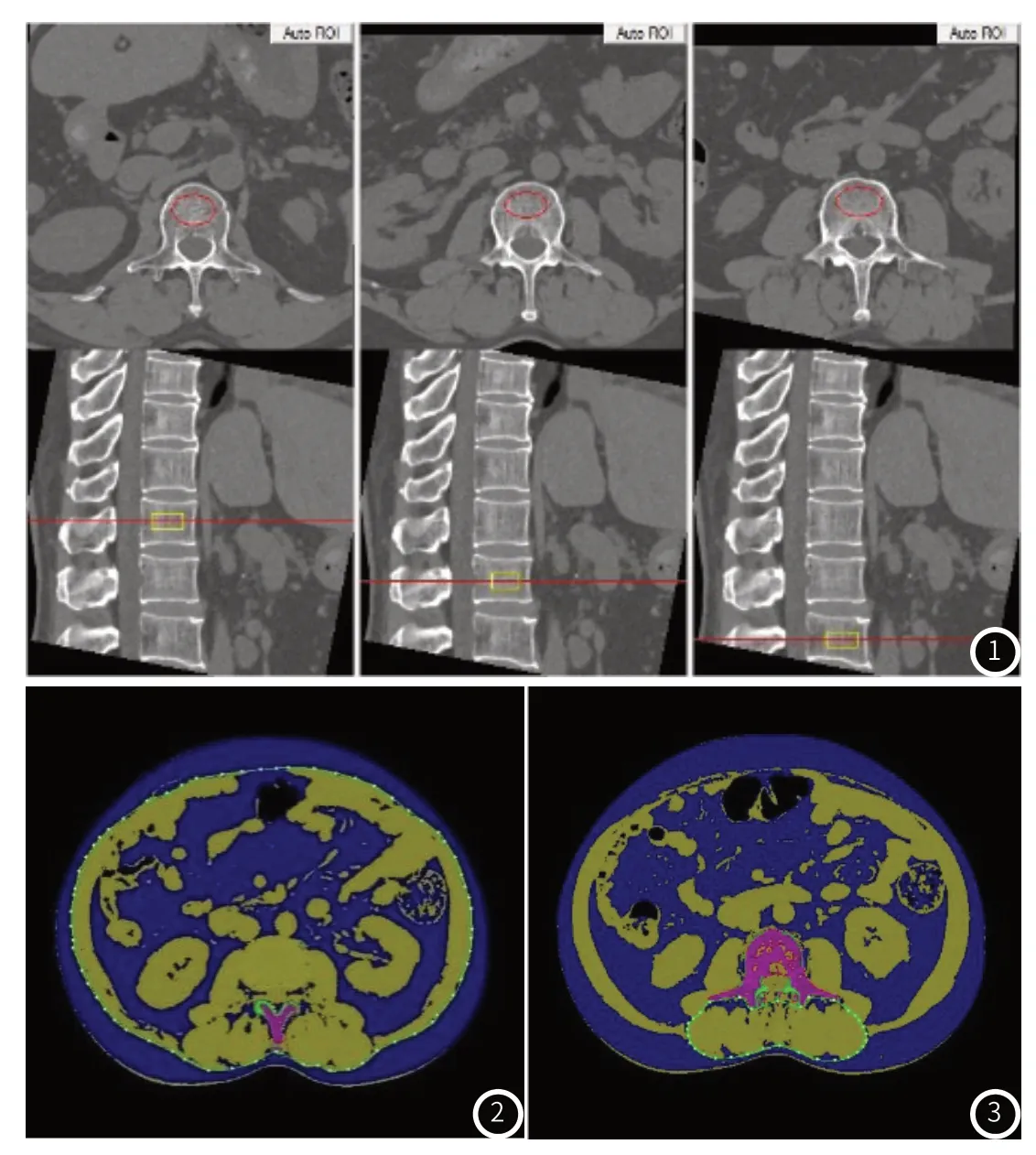
图1 腰椎vBMD测量示意图。图2 腹部脂肪测量示意图(绿线以内蓝色区域为内脏脂肪,绿线以外的蓝色区域为皮下脂肪)。图3 椎旁肌成分测量示意图。
1.4 统计学方法采用SPSS 25.0统计软件进行数据分析。正态分布的计量资料用()表示,非正态分布的数据用中位数(四分位间距)表示。t检验用于比较两组之间的正态分布计量资料,Mann-Whitney U检验用于比较两组非正态分布的计量资料,χ2检验用于比较各组之间的分类数据。单因素方差分析用于比较多组间正态分布资料;Kruskal-Wallis H秩和检验用于检验多组间非正态分布资料是否存在差异。Spearman相关分析用于评估vBMD与其他变量之间的关系。P<0.05视为差异有统计学意义。
2 结果
2.1 人口学资料维持性血液透析患者156例,男78例,女78例,平均年龄(54.99±12.65)岁。对照组150例,男75例,女75例,平均年龄(54.59±12.60)岁。维持性血液透析患者中SHPT78例,平均年龄(52.78±12.06)岁;N-SHPT78例,平均年龄(57.19±12.92)岁。
2.2 血透组与对照组间各项参数的比较血透组与对照组的年龄、性别之间无显著差异性(P>0.05),说明两组数据的年龄和性别匹配。血透组的SAT和椎旁肌面积稍低于对照组,但是两组间差异无统计学意义(P>0.05)。血透组的VAT和椎旁肌脂肪面积均高于对照组(P<0.01)。血透组的vBMD与对照组无显著差异性;vBMD>180mg/cm3的血透组患者占16.67%(26例,其中SHPT组18例、N-SHPT组8例),对照组患者占9.33%(14例),血透组的vBMD显著高于对照组(P<0.001,表1)。
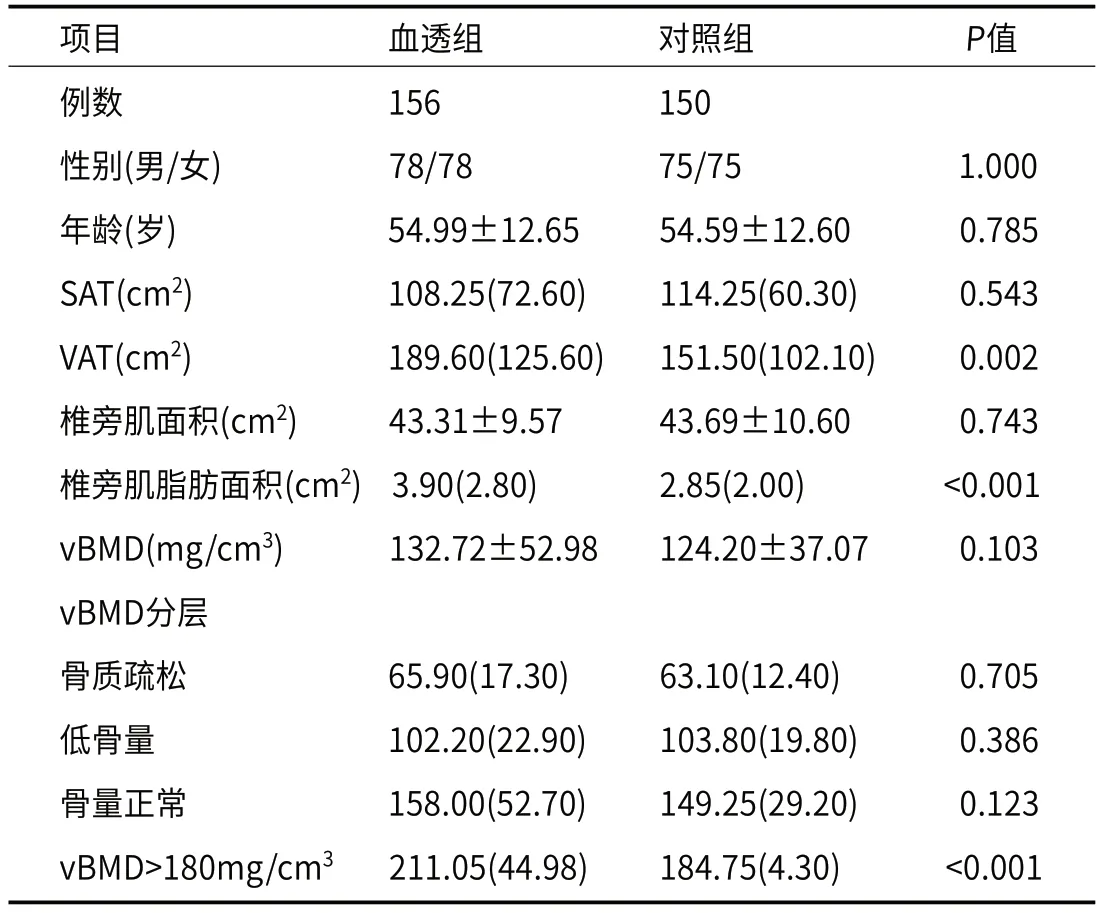
表1 血透组与对照组间各项参数的比较
2.3 SHPT组与N-SHPT组间各项参数的比较SHPT组患者年龄低于N-SHPT组(P<0.05),透析龄、vBMD均高于N-SHPT组,差异有统计学意义;两组间的SAT、VAT、椎旁肌面积和椎旁肌脂肪面积差异均无统计学意义(P>0.05)。SHPT组的iPTH、ALP均高于N-SHPT组(P<0.05,表2)。
2.4 SHPT组与N-SHPT组vBMD的影响因素SHPT组患者的vBMD与年龄、椎旁肌脂肪面积呈负相关(r=-0.413、-0.358,P值均<0.01),与iPTH、ALP呈正相关(r=0.239、0.338,P值均<0.05);N-SHPT组患者的vBMD与年龄、椎旁肌脂肪面积和ALP呈负相关(r=-0.630、-0.272、-0.437、-0.241,P值均<0.05,表3)。
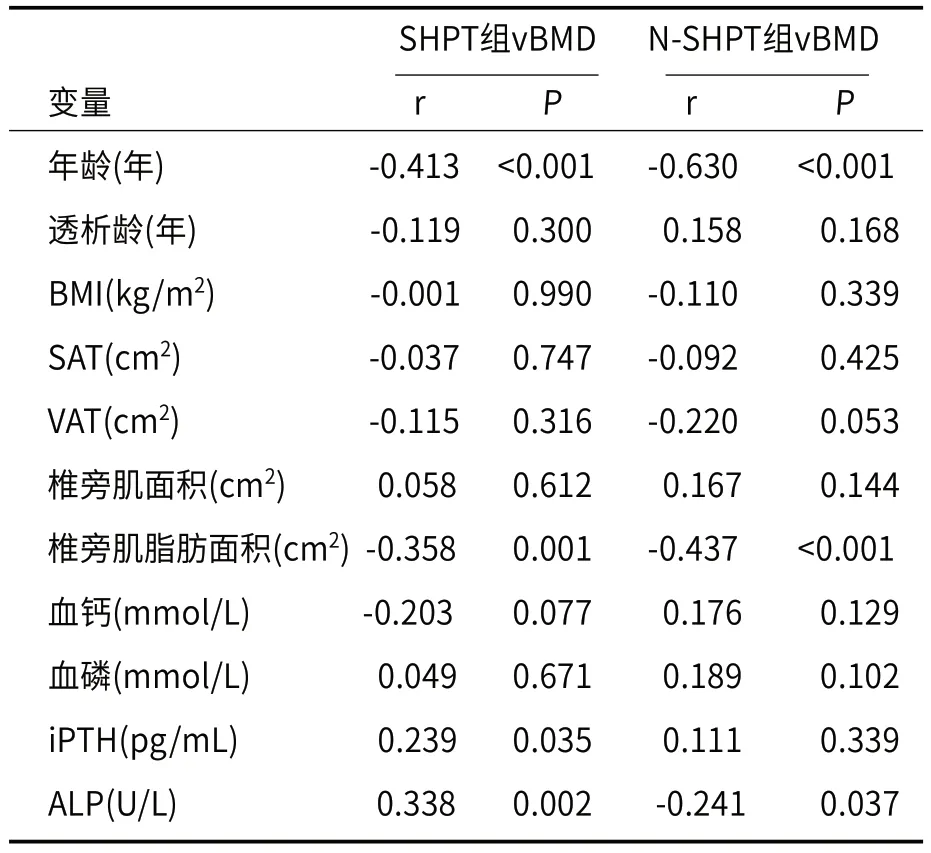
表3 SHPT组与N-SHPT组vBMD的影响因素
3 讨论
CKD患者的骨质改变、肥胖、肌肉萎缩等问题都将影响患者的生存质量,监测其骨密度、腹部脂肪含量、肌肉状态等是有必要的。QCT可以对这些指标进行有效地定量测量,Cheng等[7]研究认为L2/3椎间盘层面是评估全腹脂肪含量的最佳层面,能较好反映全腹脂肪含量。大部分研究用L3椎体中部水平的CT图像评估肌肉质量,认为将竖脊肌和多裂肌作为一个整体来测量腰椎旁肌总脂肪含量可以更省时有效[8-9]。
本研究结果显示血液透析患者骨密度稍高于健康对照组,但是差异性无统计学意义;vBMD>180mg/cm3人群中,血透组患者的vBMD显著高于对照组;SHPT组的vBMD显著高于N-SHPT组;SHPT组患者vBMD随着iPTH、ALP的升高而升高。这些结果表明血透中部分患者骨密度增高,SHPT患者尤为明显且与iPTH、ALP呈正相关,与以往研究不一致[10-11];N-SHPT组患者vBMD与ALP呈负相关,与iPTH无关,这与以往研究一致[11-12]。主要原因可能是血透患者骨转换的多样性,尤其是SHPT患者肾性骨营养不良表现为骨硬化而导致vBMD增高。Jevtic等[13]研究肾性骨病的影像学特征发现,在SHPT患者中经常发现骨硬化,其与骨吸收引起的成骨细胞骨生成过多或矿化类骨生成增加有关,典型表现为“橄榄球衣状脊柱(rugger-jersey spine)”。Maluche等[14]研究了630例血液透析患者,其中三分之二的黑人患者松质骨体积高,表现出骨量增多,与本研究结果类似。另一项研究表明间歇性特立帕肽等拟钙剂给药会在PTH水平产生昼夜节律,促进骨形成进而快速增加骨量[15]。这种高骨密度对于透析患者来说不一定是一种保护作用,曾经有研究人员发现甲状旁腺功能确实影响松质骨的形态特性,高甲状旁腺激素水平似乎与更多的松质骨分支有关,然而,甲状旁腺激素的作用不足以改变松质骨连接,骨机械强度并不会增加[2]。
本研究发现维持性血液透析患者的VAT显著高于健康对照组,两组间的SAT无明显差异;而在SHPT组与N-SHPT组间SAT、VAT均无明显差异,这表明血液透析患者可能存在内脏脂肪积聚情况,与以往研究一致[16]。尽管经过长期透析以及饮食摄入等原因可能导致患者体脂减低,但是有研究表明终末期肾病患者皮下和内脏脂肪组织中的巨噬细胞浸润增加[17],过量的内脏脂肪组织与体内炎症和氧化应激有关,这可能会影响患者的生存率[18]。
脂肪浸润会改变肌肉结构干扰肌肉收缩,从而降低肌肉质量和身体机能,许多研究表明CKD患者低肌肉质量与肌肉脂肪浸润密切相关[19]。同样,本研究发现血透组椎旁肌脂肪面积明显高于对照组,提示维持性血液透析患者肌肉质量降低;然而,血透组的肌肉面积未见显著减少,这表明肌肉脂肪浸润的过程可能是一种先于肌肉萎缩的早期的肌肉结构变化。研究中还发现无论是SHPT组还是N-SHPT组患者vBMD均与年龄、椎旁肌脂肪面积呈负相关。Yang等[9]研究发现,无论男性还是女性,肌肉脂肪浸润程度越高,vBMD越低,但与肌肉面积无关。在中老年人群中的研究中也得出了相似的结论[20]。研究表明,肌肉内脂肪可通过分泌促炎细胞因子参与炎症过程[21],这可能会对骨代谢产生负面影响。
本研究存在一定局限性。首先,该研究为横断面研究,无法评估维持性透析患者骨密度以及体质成分的个体差异变化。另外,这是一项单中心研究,需要进一步前瞻性多中心研究来验证我们的发现。
综上所述,血液透析患者内脏脂肪与椎旁肌脂肪较健康人群增加,椎旁肌脂肪浸润程度越高骨密度越低,SHPT患者骨密度随着iPTH增加而增高。QCT可对维持性血液透析患者的体质成分进行监测,早期预防异位脂肪积聚、肌肉萎缩可以改善患者生存质量及骨质量。此外,QCT测量的正常骨密度可能会掩盖潜在的骨质病变,所以有必要定期测量vBMD以监测骨质变化。

