饲料磷脂水平对乌鳢幼鱼生长性能、抗氧化能力及脂肪沉积的影响
张 玉,龚 埜,李文飞,王振杰,陈乃松,2,李松林,2
(1.上海海洋大学农业农村部鱼类营养与环境生态研究中心,上海 201306;2.上海海洋大学水产科学国家级实验教学示范中心,上海 201306)
磷脂(Phospholipid,PL)是鱼类体内重要的结构和功能分子,参与细胞膜合成、能量代谢、信号转导等多种生理过程,可通过促进脂肪酸运转、增强脂肪酸氧化并抑制脂质生成等方式降低肝脏脂肪含量[1-2]。在饲料中添加适量磷脂可促进鱼类的生长、存活、抗氧化和骨骼发育等方面的表现[3-5]。鱼类对磷脂的需求量和利用效率会因不同发育阶段和不同物种而变化。对于仔稚鱼,由于其合成磷脂的能力有限,在其饲料中补充磷脂十分必要[6],添加适宜的磷脂可促进仔稚鱼生长发育、提高存活率并降低骨骼畸形率[7-10]。而高水平的脂质摄入可能会导致鱼类肝脏中脂质过度沉积[11],影响肝功能和其健康状况[12-15]。饲料中添加磷脂可降低大黄鱼(Larimichthys crocea)[16-17]、杂交鳢(Channa argus×Channa maculata)[18]和尼罗罗非鱼(Oreochromis niloticus)[19]的肝脏脂肪含量。饲料中添加磷脂会显著提高杜氏(Serioladumerili)[20]和斑点叉尾鮰(Ictalurus punctatus)[21]肝脏中的脂质积累。饲料磷脂的增加减少了脂肪酸氧化,增加了杂交石斑鱼(Epinephelus fuscoguttatus♀×Epinephelus lanceolatus♂)肝脏脂质的积累[22]。因此,探讨磷脂对鱼类脂质代谢的调节机制,优化鱼类饲料中磷脂的添加水平和比例,对于提高水产养殖效率有着重要意义。
乌鳢(Channa argus)是中国北方广泛养殖的肉食性鱼类之一,有很高的市场价值和需求[23],但在乌鳢的集约化养殖中,时常出现营养性代谢疾病,不利于乌鳢养殖产业化健康发展[24-25]。目前,有关乌鳢幼鱼的营养需求和生理代谢研究较多[18,26-28],但乌鳢幼鱼的磷脂需求及调节机制尚不清楚。本研究探讨饲料中添加磷脂对乌鳢幼鱼的生长、抗氧化以及脂质代谢的影响,分析乌鳢幼鱼对磷脂的需求,旨在为乌鳢的健康养殖提供参考。
1 材料与方法
1.1 实验饲料
在基础配合饲料中分别添加质量分数0%、2%、4%、6%和8%的磷脂(各组饲料中磷脂水平实测值分别为1.37%、3.22%、5.36%、7.23%和9.15%),通过调整大豆油水平来维持脂肪含量的稳定,配制成5 种等氮等脂饲料,分别记为PL0、PL2、PL4、PL6 和PL8(表1)。实验饲料氨基酸组成见表2。固体原料粉碎,过孔径180 μm的筛,逐级混匀,与磷脂充分混合后再与鱼油和豆油的混合物充分混匀。将混合的原料加水充分混匀后挤压制粒,在60 ℃下烘干、密封,于-20 ℃保存备用。
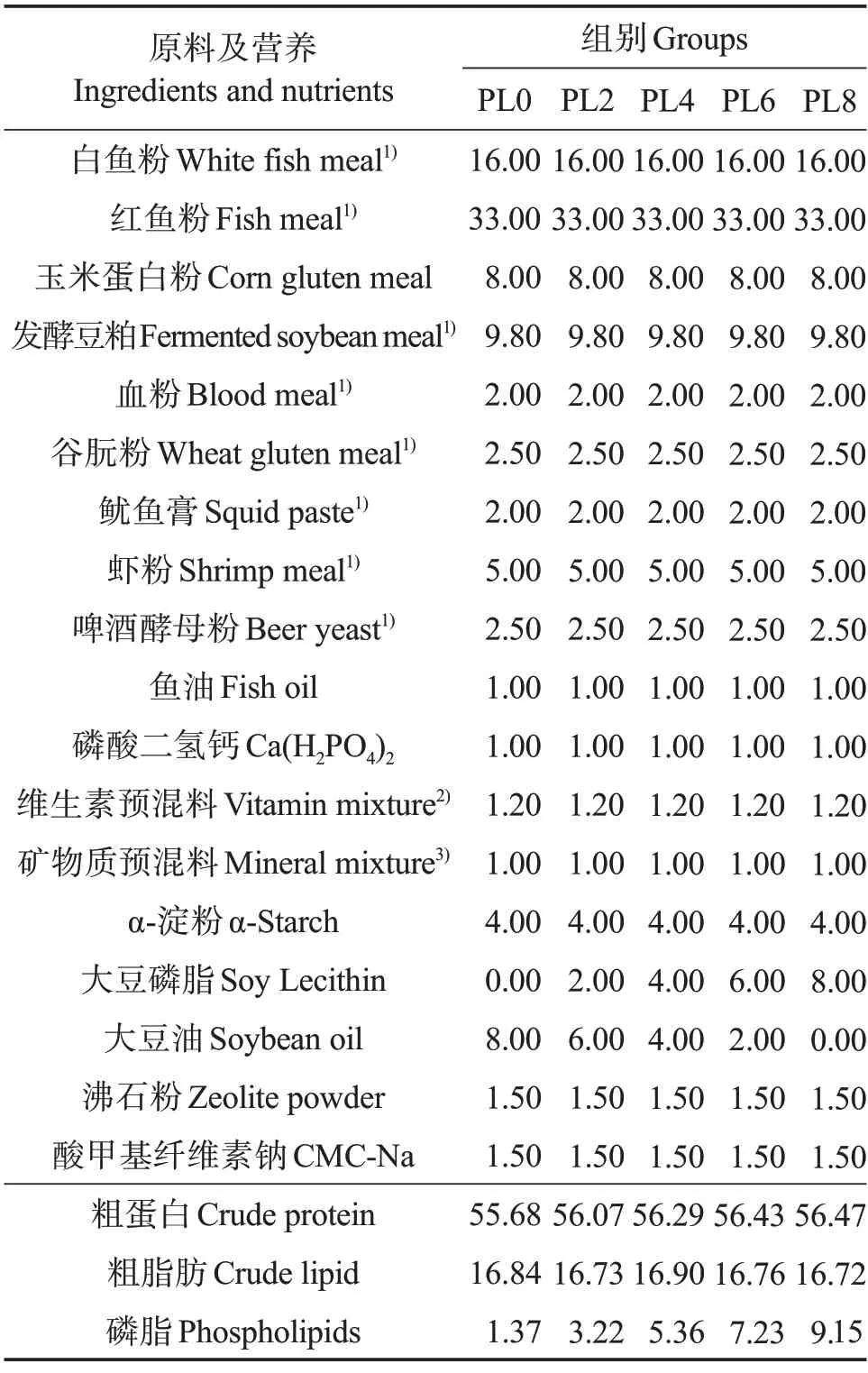
表1 实验饲料配方及营养组成(干物质)Table 1 Formulation and chemical composition of experimental diets(dry matter) %
1.2 养殖管理
养殖实验在上海海洋大学和上海农好饲料股份有限公司联合实验室的室内循环水养殖系统中进行。实验鱼用商品饲料(浙江欣欣天恩水产饲料有限公司)驯化2 周,停饲24 h,挑选规格相似、体格健壮的乌鳢幼鱼[初始体质量(3.99 ± 0.01)g]随机均分到15 个容量为800 L 的养殖桶中,每个养殖桶45 尾。各组每天6:00、10:00、14:00 和17:00 进行表观饱食投喂,为期43 d。实验用水经海绵和珊瑚砂过滤,并用紫外线消毒24 h,幼鱼摄食后吸底和排污。养殖实验期间采用自然光照周期,水温(26 ±1)℃,溶解氧大于6.2 mg/L,pH 为7.2 ± 0.2,氨氮和亚硝酸氮质量浓度均≤0.1 mg/L。
1.3 幼鱼生长性能统计及样品采集
养殖实验结束后,幼鱼停饲24 h,用丁香酚麻醉,计数,称总质量,计算生长性能指标:
存活率(SR,%)=终末数量/初始数量;
增重率(WGR)=(末均体质量-初均体质量)/初均体质量;
特定生长率(SGR)=(ln 末均体质量-ln 初均体质量)/养殖周期;
饲料系数(FCR)=摄食饲料质量/(末均体质量-初均体质量);
日摄食率(FI)=摄食饲料质量/[(初体质量+末体质量)/(2×养殖周期)];
脏体比(VSI)=内脏团质量/末体质量;
肝体比(HSI)=肝脏质量/末体质量。
每桶随机取鱼20 尾,6 尾保存在-20 ℃用于体成分分析。剩余14 尾鱼中,6 尾用于测量肝体比和脏体比,8 尾剖取肝脏和肠道用于采集生化分析和基因检测,所有样品采集后于液氮中速冻,于-80 ℃条件下保存备用。
1.4 样品分析
1.4.1 样品及实验饲料常规指标分析 实验饲料和样品(包括全鱼、肌肉和肝脏)的水分含量采用105 ℃恒温干燥法(GB/T6435—2014)测定,烘干样用于测定粗脂肪、粗蛋白及粗灰分;粗脂肪含量采用氯仿-甲醇萃取法测定[29];粗蛋白质含量采用凯氏定氮仪(OPSIS,瑞典)测定(GB/T5009.124—2016);灰分含量通过将样品在550 ℃马弗炉中燃烧至恒重后测定(GB/T6438—2007)。磷脂含量通过钼蓝法测定[30]。脂肪酸相对含量(占总脂肪酸质量分数)用HP6890 气相色谱仪(Agilents Technologies,Santa-Clara,CA,USA)测定,用于脂肪酸检测的饲料、肌肉和肝脏样品经过前处理变成的甲酯得到。
1.4.2 生化指标测定 取适量-80 ℃保存的肝脏样品于离心管,加入生理盐水,研磨,离心,取上清液,根据南京建成试剂盒说明书测定总蛋白(TP)含量、丙二醛(MDA)含量、超氧化物歧化酶(SOD)活力、过氧化氢酶(CAT)活力和总抗氧化能力(T-AOC)指标。
1.4.3 RNA 提取和实时定量PCR 使用TransZolUp(TransGen)提取肝脏样品的总RNA,用PrimeScript™RT 试剂盒(Takara)将其逆转录成第1 链cDNA。用TransStart®TopGreenqPCR SuperMix(TransGen)在定量热循环仪(Mastercycler EP Realplex,Eppendorf)中进行实时定量PCR。通过Primer Premier5.0设计特异性引物(表3),以经过验证稳定的β-actin为内参基因,根据2-ΔΔCt方法计算基因相对表达量[28]。

表3 引物序列Table 3 Sequence of primers
1.5 数据统计与分析
结果表示为平均值± 标准误。使用SPSS26.0统计软件对数据进行单因素方差分析,数据差异显著时,采用Duncan's多重检验法进行比较,显著水平α=0.05。
2 结果
2.1 饲料磷脂水平对乌鳢幼鱼生长性能与饲料利用的影响
由表4 可知,在饲料中添加磷脂对乌鳢幼鱼的终末体质量(FBW)和SGR 有显著影响,其中PL4组和PL6组均显著高于PL0组(对照)(P<0.05),但对幼鱼SR影响不显著(P>0.05)。随饲料中磷脂水平的升高,幼鱼HSI 无显著差异(P>0.05),PL8 组幼鱼VSI 显著小于其他组(P<0.05);FI 和FCR 先降低后升高,PL2 和PL4 组FI 显著低于PL0 组(P<0.05),PL2组、PL4组和PL6组FCR 显著低于PL0组(P<0.05)。

表4 饲料磷脂水平对乌鳢幼鱼的生长性能与饲料利用情况的影响Table 4 Effects of dietary phospholipids on growth performance and feed utilization of juvenile snakehead
2.2 饲料磷脂水平对乌鳢幼鱼的鱼体、肝脏、肌肉营养成分的影响
由表5可知:随着饲料中磷脂添加量的增加,鱼体的粗脂肪含量呈下降趋势,PL6 组和PL8 组显著低于PL0 组(P<0.05),鱼体水分含量则呈上升趋势,PL6 组和PL8 组显著高于PL0 组(P<0.05);肌肉粗蛋白含量呈下降趋势,PL8 组肌肉蛋白含量显著低于PL0组(P<0.05);肌肉水分呈先降后升变化趋势,PL2 组和PL4 组显著低于PL0 组,PL8 组升至PL0 组水平(P<0.05)。磷脂水平的提高,对幼鱼肝脏组织中的蛋白含量无显著影响(P>0.05),肝脏粗脂肪含量呈降低趋势,PL0 组肝脏脂肪含量显著高于其他处理组(P<0.05);肝脏水分含量则呈升高趋势,PL6组、PL8组显著高于PL0组(P<0.05)。

表5 饲料磷脂水平对乌鳢幼鱼鱼体、肌肉和肝脏成分的影响(湿基)Table 5 Effects of dietary phospholipids on composition of whole fish body,muscle and liver of juvenile snakehead(wet basis) %
2.3 饲料磷脂水平对乌鳢幼鱼肝脏抗氧化酶活力的影响
由表6可知:随着磷脂含量的升高,乌鳢幼鱼肝脏MDA 含量呈降低趋势,PL6和PL8组显著低于其他组(P<0.05);肝脏SOD 活力呈升高趋势,PL6 和PL8 组显著高于PL0 组(P<0.05),PL8 组升至最高(P<0.05);T-AOC 则呈先升后降趋势,PL2 组最高(P<0.05),PL8 组降至对照组水平。饲料中磷脂含量变化对CAT活力无显著影响(P>0.05)。
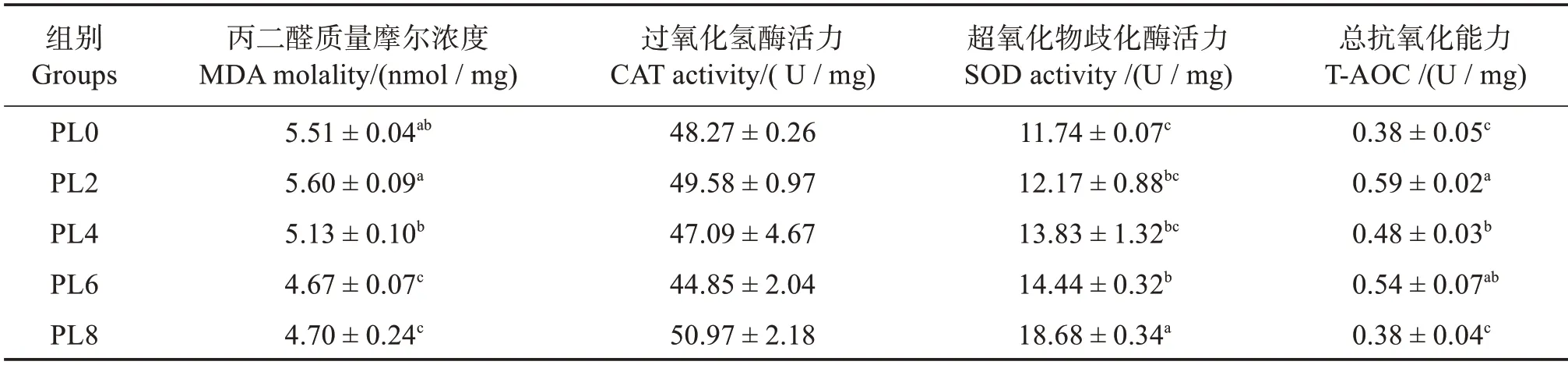
表6 饲料磷脂水平对乌鳢幼鱼肝脏抗氧化酶活力的影响Table 6 Effects of dietary phospholipids on hepatic antioxidant capacity of juvenile snakehead
2.4 饲料磷脂水平对乌鳢幼鱼肝脏、肌肉脂肪酸组成的影响
由表7可知:随着饲料中磷脂含量的升高,乌鳢幼鱼肝脏组织脂肪酸C14:0、C18:0、C16:1n7、C18:1n9和单不饱和脂肪酸(MUFA)相对含量无显著变化(P>0.05);C16:0、饱和脂肪酸(SFA)、C20:1n9、C20:4n-6、C20:5n-3、C22:6n-3、n-3 多不饱和脂肪酸(n-3 PUFA)相对含量显著升高(P<0.05),且PL8组最高;C18:2n-6c、n-6 PUFA 和C18:3n-3 相对含量则显著降低(P<0.05),且PL8组最低。

表7 各组乌鳢幼鱼肝脏脂肪酸占总脂肪酸质量分数Table 7 Mass fraction of fatty acid to total fatty acid in liver of juvenile snakehead in different groups %
由表8 可知:在肌肉组织中,随着饲料中磷脂含量的升高,C14:0、C18:1n9、C20:1n9 相对含量无显著变化(P>0.05);但C16:0、C18:0、SFA、C20:4n-6、C20:5n-3、C22:6n-3、n-3 PUFA 相对含量值显著升高(P<0.05),且PL8 组最高;C16:1n7、MUFA、C18:2n-6c、n-6 PUFA 和C18:3n-3 相对含量显著降低(P<0.05),且PL8组最低。

表8 不同饲料组乌鳢幼鱼肌肉脂肪酸占总脂肪酸质量分数Table 8 Mass fraction of fatty acid to total fatty acids in muscle of juvenile snakehead in different groups %
2.5 饲料磷脂水平对乌鳢幼鱼肝脏脂质代谢相关基因表达的影响
在脂肪生成相关基因中,饲料中磷脂水平的升高对fasn表达量无显著影响(P>0.05);但显著降低acc1的表达量,PL8 组显著低于PL0 组(P<0.05)(图1(a-b))。在脂肪分解相关基因中,PL4 组atgl基因表达量显著高于其他组(P<0.05),PL0组mgl的表达量显著低于除PL2 组外的各组(P<0.05),PL6 组的hsl表达量显著高于其他组(P<0.05)(图1(c-e))。在脂肪酸氧化相关基因中,PL6 组的aco表达量显著高于PL0 组(P<0.05),同时,PL6 组cpt1和pparα的表达量显著高于其他组(P<0.05)(图1(f-h))。

图1 饲料磷脂水平对乌鳢肝脏脂质代谢相关基因表达的影响Fig.1 Effects of dietary phospholipids on relative expression of lipid metabolism related genes in liver of juvenile snakehead
3 讨论
3.1 饲料磷脂对乌鳢幼鱼生长的影响
磷脂是一种重要的结构性和功能性脂质[3]。鱼类在幼体阶段内源性磷脂合成能力有限[5],主要是肠上皮细胞的磷脂生物合成能力低,导致其对外源性磷脂的依赖性高[31]。磷脂可以增强肠道健康状态,促进脂质从肠道转运到身体其他部位,从而增加生长所需能量和促进脂肪酸的合成和沉积[32]。随着鱼类生长和发育,其对磷脂的需求量逐渐减少[4]。饲料磷脂对生长性能的影响在鱼类生长早期阶段更为明显[17,33],为探究磷脂对乌鳢幼鱼生长性能的影响,本研究实验周期选择为43 d。
在饲料中添加磷脂不会对大西洋鲑(Salmo salar)幼鱼产生影响[34],大豆卵磷脂也不影响斑点叉尾鮰幼鱼的生存和生长[20]。本研究中,随着饲料中外源性磷脂含量的提高,乌鳢幼鱼FBW 和SGR 显著升高,FCR 显著降低,可见添加适量的磷脂可增强乌鳢幼鱼的食欲和饲料利用率,促进其生长发育。在牙鲆(Paralichthys olivaceus)[35]、虹鳟(Oncorhynchus mykiss)[33]、团头鲂(Megalobrama amblycephala)[36]和军曹鱼(Rachycentron canadum)[37]幼鱼中也有类似结果。然而,当饲料中磷脂水平高于5.36%时,乌鳢幼鱼生长性能开始下降,大黄鱼[17]和杂交鳢[18]有类似结果,可能归因于过量的磷脂造成营养失衡或者消化吸收障碍。
3.2 饲料磷脂对乌鳢幼鱼脂质代谢的影响
在哺乳动物中,磷脂可通过减少脂肪酸的合成、促进脂肪酸氧化来减少肝脏脂肪的沉积[1]。在团头鲂[12]和大黄鱼[38]等硬骨鱼的研究中可证明脂质代谢相关基因在调节脂肪沉积中的作用。磷脂会通过抑制脂肪酸的合成,并促进脂肪酸氧化,来抑制某些鱼类的脂质积累,如大黄鱼幼鱼[16]和杂交鳢[18]。本研究中,随着饲料中大豆磷脂添加量的增加,乌鳢幼鱼鱼体和肝脏脂质含量显著降低,说明磷脂可减少肝脏的脂肪沉积,在大口黑鲈(Micropterus salmoides)幼鱼[39]中有相同结果。同时全鱼和肝脏的水分含量显著升高,鱼的体脂百分比与体水分之间呈现很强的负相关,并且不受进食、生长和性腺发育的影响[40],在罗非鱼[19]和牙鲆[20]中也发现了这种现象。此外,本研究检测了乌鳢幼鱼肝脏与脂肪生成(acc1、fasn)、脂肪分解(agt1、mgl和hsl)及脂肪氧化(aco、pparα和cpt1)相关的基因表达情况,结果显示,随着饲料中磷脂水平的增加,acc1基因的表达量显著下降,而agt1、mgl、hsl、aco、pparα和cpt1基因的表达量均有不同程度的上升,表明磷脂能够抑制乌鳢幼鱼肝脏中脂肪生成途径的活性,同时激活其脂肪分解或氧化途径的活性,从而减少体内脂肪的积累。
3.3 饲料磷脂对乌鳢幼鱼抗氧化能力的影响
过多的肝脏脂质沉积通常会对鱼类抗氧化能力产生负面影响[13,41]。在草鱼[1]、大黄鱼[17]、团头鲂[36]等硬骨鱼中,磷脂可以提高抗氧化能力。本研究中,饲料中添加磷脂显著降低了乌鳢幼鱼肝脏中MDA 的含量,提高了总抗氧化能力及SOD 的活力,减轻了幼鱼肝脏的氧化损伤,说明饲料中补充磷脂有助于增强乌鳢幼鱼抗氧化能力,减少了脂质过氧化。
3.4 饲料磷脂对乌鳢幼鱼肝脏、肌肉脂肪酸组成的影响
通常养殖鱼类的脂肪酸组成通常与实验饲料中的脂肪酸组成有关。在本研究中,肝脏和肌肉中C18:2n-6、C18:3n-3 和EPA(百分比脂肪酸)的浓度相对低于实验饲料,而样品中的DHA 浓度显著高于相应实验饲料中的DHA。淡水和鲑科鱼类可有效地将C18 PUFA 转化为长链PUFA[42]。本研究中,鱼类样品和实验饲料中脂肪酸含量的分析结果比较说明乌鳢具有长链PUFA 生物合成能力,并可进行EPA 与DHA 的转换,在之前的一些研究中也有类似的结果[14,39]。同时,本研究中饲料磷脂含量显著提高了EPA 和DHA 等长链PUFA 的浓度,但降低了C18 PUFA 浓度,这表明高浓度磷脂促进了C18 PUFA 向长链PUFA 转化。值得注意的是,已证实n-3 长链PUFA 在缓解草鱼[43]和大西洋鲑[44]等鱼类脂质沉积方面的潜在作用,本研究n-3 长链PUFA 浓度的增加部分说明了磷脂对脂质积累的缓解作用。
4 结论
在饲料中补充大豆磷脂可提高乌鳢幼鱼的生长性能,减少体内脂肪沉积,增强鱼体抗氧化能力,并通过调节脂肪酸代谢相关基因表达,抑制脂肪酸合成并促进脂肪氧化分解缓解肝脏脂肪积累。基于生长指标,本研究中乌鳢幼鱼饲料适宜磷脂添加水平为5.36%。
——白乌鳢

