多囊卵巢综合征患者颗粒细胞miR-3135b 的表达及临床意义
许珂,毕晓英,赵艳晓,王丹丹
(河南中医药大学第三附属医院生殖中心,河南 郑州 450000)
多囊卵巢综合征(Polycystic ovarian syndrome,PCOS) 是一种以排卵障碍和高雄激素血症为特征的女性生殖内分泌及代谢异常疾病[1],患者可出现卵巢增大、白膜增厚、多个不同发育阶段的卵泡,并伴有颗粒细胞黄素化[2]。 PCOS 的确切发病机制尚未明确, 目前普遍认为其临床表现及生化特征的复杂性和多样性, 与卵巢颗粒细胞增殖引起的内在异常密切相关[3-4]。 微小核糖核酸(microRNAs,miRNAs) 是一类在物种进化中相对保守的单链非编码小分子RNA, 其组织特异性和时序性可决定组织和细胞的功能特异性, 在细胞生长和发育过程的调节中具有重要作用[5]。 既往研究显示,PCOS患者体内miRNAs 的异常表达与颗粒细胞(Granulosa cells, GCs)生长、增殖和分化有关,miRNAs 表达涉及生理和病理变化, 可作为监测疾病进展的理想标志[6]。 本研究主要探讨分析PCOS 患者颗粒细胞miR-3135b 的表达及临床意义,旨在为PCOS发病机制的研究提供参考依据。
1 资料与方法
1.1 一般资料 选取2019 年1 月至2021 年1 月河南中医药大学第三附属医院收治的92 例因PCOS 导致不孕患者纳入PCOS 组,年龄25~45 岁,平均(31.29±2.41)岁,平均体质量指数(Body mass index,BMI)为(23.95±2.13) kg/m2。 纳入标准:(1)年龄>18 岁;(2)符合PCOS 诊断标准[7](符合以下三项中两项即可确诊:①稀发排卵或无排卵;②出现多毛、痤疮等高雄激素临床表现;③B 超检查结果显示卵巢出现多囊样改变)(3)近3 个月内未接受激素治疗者。 排除标准:(1)合并严重心、肝、肾等脏器功能不全及其他免疫性相关性疾病者;(2)合并高血压、糖尿病者;(3)合并凝血功能障碍、甲状腺功能亢进者;(4) 入组前3 个月内有手术史者;(5)合并子宫内膜异位症、输卵管积水者;(6)既往有异常流产史或胎儿发育异常史者;(7)合并恶性肿瘤或心理、精神疾病者。 选取92 例同期于本院因输卵管或男方不育等原因导致不孕患者纳入对照组,年龄26~45 岁,平均(31.75±2.26)岁,平均BMI 为(23.69±2.07) kg/m2,两组患者年龄、BMI 比较,差异无统计学意义(P>0.05)。本研究经伦理委员会通过。
1.2 检测方法
1.2.1 仪器与试剂 主要仪器实时定量PCR 仪(CFX96 型,美国Bio-Rad 公司),电泳仪(CPC-300型,上海百赛生物技术股份有限公司),凝胶成像分析系统(BIO-RAD 型, 上海艾研生物科技有限公司),分光光度计(NANO Drop 2000);主要试剂:TRIzol Reagent 试剂盒(上海双达生物技术有限公司),反转录试剂盒(北京伊塔生物科技有限公司),实时PCR 试剂盒(武汉纯度生物科技有限公司),DNA Marker (上海韵泰信息科技有限公司),RNA Marker(北京泽平科技有限责任公司)。
1.2.2 GCs 收集[8]于患者排卵日,在超声引导下经阴道穿刺抽吸卵泡,选取直径≥16 mm。操作步骤:(1)用针分离单个卵母细胞周围的GCs,取出卵丘卵母复合体,并收集剩余的卵泡液;(2)卵泡液离心后,弃上清,剩余沉淀物加透明质酸钠1 mL 充分混匀,水浴后移至无菌离心管,加入4 mL 淋巴细胞分离液后离心;(3) 取离心后GCs 至离心管内,接种于全营养培养基,置于37 ℃5%CO2 培养箱中培养24 h;(4) 将培养的GCs 细胞收集后于-80 ℃保存备用。
1.2.3 实时荧光定量聚合酶链式反应法 (Real-Time quantitative polymerase chain reaction, qRTPCR) 检测miR-3135b 的表达 采用Trizol 试剂抽提GCs 中总RNA, 使用分光光度计于260 nm 和280 nm 波长下测定所有样品中A260 /A280,并计算所有RNA 的浓度和纯度。 采用反转录试剂盒将RNA 反转录成cDNA,反应产物稀释后作为qRTPCR 模板。 使用实时荧光定量PCR 仪检测PCOS患者GCs 中miR-3135b 的表达,反应条件如下: 95℃预变热10 min、95 ℃15 s、55℃20 s、70 ℃20 s,如此循环40 次。以U6 为内参,引物序列见表1。用2-△△CT方法计算miR-3135b 的相对表达量,对比两组患者颗粒细胞miR-3135b 的表达。 文中所用引物序列均由华大基因设计。 所有步骤均严格按照各仪器及试剂说明书进行。

表1 引物序列
1.3 观察指标 记录两组患者年龄、 不孕年限、BMI、空腹血糖(Fasting blood glucose, FBG)、LH、FSH、LH/FSH、E2、 T、P、 FINS、FBG、PRL 及初始卵泡、闭锁卵泡、窦卵泡、过渡型初级卵泡、典型初级卵泡、次级卵泡、获卵数和胚胎形成率。 采用稳态评估模型评价计算HOMA-IR,计算公式为HOMAIR=(FINS×FBG)/405。 胰 岛 素 抵 抗 评 定 标 准:HOMA-IR>3.8。
1.4 统计学处理 采用SPSS 18.0 统计学软件进行数据分析, 满足正态分布且方差齐的计量资料采用(±s)表示,采用两样本独立t检验比较组间差异,用ROC分析miR-3135b 表达对PCOS 的诊断价值,P<0.05 为差异有统计学意义。
2 结果
2.1 两组患者一般资料和临床特征比较 两组患者年龄、不孕年限、BMI 和FBG 比较,差异无统计学意义 (P>0.05);PCOS 组患者LH、LH/FSH、P、T、FINS、HOMA-IR 和E2 均明显高于对照组,FSH、PRL 则低于对照组,差异有统计学意义(P<0.05)。见表2。
表2 两组患者一般资料和临床特征比较(±s)
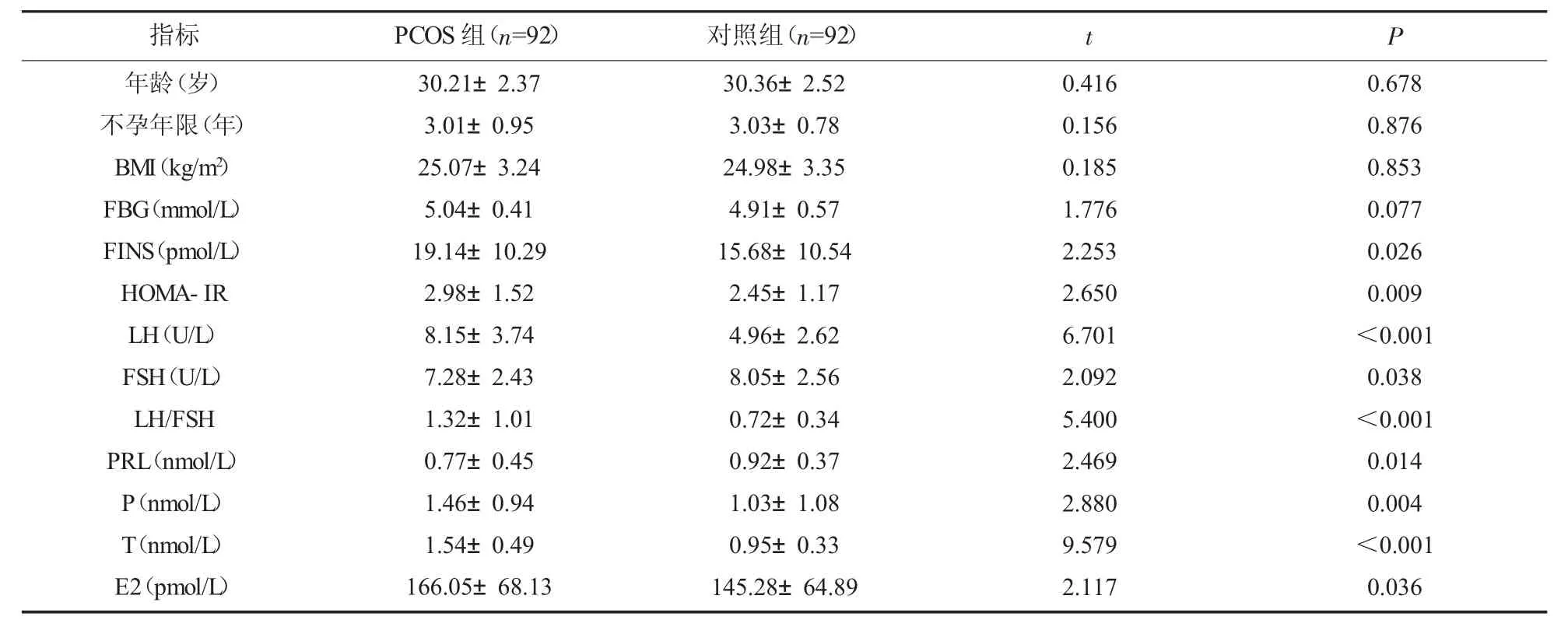
表2 两组患者一般资料和临床特征比较(±s)
指标 PCOS 组(n=92) 对照组(n=92) t P年龄(岁)不孕年限(年)BMI(kg/m2)FBG(mmol/L)FINS(pmol/L)HOMA-IR LH(U/L)FSH(U/L)LH/FSH PRL(nmol/L)P(nmol/L)T(nmol/L)E2(pmol/L)30.21±2.37 3.01±0.95 25.07±3.24 5.04±0.41 19.14±10.29 2.98±1.52 8.15±3.74 7.28±2.43 1.32±1.01 0.77±0.45 1.46±0.94 1.54±0.49 166.05±68.13 30.36±2.52 3.03±0.78 24.98±3.35 4.91±0.57 15.68±10.54 2.45±1.17 4.96±2.62 8.05±2.56 0.72±0.34 0.92±0.37 1.03±1.08 0.95±0.33 145.28±64.89 0.416 0.156 0.185 1.776 2.253 2.650 6.701 2.092 5.400 2.469 2.880 9.579 2.117 0.678 0.876 0.853 0.077 0.026 0.009<0.001 0.038<0.001 0.014 0.004<0.001 0.036
2.2 两组患者卵巢各级卵泡数及获卵数、胚胎成型率比较 两组患者初始卵泡、闭锁卵泡数和胚胎形成率比较,差异无统计学意义(P>0.05);PCOS 组过渡型初级卵泡、典型初级卵泡、次级卵泡、窦卵泡数和获卵数明显高于对照组, 差异有统计学意义(P<0.05)。 见表3。
表3 两组患者卵巢各级卵泡数及获卵数、胚胎成型率比较(±s)

表3 两组患者卵巢各级卵泡数及获卵数、胚胎成型率比较(±s)
指标 PCOS 组(n=92) 对照组(n=92) t P初始卵泡过渡型初级卵泡典型初级卵泡次级卵泡窦卵泡数闭锁卵泡数获卵数胚胎形成率20.51±7.26 10.23±2.81 5.42±2.65 1.72±1.03 34.14±11.32 3.28±2.65 16.29±5.32 0.47±0.25 19.24±5.12 6.78±2.60 2.01±0.73 1.06±0.68 17.68±5.65 2.79±1.42 13.34±4.98 0.46±0.18 1.371 8.644 11.899 5.129 12.479 1.563 3.883 0.311 0.172<0.001<0.001<0.001<0.001 0.119<0.001 0.756
2.3 GCs 中miR-3135b 的表达 采用qRT-PCR 检测GCs 中miR-3135b 的表达水平, 结果显示,PCOS 组中miR-3135b 表达量(1.92±1.08)显著高于对照组 (1.02±0.33), 差异有统计学意义 (P<0.05)。
2.4 miR-3135b 表达对PCOS 的诊断价值 根据2.3 结果,为测试miR-3135b 表达对PCOS 的诊断能力,建立了ROC曲线,结果显示,miR-3135b 表达诊断PCOS 的AUC为0.750, 截断值为1.55,敏感度为58.7%,特异度为95.7%(P<0.001)。见图1。

图1 miR-3135b 表达诊断PCOS 的ROC 曲线
3 讨论
PCOS 是导致育龄期妇女无排卵性不孕的主要病因[9],患者临床主要表现为持续无排卵和高雄激素血症,B 超检查可见卵巢呈现多囊样改变[10]。无排卵性不孕的主要原因为卵泡发育障碍, 导致其发育停滞于窦状卵泡阶段,无法进行有效排卵[11]。近年来有研究表明, 在细胞各功能中起重要作用的miRNA 参与了多种疾病的发生发展过程,被作为各种疾病的诊断或预后生物标志物在临床中广泛应用[12]。 本研究主要探讨PCOS 患者GCs 中miR-3135b 的表达,并分析其临床意义。
本研究对PCOS 导致不孕患者与因输卵管或男方不育等原因导致不孕患者的一般资料和临床特征进行对比分析,结果显示两组在LH、LH/FSH、P、T、FINS、HOMA-IR、E2、FSH 和PRL 差异有统计学意义。 其中,LH 和LH/FSH 显著说明PCOS 患者出现促性腺激素功能失调,T 水平升高提示高雄激素血症, 而FINS、HOMA-IR 升高则说明PCOS 患者出现高胰岛素血症和胰岛素抵抗, 这与孙守萍等[13]研究结果基本一致,证实了PCOS 具有高雄激素血症、高胰岛素血症、胰岛素抵抗和促性腺激素功能失调等生化特征。 本研究中,两组患者初始卵泡、闭锁卵泡数和胚胎形成率无显著差异,与对照组比,PCOS 组过渡型初级卵泡、典型初级卵泡、次级卵泡、窦卵泡数和获卵数明显增多,说明PCOS患者早期初级卵泡、 次级卵泡和窦卵泡数呈现增多趋势,与Pedroso[14]实验结论基本一致,但Pedroso发现PCOS 患者卵泡刺激素显著降低,分析其原因可能与PCOS 引起的卵巢功能障碍有关。
本研究采用qRT-PCR 检测miR-3135b 在PCOS 患者GCs 中的表达,结果显示其表达与在对照组患者中的表达存在显著的统计学差异, 与非PCOS 的对照组患者比较,PCOS 组中miR-3135b表达上调, 其表达量显著高于对照组患者, 提示miR-3135b 可能在PCOS 发病机制中具有重要作用。 卵巢GCs 是由原始卵泡中扁平卵泡细胞增殖形成的柱状多层颗粒细胞, 在成熟卵泡时期停止增殖,可传递营养物质和激素,在卵泡发育过程中发挥重要作用[15-16]。 卵泡发育异常是导致患者不孕不育,甚至自发性流产的主要原因[17]。有研究显示,卵巢GCs 中的miRNAs 以转录后调控方式参与生殖过程的调节,并调控激素合成,其异常表达与卵泡生长、发育关系密切[18]。 miR-3135b 可能通过降低增殖细胞核抗原表达, 达到抑制卵巢GCs 增生的目的。 miRNAs 对卵巢GCs 中E2、P 和T 等激素的分泌也有抑制作用, 可进一步影响卵母细胞的生长和发展[19]。 本研究结果证实,PCOS 患者GCs中miR-3135b 呈现高表达,Wang Y[20]的研究发现,PCOS 患者存在多种miRNAs 的差异表达, 其中miR-3135b 在PCOS 患者的GCs 中呈现更高的表达,可提高对PCOS 的预测准确性,这与本研究结论基本一致。 本研究采用ROC曲线分析了miR-3135b 表达对PCOS 的诊断价值, 结果显示miR-3135b 表达诊断PCOS 的AUC为0.750, 说 明miR-3135b 表达具有较好的PCOS 诊断价值。
综上所述,miR-3135b 在PCOS 患者GCs 中呈现高表达,在卵泡发育障碍中发挥重要作用,且对PCOS 诊断具有较好的预测价值。 本研究的不足之处在于未对与PCOS 患者卵泡发育相关的miR-3135b 信号通路进行系统阐述,后续仍需加大样本量进行深入研究, 但本研究仍为临床进一步了解PCOS 的病理生理机制提供了新思路。

