灯盏花倍性的流式细胞术检测优化
王梦钦,董云龙,徐 达,陈晓波,张云峰,2
(1.云南师范大学生命科学学院,昆明 650500;2.生物能源持续开发利用教育部工程中心,昆明 650500)
多倍化是植物新物种形成的重要方式,在自然界中广泛发生,可以帮助物种具备更广泛的环境适应能力,在高等植物进化中占有重要地位[1]。植物多倍化后形成更大的营养储存器官[2],产生更快、更为丰富的次生代谢产物[3],具有更强的抗病性和更好的环境适应性[4]。诸如异源多倍体化的燕麦(Avena sativa)、小麦(Triticum aestivum)、甘蔗(Saccharum officinarum)以及同源多倍体化的马铃薯(Solanum tuberosum)、草莓(Fragaria ananassa)、咖啡(Coffea arabicaL.)、烟草(Nicotiana tabacumL.)等为人类生产所利用[5]。灯盏花(Erigeron breviscapusHand.)又名短葶飞蓬、灯盏细辛,为菊科(Compositae)飞蓬属植物,主要分布于中国云南省(占全国95%以上),少数分布于四川、贵州和西藏等地[6],可用于治疗高血压、心脑血管病等多种疾病[7]。灯盏花人工大田栽培病虫害严重,连作障碍明显,严重制约了灯盏花产业的可持续发展[8]。灯盏花多倍体具有株型大、有效成分较高、抗性强等特性,进行灯盏花的多倍体品种选育是灯盏花育种的一种有效尝试[9]。
传统的植物倍性鉴定主要通过器官形态差异观察、生理生化指标测定、气孔大小检测等方法进行推测,准确度不高。采用染色体计数法虽然直观、准确,但对于染色体数目多、染色体小的植物而言,其技术要求相对较高[10]。流式细胞技术可针对细胞核中的DNA 进行荧光标记,快速准确地测定其DNA 含量和倍性水平[11],已广泛用于苹果(Malus pumilaMill.)、梨(Pyrus communis)、桑树(Morus albaLinn.)、菘蓝(Isatis indigoticaFortune)、草莓、水稻(Oryza sativaL.)、樱桃(Cerasus pseudocerasus G.Don)、马铃薯等的鉴别[12]。
菊科植物由于酚类、糖类物质含量较高,进行细胞裂解时易发生氧化反应造成细胞核沉积、黏连,影响了流式细胞仪的检测效果,尤其是多倍体的检测效果不佳。本研究通过对制样方式、细胞核悬液及荧光染料染色剂等工艺进行优化,建立灯盏花倍性鉴定的方法,旨在为灯盏花大规模的倍性鉴定奠定基础,推动灯盏花的育种工作。
1 材料与方法
1.1 材料
以云南师范大学生物工程中心遗传实验室培养的二倍体和四倍体灯盏花为材料来源,选取在MS 培养基中正常生长3 周左右的幼嫩叶片为供试材料。
1.2 解离液及染色液的配制
共设计3 种细胞解离液和2 种PI 染色液,其配方成分详见表1。

表1 解离液和染色液成分
1.3 制样方法
1.3.1 机器研磨法 将叶片用灭菌dd H2O2冲洗干净,擦干,放入离心管中加入钢珠,同时加入2 mL 解离液,放入研磨机中,温度设置为4 ℃,研磨1 min。
1.3.2 液氮研磨法 将叶片用灭菌dd H2O 冲洗干净,擦干,放入研钵中,加入5~10 mL 液氮迅速研磨成粉末,然后加入2 mL 预冷的解离液,再将其转入1.5 mL 离心管中插入冰上裂解30 min。
1.3.3 刀片切碎法 将叶片用灭菌dd H2O 冲洗干净,擦干,放入培养皿中同时加入2 mL 解离液,用吉利刀片迅速切2 min。
1.4 植物组织单细胞制备方法
选取培养瓶中生长状况好的幼嫩叶片,用灭菌dd H2O 冲洗干净、擦干后,按照“1.3”方法进行样品制备;随后用400 目的滤膜过滤至1.5 mL 离心管中,于4 ℃下静置10 min 后离心,转速1 000~2 000 r/min离心5 min,弃上清液,取沉淀物。在试管中加入预冷的按照“1.2”方法制备的解离液1 mL,加20 μL 1 mg/mL 预冷的染料,使其悬浮液与染料结合,4 ℃避光保存15~20 min,用400 目的滤膜过滤至上机管中待测。
1.5 流式细胞术测定与数据分析
使用艾森生物ACEA NovoCyte 型流式细胞仪,按照仪器操作说明进行测定,采用NovoExpress 1.3.0软件处理数据。以细胞核DNA 相对含量的总荧光强度为横坐标,细胞核数量为纵坐标,绘制流式峰值图;以细胞的总荧光强度为横坐标,细胞核颗粒度为纵坐标,绘制流式散点图。
2 结果与分析
2.1 不同方法制备的细胞核悬液效果比较
分别采用液氮研磨法、刀片切碎法和机器研磨法3 种方法制备灯盏花叶片样品,使用流式细胞仪进行细胞核悬液效果检测(图1)。由图1 可知,液氮研磨法和机器研磨法中细胞核没有显著聚集在一起,而刀片切碎法在总荧光强度106和106.2处分别呈现出细胞核的显著聚集,且不同荧光强度的2 个细胞核群可以完全地分开,表明刀片切碎法收集到了完整的细胞核。此外,图1c 中的细胞核聚集较为紧密,细胞核占比为67.77%。结果表明,刀片切碎法制备的灯盏花流式细胞样品效果较好。

图1 不同方法制备的细胞核悬液效果比较
2.2 不同细胞解离液解离的效果比较
采用3种细胞解离液分别对二倍体灯盏花(图2)和四倍体灯盏花细胞(图3)进行植物组织单细胞裂解。由图2 可知,采用解离液Ⅰ处理灯盏花二倍体叶片细胞,灯盏花叶片的流式细胞检验图峰型清晰且集中,在总荧光强度1.2 处出现峰值;解离液Ⅱ处理的样品,检验图出现了明显的杂乱峰;解离液Ⅲ处理的样品,峰型集中但不够清晰,总荧光强度1.2 后有杂乱峰。由图3 可知,解离Ⅰ处理的灯盏花四倍体叶片细胞出现了集中且清晰的2 个峰型,比二倍体更明显;解离液Ⅱ和解离液Ⅲ处理的样品,虽测出1 个峰,但峰型表现杂乱。结果表明,采用细胞解离液Ⅰ对灯盏花细胞进行裂解,不仅出峰清晰,且能较好地呈现出二倍体和四倍体细胞核DNA 峰型。因此,本研究选择解离液Ⅰ。
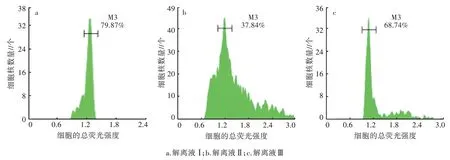
图2 不同解离液处理二倍体灯盏花叶片的流式细胞检验
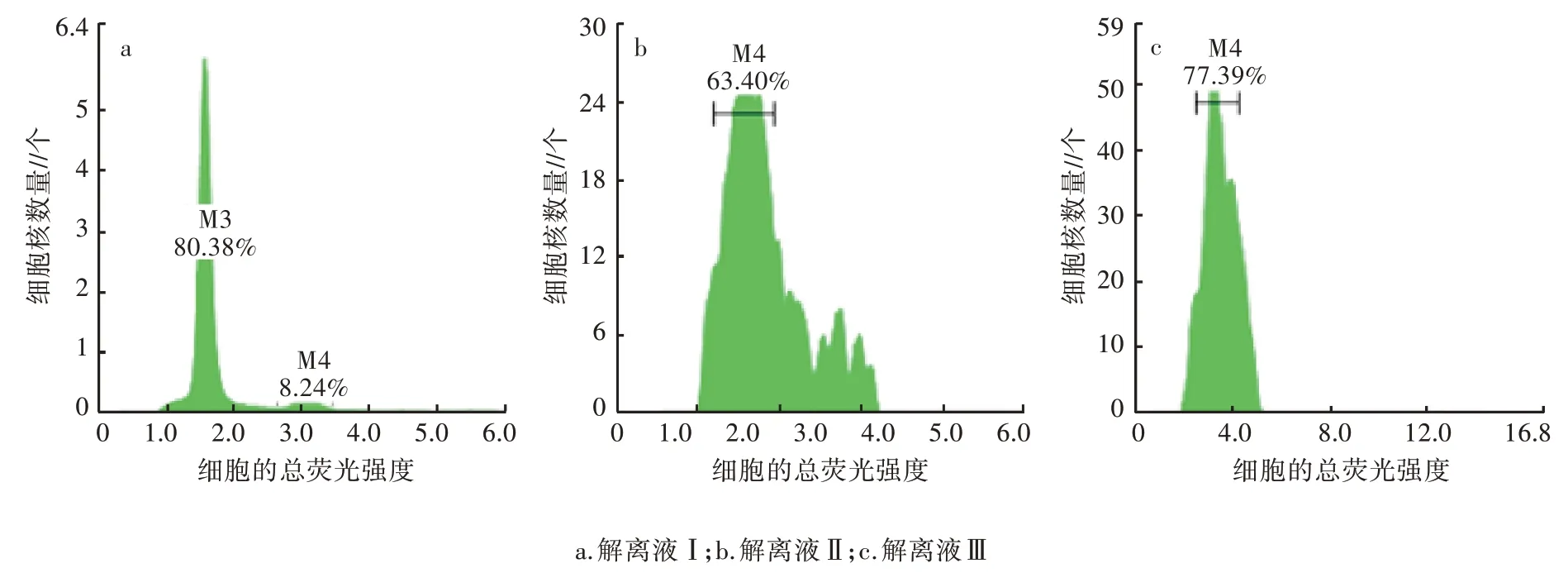
图3 不同解离液处理四倍体灯盏花叶片的流式细胞检验
2.3 不同染色液的效果比较
采用刀片切碎法制备样品,经解离液Ⅰ裂解后的细胞悬液分别用不同公司的PI 染色液进行染色,结果(图4)表明,使用BioFroxx 公司的粉末自配染色液可以明显减少细胞碎片造成的背景干扰,染色效果明显。因此,本研究选择BioFroxx公司的PI 染色液。
2.4 对继代苗体细胞变异的检验
在植物组织培养过程中,体细胞变异(Somaclonal variation)是时常发生的事件[13],尤其是继代数超过12 次以后。在灯盏花的组织培养过程中,发现再生植株呈现出不同的表型,对其叶片进行流式细胞测定,发现不同表型呈现出不同的峰型(图5)。图5a 灯盏花植株的流式细胞检验为二倍体,图5b 为单倍体,图5c 为四倍体,图5d 为混倍体,并进行了验证试验。组织培养过程中最常见的遗传不稳定性是倍性变化[14],体细胞无性系核型的改变包括染色体重排、非整倍体和整倍体。非整倍体可能是由染色体不分离、异常纺锤体、滞后染色体和/或染色体断裂引起的[15]。其中,多倍体化是染色体数量上最常见的变化,通常由内多倍体化(核内重复或有丝分裂)或核聚变引起[16]。许多研究表明,基因型[15]、继代培养次数、培养基类型、外植体状况都会导致体细胞无性系变异[17],尤其是培养基中2,4-d 的运用[18]。尽管如此,鲜见灯盏花组培中体细胞变异的相关报道。本研究表明,在灯盏花的组培快繁中的确存在体细胞变异。下一步可以利用组培过程中的变异体细胞筛选有用的变异株。
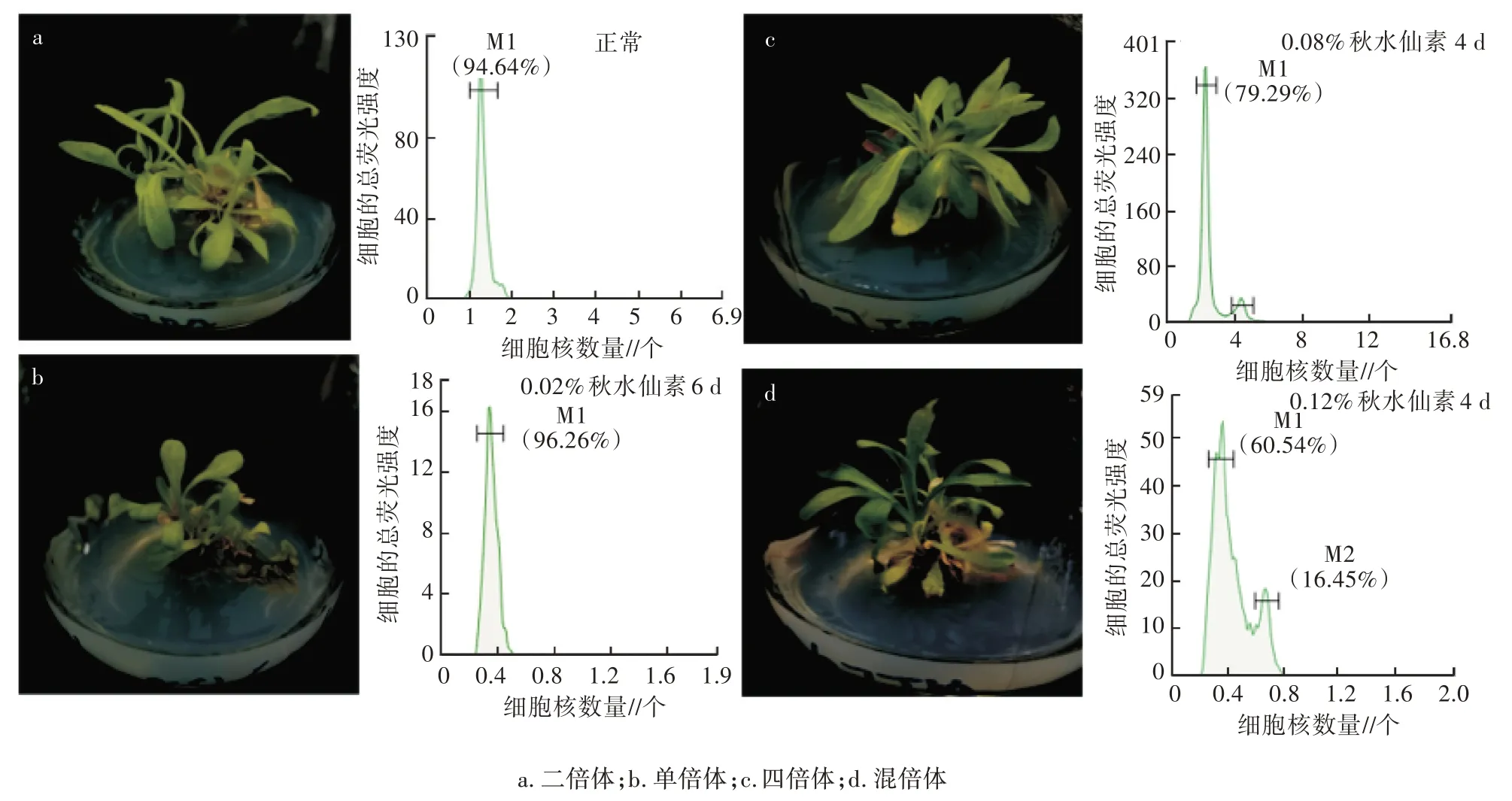
图5 流式细胞检验优化流程对灯盏花继代再生苗的检验
3 小结
利用染色体计数方法鉴定植株倍性,虽准确率高但操作繁锁,且技术要求高,所需材料为根尖,而取根通常会影响植物的正常生长,且不易鉴定出混倍体[10]。流式细胞检测不仅操作简单,取材多元化,且能测定基因组大小及鉴定混倍体。有许多因素会影响到流式细胞的检验结果,如材料来源[19]、细胞核解离液类型[20]、膜过滤次数[21]、DNA 荧光染料类型[22]等,尤其是材料选取不当,酚类、多糖、单宁等杂质的干扰会导致解离出来的单细胞核颗粒少,甚至形成较大的染色体峰。但是,采用适宜的解离液和解离方法可以消除此类干扰[23]。灯盏花多糖、酚类物质含量较高,本研究采用刀片研磨法制备样品,选择解离液I 进行植物组织裂解,使用Bio-Froxx 公司染料进行染色。优化后的工艺不仅能较好地检验灯盏花的倍性,同时也能检验出再生植株中的混倍体和单倍体。建立的流式细胞术测定灯盏花倍性检验体系,可为灯盏花多倍体育种提供参考。

