血清cfDNA、TC水平监测在乙型肝炎肝硬化失代偿期患者预后评估中的价值*
胡文坛, 刘红春, 徐 进, 戎庭军
(1.信阳市中心医院检验科,河南 信阳 464100; 2.郑州大学第一附属医院检验科,郑州 450000)
慢性乙型肝炎是因乙型肝炎病毒持续感染引发的肝脏病症,于临床多见[1]。据悉全球罹患慢性乙型肝炎病例3.5亿~4亿,其中,近1/3来自我国(1.1亿),现已成为困扰全球健康公共卫生问题[2-3]。目前该病尚无特异性治疗方案, 现阶段以抗病毒治疗常用,可最大限度延缓病情进展,但部分患者可因机体持续存在的炎症坏死损伤肝细胞进一步发展为肝硬化失代偿甚至肝细胞癌(HCC)等终末期肝病[4]。因肝硬化失代偿期通常伴有黄疸、腹水、感染、肝性脑病等并发症,患者普遍预后不佳,故早期及时识别对乙型肝炎肝硬化失代偿期患者预后意义重大[5]。但截至目前,通过监测白蛋白(Alb)、钠(Na+)等临床血清学指标诊断价值有限,且构建经典预后模型Child-Turcotte-Pugh(CTP)、国际标准化比值(INR)及终末期肝病模型(MELD)临床应用亦有不足[6]。故发掘特异性临床血清学指标用以完善预后模型仍为现今研究热点。有研究[7]证据指出,不同病因所致肝硬化失代偿期均可出现血脂异常改变,且随CTP分级增加,血脂可相应下降。而循环游离DNA(cfDNA)由受损组织细胞或炎症细胞释放,可在严重创伤性脑损伤[8]、非小细胞肺癌(NSCLC)[9]等发生、进展中发挥关键作用。且有研究[10]证实cfDNA可用于肝硬化患者HCC的早期预测。这提示肝硬化患者病情加重后血清cfDNA呈高水平,故将cfDNA用于乙型肝炎肝硬化失代偿期预后评估是可行的。本研究旨在探讨血清cfDNA、TC水平监测在乙型肝炎肝硬化失代偿期患者预后评估中的应用价值,报道如下。
1 对象与方法
1.1 对象 选取2019年1月—2022年1月信阳市中心医院诊治的90例肝炎肝硬化失代偿期患者,纳入标准:①符合《慢性乙型肝炎防治指南》中肝硬化失代偿期诊断标准[11]。②初始均应用基础抗病毒治疗方案,即阿德福韦酯+拉米夫定/替比夫定。③预期生存期>6个月。④患者及家属对研究知情同意。排除标准:①其他病因或不明病因所致肝病,如酒精性肝病、胆汁淤积性肝病、自身免疫性肝病等。②合并恶性肿瘤。③伴发全身严重感染。④既往接受相关手术史,如脾切除术、门静脉分流术等。⑤合并消化道出血。⑥行糖皮质激素或免疫抑制剂治疗。⑦临床资料缺失。本研究已通过医院伦理委员会审查。
1.2 方法
1.2.1 分组方法 随访2年,其间以死亡为终点予以分组,分为存活组(n=54)、死亡组(n=36)。
1.2.2 观察指标
1.2.2.1 人口学信息 包括年龄、性别(男/女)、合并基础病(含糖尿病、高血压等,分有/无)、家族史(有/无)、吸烟史(有/无)、饮酒史(有/无)。
1.2.2.2 临床指标 均于入组时进行测定,包括谷草转氨酶(AST)、谷丙转氨酶(ALT)、碱性磷酸酶(ALP)、谷氨酰转移酶(GGT)、总胆红素(TBil)、Alb、肌酐(Scr)、尿素氮(BUN)、钠(Na+)、血红蛋白(Hb)、血小板(PLT)计数、白细胞(WBC)计数、淋巴细胞计数、中性粒细胞计数、凝血酶原时间(PT)、甘油三酯(TG)、总胆固醇(TC)、血清cfDNA。
1.2.2.3 经典预后模型 项目计算CTP评分、INR及MELD评分。①CTP:以ALb(>35 g·L-1计1分,28~35 g·L-1计2分,<28 g·L-1计3分)、TBil(<34 μmol计1分、34~51 μmol计2分、>51 μmol计3分)、PT(≤14 s计1分、15~17 s计2分、≥18 s计3分)、腹水(无计1分,消退容易计2分,消退困难计3分)及肝性脑病(无计1分、Ⅰ~Ⅱ度计2分、Ⅲ~Ⅳ度计3分)5方面累积计分,总分15分,分A(5~8分)、B(9~11分)及C级(12~15分)。②INR:即PT/国际敏感度指数(ISI)比值。③MELD评分:计算公式:3.8×In(TBil)(mg·dL-1)+9.6×In(Scr)(mg·dL-1)+11.2In(INR)(mg·dL-1)+6.4×病因(因本文对象均为乙型肝炎肝硬化失代偿期患者,病因为1),统计结果取整数。
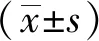
2 结果
2.1 2组患者临床资料比较 随访2年,90例乙型肝炎肝硬化失代偿期患者中死亡36例,占40.0%。死亡组AST、ALT、TBil、Scr、WBC计数、淋巴细胞计数、PT、cfDNA、CTP评分、INR、MELD评分高于存活组,Alb、Na+、中性粒细胞计数、TC低于存活组,差异有统计学意义(P<0.05),其他指标差异无统计学意义(P>0.05)。见表1。

表1 2组患者临床资料比较
2.2 乙型肝炎肝硬化失代偿期患者预后Cox比例风险模型多因素分析 经Cox比例风险模型多因素分析结果显示:影响乙型肝炎肝硬化失代偿期患者预后独立性风险因素为cfDNA(HR:1.004;95%CI:1.001~1.008)、CTP评分(HR:1.300;95%CI:1.022~1.653)及MELD评分(HR:1.874;95%CI:1.203~2.921),独立性保护因素为TC(HR:0.412;95%CI:0.183~0.929)。见表2。

表2 乙型肝炎肝硬化失代偿期患者预后Cox比例风险模型多因素分析
2.3 单一风险因素预测乙型肝炎肝硬化失代偿期患者预后ROC曲线分析结果 经ROC曲线分析结果显示:相比于CTP评分、MELD评分经典预后模型,cfDNA、TC诊断效能稍低,其中,cfDNA评估乙型肝炎肝硬化失代偿期患者预后灵敏度、特异度依次为94.45%、57.41%,此时AUC值为0.854,最佳截断值为3 019 μg·L-1,TC评估乙型肝炎肝硬化失代偿期患者预后灵敏度、特异度依次为80.56%、79.63%,此时曲线下面积(AUC)值为0.818,最佳截断值为2.75 mmol·L-1。见表3、图1。

图1 单一风险因素预测乙型肝炎肝硬化失代偿期患者预后ROC曲线分析

表3 单一风险因素预测乙型肝炎肝硬化失代偿期患者预后ROC曲线分析结果
2.4 不同分层乙型肝炎肝硬化失代偿期患者生存情况 根据cfDNA、TC最佳截断值分作高/低cfDNA组、高/低TC组,由Kaplan-Meier生存曲线显示:TC<2.75 mmol·L-1乙型肝炎肝硬化失代偿期患者生存时间短于TC≥2.75 mmol·L-1,cfDNA≥3 019 μg·L-1乙型肝炎肝硬化失代偿期患者生存时间短于cfDNA<3 019 μg·L-1,差异有统计学意义(P<0.05)。见表4、见图2-3。

图2 乙型肝炎肝硬化失代偿期患者TC分层Kaplan-Meier生存曲线
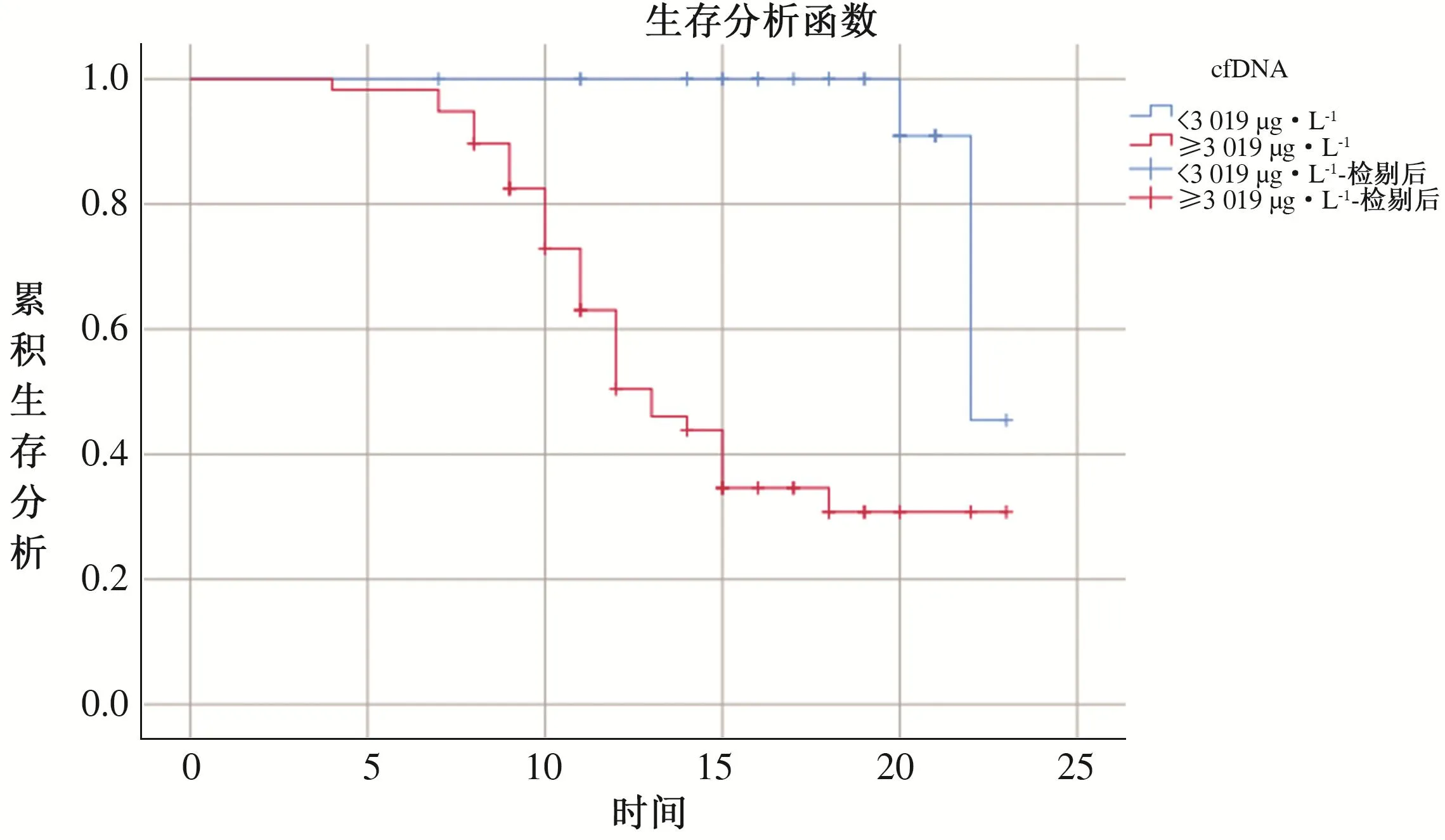
图3 乙型肝炎肝硬化失代偿期患者TC分层Kaplan-Meier生存曲线
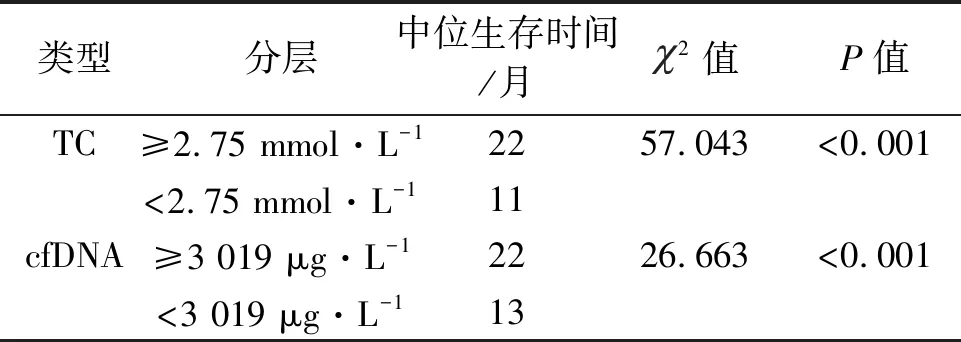
表4 不同分层乙型肝炎肝硬化失代偿期患者生存情况
3 讨论
肝硬化失代偿期患者中近一半(49.3%)均由慢性乙型肝炎导致发生[12]。且相比于代偿期肝硬化患者,肝硬化失代偿期患者预后更差[13]。本研究结果显示:慢性乙型肝炎肝硬化失代偿期2年生存期为40.0%,与吴雄健等[14]研究的39.53%(34/86)相当。目前,该病以肝移植为最有效手段,但因供体肝缺乏,患者多行抗病毒治疗用以病情延缓。由此,于早期评估患者肝脏功能对患者预后判定具有重要价值。
因慢性乙型肝炎肝硬化失代偿期患者预后影响因素良多,由KUMADA等[15]研究证实,慢性乙型肝炎肝硬化失代偿期患者非肝脏相关病死率影响因素为年龄(HR:2.692),肝脏相关死亡率影响因素为男性(HR:3.045)、血脂异常(HR:0.182)。QI[16]研究认为,MELD模型、血清淋巴细胞计数/单核细胞比率为慢性乙型肝炎肝硬化失代偿期患者1个月病死率独立预测因子。Alb、INR指标异常与慢性乙型肝炎肝硬化失代偿期患者不良事件具有密切关联[17]。此外,BROWN等[18]在MELD模型加入Na+便于准确评估慢性乙型肝炎肝硬化失代偿期患者肝脏损伤严重程度。本研究经单因素及Cox比例风险模型多因素分析结果显示,TC、cfDNA、CTP评分及MELD评分均为慢性乙型肝炎肝硬化失代偿期患者预后影响因素。提示除CTP评分及MELD评分等经典预后模型外,TC、cfDNA等临床血清学指标可对患者预后产生重要影响。虽然经典预后模型于临床应用存在一定不足,譬如CTP评分中5维度权重相当,在综合分析过程中存在过度或过低评估的可能,且腹水、肝性脑病评定具有较强主观性,MELD评分计算困难,且评分<20分灵敏度、特异度有一定降低。但本研究ROC曲线分析结果显示,CTP评分、MELD评分用于慢性乙型肝炎肝硬化失代偿期患者预后评估AUC值依次为0.888、0.900,表明上述量表于临床具有较强适用性,而为进一步提高诊断效能,有待对模型作进一步完善。本研究将TC、cfDNA作ROC曲线发现,其AUC值分别为0.818、0.854,表明TC、cfDNA可较好评估慢性乙型肝炎肝硬化失代偿期患者预后。现作具体分析:①TC:由于肝脏可行使TC合成、储运、转运及降解功能,肝脏功能正常时,机体TC水平于一定范围内维持动态平衡。处于慢性乙型肝炎肝硬化失代偿期,患者随时间延长可出现肝功能损伤,通过减少活性肝细胞、阻碍载脂蛋白A合成及减少磷脂酰胆固醇脂酰转移酶等方式使血清TC水平下降[19]。②cfDNA:cfDNA组成包括70~200 bp小片段及21 000 bp较大片段,呈游离态,可随血液进行自主循环。一般来说,cfDNA可在患者体液中维持动态循环,若罹患慢性乙型肝炎肝硬化失代偿,因乙型肝炎病毒复制激活机体免疫反应可引起肝细胞损伤,由此大量炎症因子释放,此过程中cfDNA可降解为小片段进而血液循环,故导致cfDNA在慢性乙型肝炎肝硬化失代偿患者血清中呈高水平[20]。且本研究通过最佳截断值予以分层绘制Kaplan-Meier生存曲线证实,高TC水平、低cfDNA水平可获较长生存期,这可对上述结论准确性作进一步佐证。但本研究存在以下局限:①纳入例数较少,仅90例,需扩大样本量作进一步分析。②研究设计之初旨在发现新型临床血清学指标,尚未将TC、cfDNA融合经典预后模型构建新型预后模型,作为下一步研究方向。
综上所述,监测血清cfDNA、TC水平用于乙型肝炎肝硬化失代偿期患者预后评估有一定价值。

