六灵解毒丸抑制金黄色葡萄球菌致大鼠急性咽炎的作用机制研究
高雨嫣,卢金福,吕高虹,王恒斌,罗年翠,杨方钰,许惠琴,喻斌,狄留庆,杜萍(1.南京中医药大学药学院,江苏南京 21002;2.江苏省中药药效与安全性评价重点实验室,江苏南京 21002;.雷允上药业集团有限公司,江苏苏州 21009;4.江苏省中药高效给药系统工程技术研究中心,江苏南京 21002;.南京中医药大学附属医院,江苏南京 210029)
急性咽炎是一种主要由病毒、细菌或其他因素引发的上呼吸道急性感染性疾病,主要特征为咽部、鼻咽和扁桃体组织发炎,可出现灼热、疼痛等症状[1]。急性咽炎久治不愈、反复发作可转为慢性咽炎。六灵解毒丸由六神丸化裁而来,是部颁药品标准收载的中药成方制剂,具有清热解毒、消肿止痛等功效,是治疗喉痹的常用中药,对急性咽炎疗效显著[2-3]。前期研究[4]表明,六灵解毒丸对15%氨水咽部喷雾诱导的急性咽炎大鼠有较好的治疗作用。本研究拟进一步通过金黄色葡萄球菌感染致急性咽炎大鼠模型,探讨六灵解毒丸对感染性急性咽炎的治疗作用及相关机制,以期为其临床用药提供更丰富的科学依据。
1 材料与方法
1.1 动物SPF级SD大鼠,体质量90~100 g,雌雄兼用,由南京市江宁区青龙山动物繁殖场提供,实验动物生产许可证号:SCXK(苏)2017-0001。本实验经南京中医药大学实验动物伦理委员会审批,批文号:012009026206。
1.2 药物及试剂六灵解毒丸,苏州雷允上药业集团有限公司,批号:RAO2001;临用前取六灵解毒丸50 粒(175 mg),研磨成粉末后,用适量生理盐水溶解并定容至50 mL,摇匀,终浓度为3.5 mg·mL-1;取适量储备液,倍比稀释成1.75、0.875、0.437 5 mg·mL-1,备用。蓝芩口服液(每瓶10 mL),泰州扬子江药业有限公司,批号:19010422。
白细胞介素1β(IL-1β)抗体(批号:GR309542-28)、白细胞介素6(IL-6)抗体(批号:GR3190303-16)、肿瘤坏死因子α(TNF-α)抗体(批号:GR3272631-3),均购自英国Abcam公司;IL-1β ELISA检测试剂盒(批号:202009)、IL-6 ELISA 检测试剂盒(批号:202009)、TNF-α ELISA检测试剂盒(批号:202009),均购自上海酶联生物科技有限公司;β-actin 抗体,南京巴傲得(Bioworld)生物科技有限公司,批号:AA1217J7525ACTB1;辣根酶标记山羊抗兔二抗,美国Cell Signaling公司,批号:28;辣根酶标记山羊抗小鼠二抗,武汉博士德(BOSTER)生物公司,批号:BST11C18B50;RIPA 裂解液(批号:20191114)、PMSF(批号:20190614),北京索莱宝科技有限公司;上样缓冲液,上海碧云天生物技术有限公司,批号:082919200302。
1.3 主要仪器Synergy HT 型酶标仪,美国Bio-Tek公司;Mini-PROTEAN3 Cell 凝胶电泳仪,美国Bio-Rad 公司;LAS 4000 mini 凝胶成像系统,美国GE 公司;Allegra 64R 型台式高速冷冻离心机,美国贝克曼库尔特有限公司;Centrifuge 5702 型常温离心机,德国Eppendorf公司;TY-80S型脱色摇床,常州国宇仪器制造有限公司。
1.4 模型复制、分组及给药随机选取10 只SD 大鼠作为空白组,其余大鼠制备急性咽炎模型[5]:用注射器吸取含菌量为1×109CFU·mL-1的金黄色葡萄球菌溶液0.02 mL,以近似水平方向注入大鼠上颌口颊部分的口腔黏膜处,24 h后重复感染1次,造模第3天即可形成大鼠急性咽炎模型。将造模成功的大鼠随机分为5 组:模型组、蓝芩口服液组(原液5 mL·kg-1)及六灵解毒丸低、中、高剂量组(4.375、8.750、17.500 mg·kg-1),每组10 只。给药组大鼠每日灌胃给药1 次,连续7 d,模型组及空白组灌胃给予等体积生理盐水。
1.5 一般情况观察及咽喉局部炎症评分造模及给药期间每天观察并记录大鼠一般情况,包括皮毛、活动、饮食、体质量、死亡等情况。参照相关研究[6-7]对咽喉局部炎症情况进行评分,评分标准如下:①咽部无异常(-),计0 分;②咽部略有泛红(+),计1分;③咽部有明显红肿充血的现象(++),且大鼠时常抓挠,计2 分;④咽部有明显红肿充血现象(+++),且有溃疡处,计3分。
1.6 大鼠咽部组织病理学观察末次给药后处死大鼠,取咽部组织,用4%多聚甲醛溶液固定24 h,经脱水、透明、石蜡包埋后制备切片(4 μm);将切片经二甲苯脱蜡、梯度乙醇脱水后,进行常规苏木素-伊红(HE)染色;切片经梯度乙醇脱水、二甲苯透明后,中性树脂封片;于光学显微镜下观察各组大鼠咽部组织病理变化,并进行病理学评分[8]。
1.7 ELISA 法检测大鼠血清IL-1β、IL-6、TNF-α含量末次给药后,大鼠隔夜禁食12 h,用0.3%戊巴比妥钠腹腔注射麻醉后,腹主动脉取血,以3 000×g离心10 min,取上清液。严格按照ELISA 试剂盒说明书步骤操作,检测大鼠血清中炎症因子IL-1β、IL-6、TNF-α的水平。
1.8 免疫组化法检测大鼠咽部组织中IL-1β、IL-6、TNF-α 蛋白表达水平取大鼠新鲜咽部组织制备切片,脱蜡后以梯度乙醇水化;组织切片置于柠檬酸(pH=6.0)溶液中进行抗原修复,取出;将切片放入3%过氧化氢溶液,室温下避光孵育25 min;将切片置于PBS(pH=7.4)中脱色;加BSA 后在室温下封闭30 min,弃封闭液;加入一抗,4 ℃下孵育过夜;PBS 洗涤,加HRP 标记的二抗(辣根过氧化物酶标记),室温下孵育50 min;DAB 显色、冲洗,经复染、分色、脱水处理后封片。在光学显微镜下观察、拍照,采用ImageJ 图像分析软件进行统计分析,以阳性染色区域面积比作为目的蛋白表达水平。
1.9 Western Blot 法检测大鼠咽部组织中IL-1β、IL-6、TNF-α 蛋白表达水平取大鼠咽部黏膜下结缔组织适量,剪碎后,加入RIPA裂解液(1% PMSF);充分匀浆后置于冰上水平震荡裂解30 min,分装于EP 管中,以4 ℃、20 000×g离心10 min,取上清;采用BCA 法测定样品蛋白含量。加上样缓冲液制备样品,上样量为50 μg;经SDS-PAGE 电泳后,转移至PVDF 膜;以5% BSA 封闭2 h 后,加入一抗,4 ℃下孵育过夜;洗膜后,加IL-1β、TNF-α的二抗(HRP标记山羊抗兔IgG,1∶5 000)和IL-6的二抗(HRP标记山羊抗小鼠IgG,1∶2 000),室温下孵育1 h;洗膜后,采用ECL 显影并扫描;采用ImageJ 图像软件分析蛋白条带灰度值,以β-actin 为内参,对目的蛋白进行半定量分析。
1.10 统计学处理方法采用GraphPad Prism 6.0统计软件进行数据分析;计量资料以均数±标准差(±s)表示;多组间比较采用单因素方差分析(One-way ANOVA),两两比较采用LSD-t检验;以P<0.05 为差异有统计学意义。
2 结果
2.1 六灵解毒丸对急性咽炎大鼠一般体征的影响结果见表1、表2。造模3 d 后,大鼠出现精神状态欠佳、食欲不振、懒动等症状,且口腔分泌物增多,咽喉部均出现“++”至“+++”的红肿,表明急性咽炎大鼠模型复制成功。与空白组比较,模型组大鼠咽喉红肿程度显著增加,炎症评分显著升高(P<0.01),造模后第5~7 天的体质量显著降低(P<0.05,P<0.01)。与模型组比较,蓝芩口服液组及六灵解毒丸低、中、高剂量组大鼠的咽喉红肿程度明显减轻,炎症评分显著降低(P<0.01);造模后第7 天蓝芩口服液组及六灵解毒丸中、高剂量组大鼠的体质量显著增加(P<0.01)。
表1 六灵解毒丸对急性咽炎大鼠咽喉炎症评分的影响(±s)Table 1 Effect of Liuling Jiedu Pills on laryngopharyngeal inflammation score of acute pharyngitis rats(±s)

表1 六灵解毒丸对急性咽炎大鼠咽喉炎症评分的影响(±s)Table 1 Effect of Liuling Jiedu Pills on laryngopharyngeal inflammation score of acute pharyngitis rats(±s)
注:与空白组比较,**P<0.01;与模型组比较,##P<0.01
炎症评分/分0 2.83±0.28**1.29±0.90##1.12±0.66##0.88±0.66##0.22±0.35##组别空白组模型组蓝芩口服液组六灵解毒丸低剂量组六灵解毒丸中剂量组六灵解毒丸高剂量组剂量/(mg·kg-1)+++++--鼠数/只10咽喉红肿程度-10 5 mL·kg-1 4.375 8.750 17.500 6 7 8 8 9 0 2 2 3 7+0 0 2 3 3 2 0 1 2 3 2 0 0 5 1 0 0 0
表2 六灵解毒丸对急性咽炎大鼠体质量的影响(±s)Table 2 Effect of Liuling Jiedu Pills on body mass of acute pharyngitis rats(±s)

表2 六灵解毒丸对急性咽炎大鼠体质量的影响(±s)Table 2 Effect of Liuling Jiedu Pills on body mass of acute pharyngitis rats(±s)
注:与空白组比较,*P<0.05,**P<0.01;与模型组比较,##P<0.01
组别空白组模型组蓝芩口服液组六灵解毒丸低剂量组六灵解毒丸中剂量组六灵解毒丸高剂量组剂量/(mg·kg-1)造模后体质量/g第7天173.56±11.60 138.78±11.85*155.34±7.53##145.22±20.62 154.13±10.20##162.42±13.37##--鼠数/只10 5 mL·kg-1 4.375 8.750 17.500 6 7 8 8 9造模前体质量/g 94.85±3.77 96.23±1.55 92.80±4.14 93.35±2.94 94.11±2.23 94.01±4.49第1天122.96±4.68 125.97±4.20 124.04±4.26 123.14±8.78 120.81±8.07 124.99±8.11第3天133.31±8.48 125.63±9.53 130.74±7.35 127.76±12.44 124.74±8.42 129.18±9.96第5天151.08±10.04 132.02±13.63**141.57±6.03##133.49±13.69 138.78±9.25 142.37±10.71
2.2 六灵解毒丸对急性咽炎大鼠咽部组织病理变化的影响结果见图1。空白组大鼠的咽部组织黏膜上皮结构完整,未见明显上皮细胞变性和坏死等。与空白组比较,模型组大鼠咽部组织可见大量正常黏膜纤毛上皮消失,黏膜上皮变薄,局部仅可见一层排列疏松的上皮细胞(图1-B,黑色箭头),固有层可见少量淋巴细胞浸润(图1-B,棕色箭头),且腺体数量丰富,多为黏液腺体,病理学评分显著升高(P<0.01)。与模型组比较,蓝芩口服液组及六灵解毒丸中、高剂量组大鼠的咽部组织黏膜上皮结构完整,变性和坏死的上皮细胞明显减少,炎性细胞浸润明显减轻,病理学评分明显降低(P<0.05,P<0.01)。


图1 六灵解毒丸对急性咽炎大鼠咽部组织病理变化的影响(HE 染色,×200;±s,n=6~10)Figure 1 Effect of Liuling Jiedu Pills on pharyngeal histopathologic changes of acute pharyngitis rats(HE staining,×200;±s,n=6-10)
2.3 六灵解毒丸对急性咽炎大鼠血清炎症因子水平的影响结果见图2。与空白组比较,模型组大鼠血清炎症因子IL-1β、IL-6、TNF-α水平均显著上升(P<0.01)。与模型组比较,蓝芩口服液组及六灵解毒丸低、中、高剂量组大鼠的血清IL-1β、IL-6、TNF-α水平均显著下降(P<0.01)。

图2 六灵解毒丸对急性咽炎大鼠血清中IL-1β、IL-6、TNF-α 水平的影响(±s,n=6~10)Figure 2 Effect of Liuling Jiedu Pills on the level of IL-1β,IL-6 and TNF- α in serum of acute pharyngitis rats(±s,n=6-10)
2.4 六灵解毒丸对急性咽炎大鼠咽部组织中炎症因子表达水平的影响结果见图3~图6。与正常组比较,模型组大鼠咽部组织中IL-1β、IL-6、TNF-α蛋白表达水平显著升高(P<0.01)。而与模型组比较,蓝芩口服液组及六灵解毒丸中、高剂量组大鼠咽部组织中IL-1β、IL-6、TNF-α蛋白表达水平显著降低(P<0.05,P<0.01)。

图3 六灵解毒丸对急性咽炎大鼠咽部组织中IL-1β 蛋白表达的影响(免疫组化,×200;±s,n=3)Figure 3 Effect of Liuling Jiedu Pills on the protein expression of IL-1β in throat tissue of acute pharyngitis rats(IHC,×200;±s,n=3)


图4 六灵解毒丸对急性咽炎大鼠咽部组织中IL-6 蛋白表达的影响(免疫组化,×200;±s,n=3)Figure 4 Effect of Liuling Jiedu Pills on the protein expression of IL-6 in throat tissue of acute pharyngitis rats(IHC,×200;±s,n=3)

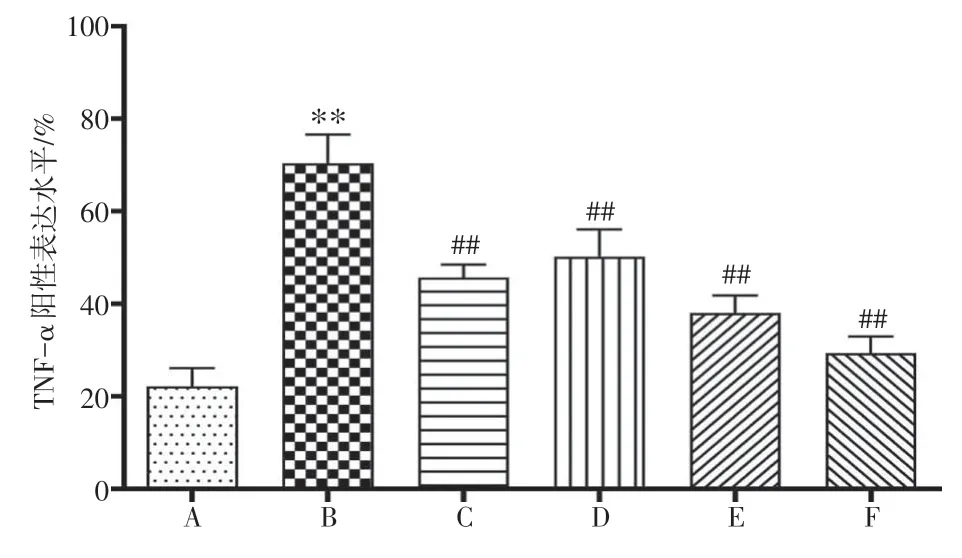
图5 六灵解毒丸对急性咽炎大鼠咽部组织中TNF-α 蛋白表达的影响(免疫组化,×200;±s,n=3)Figure 5 Effect of Liuling Jiedu Pills on the protein expression of TNF-α in throat tissue of acute pharyngitis rats(IHC,×200;±s,n=3)

图6 六灵解毒丸对急性咽炎大鼠咽部组织中IL-1β、IL-6、TNF-α 蛋白表达的影响(±s,n=3)Figure 6 Effect of Liuling Jiedu Pills on the protein expressions of IL-1β,IL-6 and TNF-α in pharyngeal tissue of acute pharyngitis rats(±s,n=3)
3 讨论
人体的咽喉部存在许多条件致病菌,当菌群失衡、人体抵抗力下降则容易诱发感染,形成急性咽炎。除了病毒感染以外,金黄色葡萄球菌感染较为常见,因此本研究采用将金黄色葡萄球菌注入大鼠咽喉的方法模拟复制临床急性咽炎动物模型。该模型稳定、可靠,模型组的病理改变与急性咽炎的临床特征基本吻合。
急性咽炎属于中医“喉痹”范畴,《素问·阴阳别论》中记载:“一阴一阳结,谓之喉痹”,多因风、热、痰、火所致,治宜疏风、清热、祛痰、泻火。六灵解毒丸由人工牛黄、珍珠、石菖蒲等组成,方中主药人工牛黄清热解毒、化痰定惊;珍珠解毒生肌、安神定惊;石菖蒲开窍豁痰、化湿开胃;诸药合用共奏清热解毒、消肿止痛、化湿祛痰之功效[9]。本研究结果显示,六灵解毒丸可明显改善金黄色葡萄球菌致急性咽炎大鼠的咽部组织炎症病理改变,减少炎性细胞浸润,保护黏膜上皮细胞,能够显著降低血清炎性因子IL-1β、IL-6、TNF-α的水平,下调咽部组织中IL-1β、IL-6、TNF-α 蛋白表达。
炎症是机体受到伤害性刺激后形成的一种防御性反应如稀释毒素、修复组织等,但过于剧烈的炎症反应往往加重机体的损伤,甚至危及生命,因此炎症控制是临床治疗的重要环节。细胞因子是炎症过程的重要参与者,主要由激活的淋巴细胞和单核细胞产生,如IL-1β、TNF-α 等[10-12]。IL-1 具有广泛的生物学活性,如免疫调节、刺激肾上腺皮质激素释放、刺激骨髓释放中性粒细胞等。其中IL-1β的促炎活性较强,通过IL-1R信号转导可诱导多种促炎介质如细胞因子、趋化因子的产生,并最终导致广泛的炎症反应,如急性期反应、发热、血管扩张、低血压等全身性反应,在局部促进黏附分子、趋化因子的合成与分泌,继而促进淋巴细胞的募集,导致炎性细胞浸润。在此基础上,免疫细胞被进一步激活而放大炎症。
核转录因子κB(NF-κB)是细胞受到有害刺激后的第一反应者,经NF-κB抑制蛋白(IκB)丝氨酸磷酸化、泛素化修饰等过程释放NF-κB 二聚体;NF-κB进入细胞核与相关位点的基因结合,启动IL、TNF等炎症因子的转录进程,触发NLRP3 炎症小体的组装和活化。NLRP3 炎症小体通过蛋白水解切割促使含半胱氨酸的天冬氨酸蛋白水解酶原1(pro-Caspase-1)变为有活性的Caspase-1,活化的Caspase-1 对pro-IL-β 剪切,使其成为有活性的IL-1β[13-14]。另一方面,炎症细胞因子同时也具有激活NF-κB 的作用[15],在炎症反应中构成瀑布式的放大效应。
在炎症反应中,IL-6 的升高早于其他细胞因子,也早于C 反应蛋白(CRP)和降钙素原(PTC),而且持续时间长,因此可用于急性炎症的早期辅助诊断。局部激活的IL-1β 可导致继发性炎症介质(如IL-6 等)的激活。与IL-1β 类似,TNF-α 是一种多效性促炎因子,在调节多种发育和免疫过程中发挥着不同的作用,包括炎症、分化、脂质代谢和凋亡,与多种疾病相关。
综上所述,六灵解毒丸可显著改善急性咽炎大鼠的症状及咽部组织炎症病理改变,其机制可能与下调IL-1β、IL-6、TNF-α 等炎性因子表达水平有关,但是否与单核细胞分泌、NF-κB 及炎症小体活化有关,有待进一步深入研究。

