卵裂期优质胚胎与非优质胚胎来源的囊胚冻融移植后着床率比较
贾 珠,张 宁
(1.山东中医药大学第一临床医学院,山东 济南 250014;2.山东中医药大学第一附属医院生殖与遗传中心,山东 济南 250014)
近年来,辅助生殖技术(assisted reproductive technology,ART)已成为解决不孕症的重要方法,随着体外培养条件的不断成熟,囊胚移植成功率不断升高。目前,大部分生殖中心倾向于选择单囊胚移植。Peter卵裂期胚胎评分[1]及Gardner评分系统[2]为目前国内临床进行胚胎评分的首选标准,国内临床上大多依据Peter卵裂期胚胎评分选择卵裂球数目为6~10、碎片率≤20%的卵裂期胚胎进行囊胚培养,并依据Gardner评分系统选择囊胚腔扩张程度2期以上、内细胞团(inner cell mass,ICM)或滋养外胚层(trophoblastic ectoderm,TE)B级以上的囊胚行冻融囊胚移植(frozen-thawed embryo transfer,FET)。但越来越多的研究者认为形态学评分并不能完全预测胚胎的发育潜能[3];随着体外培养技术的成熟,约有50%的废弃胚胎可形成囊胚[4]。基于此,本研究比较卵裂期(受精后3 d,D3)优质胚胎和非优质胚胎来源的囊胚(受精后5 d,D5)进行FET以后的囊胚着床率,并分析2组间囊胚腔扩张程度以及ICM、TE、囊胚等级对囊胚着床率的影响,旨在探讨非卵裂优质期胚胎来源的囊胚移植价值,以便为冻融单囊胚移植周期中囊胚的来源选择提供临床参考。
1 资料与方法
1.1 一般资料
选择2018年1月1日至2022年1月1日于山东中医药大学第一附属医院生殖与遗传中心行FET的613枚D5囊胚为研究对象,共613个FET周期;根据D3囊胚是否为优质胚胎将其分为优质组(n=158)和非优质组(n=455)。囊胚纳入标准:(1)冷冻周期D5单囊胚移植,囊胚等级≥2 BB;(2)20岁≤母方取卵、移植时年龄≤50岁;(3)母方FET日子宫内膜均为A型或B型,且子宫内膜厚度(endometrial thickness,EMT)≥8 mm。排除标准:(1)供精/供卵来源胚胎;(2)胚胎植入前遗传学检测(preimplantation genetic testing,PGT)者;(3)母方子宫形态、环境异常,如纵膈子宫、单角子宫、子宫腺肌症等;(4)母方合并其他严重内外科疾病者。本研究获得山东中医药大学第一附属医院生殖医学伦理委员会审核批准,所有患者知情同意并签署“卵子冷冻、解冻及移植知情同意书”。
1.2 方法
1.2.1 促排卵治疗及取卵
母方均采用常规长方案促排卵治疗,即末次月经早卵泡期(月经周期2~4 d)依据基础血清卵泡刺激素(follicle stimulating hormone,FSH)、黄体生成素(luteinizing hormone,LH)、雌二醇(estradiol,E2)、孕酮(progesterone,P)和经阴道超声结果,给予注射用醋酸曲普瑞林(法国Ipsen Pharma Biotech公司,进口药品注册证号 H20140298)3.75 mg,皮下注射 1次,进行降调节,注射后28~40 d达到降调节标准(FSH<5 IU·L-1,LH<5 IU·L-1,E2<30 ng·L-1,经阴道超声检测卵泡直径<5 mm)后,开始皮下注射重组促卵泡素β注射液(荷兰欧加农有限公司,进口药品注册证号S20150065) 150~225 IU·d-1促排卵,用药剂量依据患者年龄、体质量指数(body mass index,BMI)、抗苗勒管激素(anti-Mullerian hormone,AMH)或既往周期使用药物情况决定,用药后密切监测血清LH、E2、P水平及卵泡直径,当有2个主导卵泡直径≥18 mm或3个优势卵泡直径≥17 mm时,结合当日血清LH、E2、P水平,当晚21:00给予注射用绒促性素(上海丽珠制药有限公司,国药准字H44020673)8 000~10 000 IU+9 g·L-1氯化钠注射液(中国大冢制药有限公司,国药准字H20043271)3 mL肌内注射进行扳机,扳机后35~36 h经阴道超声引导下穿刺取卵,术中尽可能抽吸所有卵泡以防卵巢过度刺激综合征的发生。
1.2.2 体外受精(invitrofertilization,IVF)
父方于母方取卵日上午9:00取精,当日上午11:00常规IVF,受精后20 h脱颗粒,观察原核(pronucleus,PN)和极体(polar body,PB),0PN(2PB)即0个原核、2个极体,1PN(2PB)即1个原核、2个极体,2PN(2PB)即2个原核、2个极体,早裂即未见原核而出现早期卵裂;行卵胞质内单精子注射(intracytoplasmic sperm injection,ICSI)者于上午11:00左右将优化处理后的精子(尤其是头部形态正常的直线前向运动精子)从尾部吸入注射针,将注射针垂直穿过透明带,进入卵母细胞胞质,将精子缓慢注射入卵母细胞中心区,受精16~20 h后观察第二极体排出情况;行补救卵胞质内单精子注射(rescue intracytoplasmic sperm injection,R-ICSI)者于上午11:00进行IVF,每个卵子加入约 3.0万~3.5万条精子,约5 h后脱颗粒,观察第二极体排出情况,若出现受精失败或2PN受精率不理想(2PN受精卵数/第二次减数分裂中期卵子数<30%),并于1 h后再次观察并确认2PN受精率无显著变化后,可选择未排出第二极体的卵子及时行R-ICSI以提高受精率,R-ICSI后16~20 h观察PN。受精后观察D3胚胎等级,采用Peter卵裂期胚胎评分系统对D3胚胎进行评分,定义卵裂球数目4~16、碎片率≤50%的胚胎为D3可用胚胎,其中卵裂球数目6~10、卵裂球大小均等或略不均、碎片率≤20%的可用胚胎为D3优质胚胎,不符合上述优质胚胎标准的可用胚胎为非优质胚胎;酌情选取部分优质胚胎及非优质胚胎继续培养,D5观察囊胚等级,采用Gardner评分系统对D5囊胚进行评分,将囊腔扩张程度分为1~6级,ICM分为A级、B级、C 级3个级别,TE分为A级、B级、C 级3个级别,将其中D5囊胚腔扩张程度2级以上、ICM或TE至少1项为 B级以上的囊胚定义为可移植囊胚,对符合可移植标准的囊胚使用激光进行人工皱缩,待囊胚皱缩良好后再进行玻璃化冷冻。
1.2.3 母方冷冻周期内膜准备方案
(1)自然周期方案:对于月经周期规律、可自行排卵且内膜生长同步者,自月经周期11 d左右开始经阴道超声监测排卵,卵泡直径≥14 mm时,开始每日使用促黄体生成素检测试纸,试纸强阳日测定血清LH、E2、P水平联合卵泡直径,确定排卵后(排卵日为0 d)给予黄体酮软胶囊(浙江爱生药业有限公司,国药准字 H20031099) 200 mg·d-1口服及黄体酮注射液(浙江仙琚制药股份有限公司,国药准字 H33020828)20 mg·d-1肌内注射,共5 d,转化内膜,5 d后行FET。(2)替代周期方案:从月经周期或激素药物撤退性出血2~3 d给予戊酸雌二醇片(德国拜耳医药保健有限公司,进口药品注册证号 H20120368) 4 mg·d-1口服,经阴道超声监测EMT,并逐渐增加戊酸雌二醇片用量,最大剂量用至8 mg·d-1,当EMT≥8 mm时,给予地屈孕酮片(美国雅培制药有限公司,进口药品注册证号H20130110)20 mg·d-1口服及黄体酮注射液20 mg·d-1肌内注射,共5 d,转化内膜,5 d后行FET。(3)降调节+替代周期方案:对于子宫内膜异位症、子宫腺肌症等患者,在末次月经早卵泡期给予注射用醋酸曲普瑞林皮下注射3.75 mg进行垂体降调节,28 d后测定血清LH、E2、P水平,并采用经阴道超声检测卵泡直径,达到降调节标准后开始口服戊酸雌二醇片,用药方法及移植时间同上述替代周期。(4)促排卵周期方案:排卵障碍、月经不规律但无明显痛经者,从月经或激素药物撤退性出血5 d开始口服枸橼酸氯米芬片(华润双鹤药业股份有限公司,国药准字 H11020546)100 mg·d-1或来曲唑片(浙江海正药业股份有限公司,国药准字 H20133109)5 mg·d-1,持续5 d,监测卵泡,适时给予注射用尿促性素(上海丽珠制药有限公司,国药准字H20023376)75 U·d-1肌内注射,当卵泡直径≥18 mm、EMT≥8 mm,测定血清LH>20 IU·L-1时,肌内注射8 000~10 000 IU HCG诱发排卵,经阴道超声检测排卵后给予黄体酮软胶囊200 mg·d-1口服及黄体酮注射液20 mg·d-1肌内注射,共5 d,转化内膜,5 d后行FET。
1.2.4 玻璃化冷冻后胚胎复苏
FET日上午9:00将冷冻载杆放置囊胚面平行浸入复温至37 ℃的解冻液中2 min,从解冻液移入稀释液放置3 min,随后放入清洗液1和清洗液2中各2 min,转移至培养液等待移植。
1.2.5 移植后黄体支持
FET后母方给予黄体酮软胶囊每日300 mg,睡前0.5 h口服;地屈孕酮片每日20 mg,分早晚各10 mg 口服;黄体酮注射液每日40 mg,上午10:00肌内注射;同时给予参芪寿胎丸方:黄芪15 g、炙甘草 6 g、醋香附12 g、炒白芍9 g、菟丝子15 g、槲寄生15 g、盐续断15 g、盐杜仲15 g、麸炒白术12 g、山药15 g、党参15 g、黄芩12 g,每日1剂,水煎,分早晚各1次口服,持续用药14 d;若FET后14 d血清β绒毛膜促性腺激素(beta-human chorionic gonadotropin,β-HCG)≥5 IU·L-1,则继续上述方案用药7 d后行经阴道超声检查,宫腔内有妊娠囊者视为胚胎着床;宫腔内未探及妊娠囊且宫腔外探及血流丰富的混合回声区者视为异位妊娠,也视为胚胎着床。
1.3 观察指标
(1)优质组与非优质组不同内膜准备方案的囊胚着床率;(2)优质组与非优质组囊胚腔不同扩张程度者的囊胚着床率;(3)优质组与非优质组不同级别ICM的囊胚着床率;(4)优质组与非优质组不同级别TE的囊胚着床率;(5)优质组与非优质组不同等级囊胚的着床率:综合Gardner评分系统对囊胚的囊腔扩张程度分期、ICM分级和TE分级,对D5囊胚进行分级,将纳入的613枚囊胚按囊胚等级分为≤3BB(包括2BB、2BC、2CB、3BC、3CB、3BB)组、3BB~4BB(包括3AA、3AB、3BA、4BC、4CB)组、≥4BB(包括4BB、4AB、4BA、5BC、5BB、5BA)组,观察不同等级的囊胚着床率。囊胚着床率=(孕囊数+宫腔外探及血流丰富的混合回声区例数)/移植囊胚总数×100%。
1.4 统计学处理
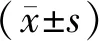
2 结果
2.1 优质组与非优质组不同内膜准备方案的囊胚着床率比较
优质组158枚囊胚中,成功着床60枚,着床率为 37.97%;其中采用自然周期方案的47枚囊胚着床成功18枚,着床率为 38.30%;采用替代周期方案的55枚囊胚着床成功 23枚,着床率为 41.82%;采用降调节+替代周期方案的30枚囊胚着床成功 11枚,着床率为 36.67%;采用促排卵周期方案的26枚囊胚着床成功 8枚,着床率为30.77%。优质组4种内膜准备方案的着床率比较差异无统计学意义(χ2=0.942,P>0.05)。
非优质组455枚囊胚中,成功着床152枚,着床率为33.41%;其中采用自然周期方案的129枚囊胚着床成功 40枚,着床率为 31.01%;采用替代周期方案的111枚囊胚着床成功 36枚,着床率为 32.43%;采用降调节+替代周期方案的30枚囊胚着床成功 7枚,着床率为 23.30%;采用促排卵周期方案的185枚囊胚着床成功 69枚,着床率为37.30%。非优质组4种内膜准备方案的着床率比较差异无统计学意义(χ2=3.008,P>0.05)。
优质组与非优质组的囊胚着床率比较差异无统计学意义(χ2=1.082,P>0.05)。优质组与非优质组自然周期方案、替代周期方案、降调节+替代周期方案、促排卵周期方案的囊胚着床率比较差异均无统计学意义(χ2=0.829、1.414、1.270、0.419,P>0.05)。
2.2 优质组与非优质组囊胚腔不同扩张程度者囊胚着床率比较
优质组158枚囊胚中,囊胚腔扩张程度2级16枚,3级71枚,4级69枚,5级2枚。优质组中囊胚腔扩张程度2级胚囊着床率为6.25%(1/16),3级胚囊着床率为35.40%(25/71),4级胚囊着床率为46.38%(32/69),5级胚囊着床率为0.00%(0/2);优质组中不同囊胚腔扩张程度的囊胚着床率比较差异有统计学意义(χ2=10.393,P<0.05);其中囊胚腔扩张程度3、4级的囊胚着床率高于2级,差异有统计学意义(χ2=5.227、8.805,P<0.05);囊胚腔扩张程度3级与4级的囊胚着床率比较差异无统计学意义(χ2=1.807,P>0.05)。
非优质组455枚囊胚中,囊胚腔扩张程度2级47枚,3级206枚,4级191枚,5级11枚。非优质组中囊胚腔扩张程度2级囊胚着床率为40.43%(19/47),3级囊胚着床率为31.07%(64/206),4级囊胚着床率为34.03%(65/191),5级囊胚着床率为 36.36%(4/11);非优质组中不同囊胚腔扩张程度的囊胚着床率比较差异无统计学意义(χ2=1.624,P>0.05)。
非优质组中囊胚腔扩张2级的囊胚着床率显著高于优质组,差异有统计学意义(χ2=6.434,P<0.05);优质组与非优质组中囊胚腔扩张3、4、5级的囊胚着床率比较差异均无统计学意义(χ2=0.416、3.303、1.051,P>0.05)。
2.3 优质组与非优质组中不同级别ICM的囊胚着床率比较
优质组中ICM A级的6枚囊胚着床成功1枚,着床率为16.67%;ICM B级的138枚囊胚着床成功56枚,着床率为40.58%;ICM C级的14枚囊胚着床成功3枚,着床率为21.43%。优质组中不同级别ICM的囊胚着床率比较差异无统计学意义(χ2=3.181,P>0.05)。
非优质组中ICM A级的7枚囊胚着床成功2枚,着床率为28.57%;ICM B级的405枚囊胚着床成功138枚,着床率为34.07%;ICM C级的43枚囊胚着床成功12枚,着床率为27.90%。非优质组中不同级别ICM的囊胚着床率比较差异无统计学意义(χ2=0.739,P>0.05)。
优质组与非优质组中ICM A、B、C级的囊胚着床率比较差异均无统计学意义(χ2=0.258、1.897、0.229,P>0.05)。
2.4 优质组与非优质组中不同级别TE的囊胚着床率比较
优质组中TE A级的16枚囊胚着床成功6枚,着床率为37.50%;TE B级的113枚囊胚着床成功41枚,着床率为36.28%;TE C级的29枚囊胚着床成功13枚,着床率为 44.83%。优质组中不同TE等级的囊胚着床率比较差异无统计学意义(χ2=0.713,P>0.05)。
非优质组中TE A级的15枚囊胚着床成功11枚,着床率为73.33%;TE B级的307枚囊胚着床成功111枚,着床率为36.16%;TE C级的133枚囊胚着床成功30枚,着床率为22.56%。非优质组中不同TE等级的囊胚着床率比较差异有统计学意义(χ2=18.83,P<0.05);其中A级的囊胚着床率明显高于B级和C级,差异有统计学意义(χ2=8.399、17.353,P<0.05),B级的囊胚着床率明显高于C级,差异有统计学意义(χ2=7.882,P<0.05)。
非优质组中TE A级的囊胚着床率显著高于优质组,差异有统计学意义(χ2=4.014,P<0.05);非优质组中TE C级的囊胚着床率显著低于优质组,差异有统计学意义(χ2=6.057,P<0.05);2组中TE B级的囊胚着床率比较差异无统计学意义(χ2=0.001,P>0.05)。
2.5 优质组与非优质组中不同等级囊胚的着床率比较
优质组中囊胚等级≤3BB的76枚囊胚着床成功14枚,着床率为18.42%;3BB~4BB的29枚囊胚着床成功14枚,着床率为48.28%;≥4BB的53枚囊胚着床成功32枚,着床率为60.38%。优质组中不同等级囊胚的着床率比较差异有统计学意义(χ2=24.936,P<0.05);其中3BB~4BB、≥4BB的囊胚着床率高于≤3BB,差异有统计学意义(χ2=9.567、23.957,P<0.05);≥4BB的囊胚着床率与3BB~4BB比较差异无统计学意义(χ2=1.115,P>0.05)。
非优质组中囊胚等级≤3BB的230枚囊胚着床成功53枚,着床率为23.04%;3BB~4BB的97枚囊胚着床成功29枚,着床率为29.90%;≥4BB的128枚囊胚着床成功70枚,着床率为54.69%。非优质组中不同等级囊胚的着床率比较差异有统计学意义(χ2=37.697,P<0.05);其中≥4BB的囊胚着床率显著高于3BB~4BB、≤3BB,差异有统计学意义(χ2=13.764、33.149,P<0.05),3BB~4BB与≤3BB的囊胚着床率比较差异无统计学意义(χ2=1.706,P>0.05)。
优质组与非优质组中囊胚等级≤3BB、3BB~4BB、≥4BB的着床率比较差异均无统计学意义(χ2=0.714、3.355、0.493,P>0.05)。
3 讨论
ART中一味选择低质量的卵裂期胚胎直接进行胚胎冷冻,可能会增加患者的就诊费用,且不能获得理想的妊娠结局[5]。但如果仅根据卵裂期胚胎形态学评分丢弃“低质量”的胚胎,则可能面临无胚胎可用的局面[6]。近10 a来,随着体外培养系统及胚胎冷冻技术的不断完善,囊胚培养已成为一种趋势[7],囊胚培养通过延长体外培养的时间从而达到筛选胚胎的目的,这一过程可选择更具有发展潜能的卵裂期胚胎,相对于卵裂期胚胎移植,囊胚移植可大大提高临床妊娠率[8];临床研究数据表明,选择卵裂期非优质胚胎进行囊胚培养也可提高胚胎利用率[9]。但目前尚无文献报道源于非优质卵裂期胚胎的囊胚移植策略选择。基于此,本研究依据D5囊胚的来源进行分组,探讨卵裂期非优质胚胎形成囊胚后的移植策略。
本研究纳入源自卵裂期优质胚胎的D5囊胚158枚,经阴道超声下可见妊娠囊60个,着床率为 37.97%;源自卵裂期非优质胚胎的D5囊胚455枚,经阴道超声下可见妊娠囊152个,着床率为33.41%;源自卵裂期非优质胚胎的囊胚着床率虽低于源自卵裂期优质胚胎的囊胚着床率,但差异无统计学意义,这提示卵裂期非优质胚胎经继续培养成功至可移植囊胚阶段,也能获得较为理想的着床率,与彭姝明等[10]的研究结果一致。本研究中,2组的组内比较结果显示,4种内膜准备方案对卵裂期优质胚胎来源和非优质胚胎来源的囊胚着床率的影响差异均无统计学意义;且组间比较显示,采用同一种内膜准备方案的卵裂期优质胚胎来源的囊胚和非优质胚胎来源的囊胚的着床率比较差异也无统计学意义;本研究结果与焦雨帆等[11]的研究结果一致,这可能与本研究纳入FET日母体子宫内膜厚度均≥8 mm有关;而朱素芹等[12]研究发现,子宫内膜厚度<8 mm时会显著降低临床妊娠率。
胚胎种植的过程是一个极其复杂的过程,胚胎因素、子宫因素、凝血异常以及免疫因素等均可影响胚胎种植潜能、子宫内膜容受性及二者发育的同步性,导致种植失败,其中胚胎质量是最重要的因素[13]。本研究结果显示,优质组中不同囊胚腔扩张程度的着床率比较差异有统计学意义,扩张程度增加,着床率相应提高,这与已有相关研究结论相符[14-15];而非优质组中不同囊胚腔扩张程度的着床率比较差异无统计学意义,这可能是因为非优质卵裂期胚胎继续培养的过程本就是筛选淘汰的过程,与XIA等[16]的研究相符。另外,本研究结果显示,非优质组囊胚腔扩张2级的着床率显著高于优质组,2组之间囊胚腔扩张3、4、5级的着床率比较差异均无统计学意义,但本研究中囊胚腔扩张程度2级、5级的样本量较少,其结果可能并不能代表真实的临床意义。
胚胎发育成桑椹胚后进一步发育,细胞开始出现分化,聚集在胚胎的一端,个体较大的细胞为ICM,ICM的细胞是一种未分化的细胞,具有全能性,将发育成胎儿的各种组织,而沿透明带内壁扩展和排列的个体较小的细胞为滋养层细胞,将发育成胎膜和胎盘[17]。SIVANATHAM等[18]研究表明,在冻融单囊胚移植周期中,ICM等级低是临床妊娠率低的危险因素。本研究结果显示,不同级别ICM的卵裂期优质胚胎来源的囊胚着床率比较差异无统计学意义,不同级别ICM的非优质胚胎来源的囊胚着床率比较差异亦无统计学意义,且优质组与非优质组中ICM A、B、C级的囊胚着床率比较差异均无统计学意义,这与SIVANATHAM等[18]的研究结果不同,可能与本研究中ICM为A级的囊胚数目少有关。本研究中,优质组中不同TE 等级的囊胚着床率比较差异无统计学意义;非优质组中不同TE等级的囊胚着床率比较差异有统计学意义,随着TE等级降低,非优质组囊胚着床率也下降,与相关研究结果一致[19]。近年来也有研究表示,ICM比TE更能预测胚胎植入率,ICM具有更强大的预测价值[20]。
将卵裂期胚胎培养至囊胚在一定程度上可以增加其着床率,但选用何种囊胚是目前尚存争议的问题。并非所有的生殖中心都具有行胚胎植入前PGT的资质,在不采用PGT的情况下,仅通过外观形态评判胚胎等级有一定的局限性。Gardner评分系统不一定是最佳的囊胚评分系统,但该评分系统在静态下具有较高的预测能力。本研究综合D5囊胚等级来看,无论是源自卵裂期优质胚胎或非优质胚胎的囊胚,等级≥4BB的着床率均为最高,与路锦等[21]的研究结果相符,提示应优先选用此类囊胚行FET。本研究结果提示,针对发育成囊胚的卵裂期非优质胚胎,应优先选用等级≥4BB的囊胚进行移植。
4 结论
IVF/R-ICSI/ICSI后所余卵裂期优质胚胎或非优质胚胎均可继续培养至囊胚阶段,在这一过程中,低质量胚胎或发育潜能差的胚胎被淘汰,选择卵裂期非优质胚胎形成的≥4BB级囊胚行FET,可大大提高着床率。但本研究ICM、TE A级的囊胚数量较少,且仅统计着床率这一指标,而没有统计母方周期妊娠率、临床妊娠率、早期流产率、抱婴率等指标,未来将进一步收集更多统计ICM及TE A级的囊胚数据,并将其他妊娠结局纳入研究。

