促代谢因子、白介素1β及血管内皮生长因子与糖尿病视网膜病变的相关性研究*
焦晨旭,蔺晓慧
(1.内蒙古科技大学包头医学院2020级研究生,内蒙古 包头 014040;2.内蒙古自治区人民医院)
糖尿病视网膜病变(diabetic retinopathy,DR)是危害糖尿病患者视力的主要原因,约50 %的糖尿病患者合并视网膜病变[1]。据预测,到2045年我国糖尿病人群将达到1.74亿人,而患有糖尿病视网膜病变患者人群将是目前的2倍[2]。DR的早期非增殖期主要表现为视网膜出血、微动脉瘤、视网膜内微血管异常和棉绒斑,只有轻微的视力改变。增殖期主要是由于新生血管的发展,引起玻璃体出血和新生血管以及增殖膜牵引导致视网膜脱离。与非增殖期相比,处于增殖期的患者视力明显下降,失明的风险更高。
Betatrophin作为一种新发现的内分泌蛋白质,主要在人类肝脏及脂肪组织中表达,其基因位点与低密度脂蛋白受体位置相邻,同时与高密度脂蛋白具有相关性。该因子蛋白结构与血管生成素样蛋白家族具有相同的N端结构,与血管生成及炎症反应相关。体外研究发现,高血糖诱导下,Müller细胞刺激血管内皮生长因子(Vascular endothelial growth factor,VEGF)、白细胞介素-1β(Interleukin 1β,IL-1β)等细胞因子产生[3]。本研究主要探讨在糖尿病患者血清中Betatrophin、IL-1β及VEGF水平变化以及三种因子的相关性,并且探讨3种因子对于DR的预测作用,以期为DR寻找更敏感的诊断指标。
1 对象与方法
1.1对象 选取2021年3月至2022年6月在内蒙古自治区人民医院住院的T2DM患者114例(DM组)纳入研究,同时选取无糖尿病史住院患者37例作为对照组(NC组)。DM诊断依据2022年版《中国老年2型糖尿病防治临床指南》进行诊断,本研究通过内蒙古自治区人民医院伦理委员会审查。
1.2分组 所有患者均行散瞳后眼底检查,按照检查结果结合2021年中华医学会糖尿病学分会视网膜病变学组发表的《糖尿病相关眼病防治多学科中国专家共识》将DM组患者分为未合并视网膜病变组(NDR,n=32)、非增生型DR组(NPDR,n=49)、增殖期DR组(PDR,n=33)。排除标准:1型糖尿病;全身合并炎症、恶性肿瘤及风湿性疾病;合并眼科其他病史;急性心脑血管疾病,脑卒中,冠心病;糖尿病急性并发症;对照组患者无糖尿病病史。
1.3方法 收集患者一般信息,年龄、性别、测量身高及体重,计算BMI,休息30 min后测量患者血压,询问患者糖尿病病史、用药情况;所有受试人员在抽血前了解本次实验目的,同意抽血进行相关检测,并签署知情同意书,清晨空腹10 h以上抽取肘静脉血,测定静脉空腹血糖(FPG)、糖化血红蛋白(HbA1c)、低密度脂蛋白(LDL-C)、高密度脂蛋白(HDL-C)、总胆固醇(TC)以及三酰甘油(TG)、超敏C反应蛋白、Betatrophin、IL-1β、VEGF水平,核医学检验室进行空腹C肽及空腹胰岛素水平检测。胰岛素抵抗指数(homeostatic model assessment of insulin resistance,HOMA-IR)=[FPG×空腹胰岛素(fasting insulin,FINS)浓度]/22.5。
2 结果
2.12型糖尿病各组与正常对照组指标比较 与NC组相比,NDR组FPG、TG、HbA1c、HOMA-IR水平明显升高,HDL-C水平降低(P<0.05),NPDR组FPG、HbA1c、TG、HOMA-IR水平明显升高(P<0.05),胱抑素C、C肽水平明显降低(P<0.05),PDR组FPG、HbA1c、HOMA-IR水平明显升高(P<0.05),C肽水平明显降低(P<0.05)。见表1。

表1 研究对象的基本情况比较
2.22型糖尿病视网膜病变患者各组血清学指标比较 与NDR组相比,NPDR组病程明显增加(P<0.05),C肽水平明显降低(P<0.05),PDR组病程、FPG、HDL-C、HOMA-IR、胱抑素C明显升高(P<0.05),TG、C肽水平明显降低(P<0.05);与NPDR组相比,PDR组病程、FPG、胱抑素C水平明显升高(P<0.05)。见表1。
2.3各组间血清Betatrophin、IL-1β、VEGF比较 与NC组相比,NDR、NPDR组及PDR组Betatrophin、IL-1β及VEGF水平均明显升高(P<0.05);与NDR组相比,NPDR组Betatrophin及VEGF水平明显升高(P<0.05);与NPDR组相比,PDR组Betatrophin、IL-1β、VEGF水平明显升高(P<0.05)。见表2。
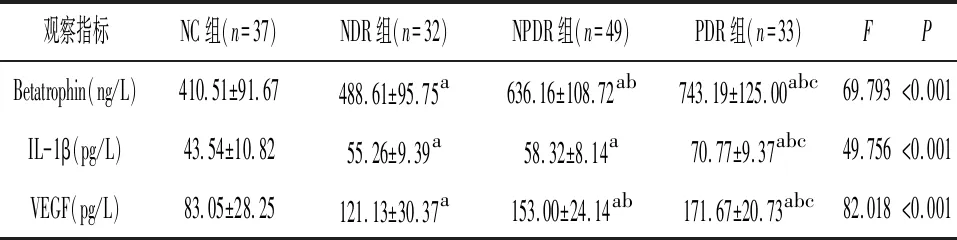
表2 Betatrophin、IL-1β及VEGF的比较
2.4血清Betatrophin、IL-1β、VEGF水平与一般临床资料相关性分析 应用Pearson及spearman相关分析对血清Betatrophin、IL-1β及VEGF水平与各生化指标相关性进行分析,结果显示,在2型糖尿病患者中,Betatrophin水平与胱抑素C、IL-1β、VEGF呈正相关(P<0.05),与C肽水平呈负相关(P<0.05);血清IL-1β水平与VEGF、FPG、HDL-C、HOMA-IR呈正相关(P<0.05),与C肽呈负相关(P<0.05);VEGF水平与收缩压、胱抑素C、FPG、HOMA-IR水平呈正相关(P<0.05)。见表3。

表3 Betatrophin、IL-1β及VEGF与临床指标的相关性分析
2.5临床指标与糖尿病视网膜病变的多元回归分析 以是否患有DR为因变量,将单因素分析中P<0.10的临床指标(C肽、HDL-C、HOMA-IR)纳入,进行多因素逐步Logistic回归分析,结果发现,血清C肽水平越低,发生DR风险越大,差异具有统计学意义(OR=0.56,95 %CI0.31-0.98,P=0.044)、DR组HDL-C高于NDR组,差异具有统计学意义(OR=4.56,95 %CI1.10-18.96,P=0.037);DR组HOMA-IR较NDR组升高,差异具有统计学意义(OR=2.43,95 %CI1.33-4.43,P=0.004),C肽、HDL-C、HOMA-IR与糖尿病视网膜病变发生发展有关。
2.6Betatrophin、IL-1β及VEGF与视网膜病变关系的Logistic回归分析 纳入Betatrophin、IL-1β及VEGF因素后以是否患有DR为因变量,行Logisitic回归分析,在校正性别、年龄后,以是否患有DR为因变量,行Logisitic回归分析,结果显示,Betatrophin水平越高,发生DR风险越大(P<0.001);IL-1β水平越高,发生DR风险越高(P=0.001);VEGF水平越高,发生DR风险越高(P<0.001)。进一步校正C肽、HDL-C、HOMA-IR后行Logistic回归分析,结果显示,Betatrophin水平越高,发生DR风险越大(P<0.001);IL-1β水平越高,发生DR风险越高(P=0.020);VEGF水平越高,发生DR风险越高(P<0.001)。见表4。

表4 Betatrophin、IL-1β及VEGF与视网膜病变关系的Logistic回归分析
2.7Betatrophin、IL-1β、VEGF关于糖尿病视网膜病变的ROC分析 Betatrophin诊断DR的曲线下面积(AUC)0.89,当约登指数最大0.74时,其敏感性和特异性分别为82.93 %和90.63 %;IL-1β诊断DR的曲线下面积(AUC)0.71,当约登指数0.32时,其敏感性和特异性分别为75.61 %和56.25 %;VEGF诊断DR的曲线下面积(AUC)0.84,当约登指数0.59时,其敏感性和特异性分别为84.15 %和75.00 %。Betatrophin对于DR的诊断效能最大,其截点值为554.97 ng/L。见表5、图1。

图1 Betatrophin、IL-1β及VEGF预测糖尿病视网膜病变的ROC曲线

表5 Betatrophin、IL-1β及VEGF对预测DR的诊断情况
2.8Betatrophin、IL-1β及VEGF对于增殖期糖尿病视网膜病变的ROC分析 Betatrophin诊断PDR的曲线下面积(AUC)0.76,当约登指数最大 0.44时,其敏感性和特异性分别为60.61 %和83.67 %;IL-1β诊断DR的曲线下面积(AUC)0.83,当约登指数0.60时,其敏感性和特异性分别为72.73 %和87.76 %;VEGF诊断DR的曲线下面积(AUC)0.72,当约登指数0.39时,其敏感性和特异性分别为87.88 %和 51.02 %。IL-1β对于PDR的诊断效能最大,截点值为68.07 pg/L。见表6、图2。

图2 Betatrophin、IL-1β及VEGF预测增殖期糖尿病视网膜病变的ROC曲线

表6 Betatrophin、IL-1β及VEGF对预测视网膜病变严重程度的预测价值
3 讨论
糖尿病视网膜病变是由于循环中长期高血糖导致的视网膜及血管内皮损伤,产生活性氧(ROS)和低水平的炎症,糖基化产物(AGEs)在血管内皮堆积,改变血管结构,增加血管硬度,并启动细胞内信号通路,进一步加剧氧化应激和炎症反应,最终导致新生血管生成。炎症在DR发生及发展过程中起重要的作用。在高血糖刺激下,视网膜细胞以及血管内皮细胞产生具有促进炎症反应的炎症因子,如IL-1β,通过有氧糖酵解和增加己糖激酶活性的途径激活白细胞,产生糖尿病视网膜病变的炎症反应,同时被激活的白细胞产生视网膜毛细血管无灌注区,同时也诱导血管通透性增加,刺激产生VEGF并且诱导新生血管生成。活化的小胶质细胞和Müller细胞在促炎白细胞作用下诱导VEGF产生增加[4]。
Betatrophin是2013年被发现的具有分泌功能的蛋白质,它与血管生成素样蛋白家族(ANGPTLs)具有相同的蛋白结构,因此又命名为ANGPTL8,血管生成素样家族与血管生成素具有相同的N-端及C-端。已有研究表明ANGPTL1,2,3和6促进血管生成,与结构中具有促进血管生成的C-端有关[5]。而Betatrophin缺乏与血管生成相关的C-端,有研究表明,Betatrophin通过促进ANGPTL3裂解[6],参与新生血管生成。研究发现,血管紧张素3、4和血管紧张素6不仅参与血管生成,而且还参与调节脂质、葡萄糖和能量代谢[7]。胱抑素C在血管损伤过程中起保护作用。有研究报道,DR患者体内胱抑素C升高是DR的危险因素,可能参与糖尿病视网膜病变的发生,与Betatropin呈正相关[8]。本研究发现,DR患者血清中胱抑素C和Betatrophin较对照组升高,且两种因子呈正相关,均为DR的危险因素。Lu等[9]研究表明,PDR患者血清和玻璃体中Betatropin与VEGF水平均升高,相关性分析显示,两种因子呈正相关,是DR的危险因素。因此Betatrophin在眼内表达,同时表明Betatrophin通过参与糖尿病视网膜病变新生血管生成,参与了DR的产生、发展。本研究表明,Betatrophin与VEGF在DR患者血清中水平升高,且两种因子呈正相关性,与之前研究结果一致,表明Betatrophin与炎症反应有关。新诊断的DM患者在调整年龄和BMI后,血清ANGPTL8与FPG、空腹C肽具有正相关关系,血清ANGPTL8可能在葡萄糖耐量受损的病理机制中起作用[10]。本研究未发现在DR患者血清中Betatrophin与血糖、血脂的相关性,可能与样本量小以及研究对象使用降糖以及降脂药物有关。本研究表明,Betatrophin与C肽水平具有负相关关系,与既往研究结果不同,需要扩大样本量再次进行研究。由于DR与糖脂代谢有关,同时Betatrophin可能与糖脂代谢有关,在矫正年龄、性别以及与DR相关性的HDL-C、空腹C肽、HOMA-IR后发现,Betatrophin与DR具有正相关性,表明Betatrophin参与了DR发生发展,是DR的危险因素。
IL-1β是一种促炎症细胞因子,由视网膜Müller细胞产生,诱导视网膜内屏障变化,使白细胞聚集、血管壁通透性增加,内皮细胞形态功能改变[3]。Cvitkovic等[11]研究发现,DR患者眼内液中IL-1β和VEGF水平升高,表明IL-1β和VEGF参与DR病理改变。Zhang等[12]认为ANGPTL8可能通过其N-端激活NF-kB,参与炎症反应,同时,在IL-1β刺激下,促进ANGPLT8转录及表达,从而激活NF-kB通路,这表明ANGPTL8与IL-1β具有相互作用。本研究表明,在糖尿病患者血清中,Betatrophin与IL-1β水平呈正相关,因此Betatrophin不仅有分泌蛋白质的功能,同时也刺激炎症因子的产生,参与炎症反应。
本研究表明,与对照组相比,DR组患者IL-1β浓度明显升高,慢性炎症反应参与了DR的发病机制。同时血清IL-1β与VEGF呈正相关,表明DR与炎症及新生血管反应具有相关性。在矫正影响DR的HDL-C、C肽及HOMA-IR后,行DR的Logistic回归分析发现,Betatrophin、IL-1β及VEGF是DR的独立危险因素。本研究通过绘制ROC曲线及计算曲线下面积,发现Betatrophin对于DR具有预测作用,特异性高于VEGF,灵敏度略低于VEGF,Betatrophin对于DR的预测价值高于IL-1β及VEGF,同时进一步探究3种因子对于PDR的预测,IL-1β对于PDR具有一定的预测价值。
综上所述,Betatrophin、IL-1β及VEGF均为DR的危险因素。Betatrophin参与血管生成作用,也参与血管炎症反应,调节促进糖尿病视网膜病变的炎症反应。DR患者血清中Betatrophin水平升高,且与VEGF具有正相关性,因此,Betatrophin参与DR发生发展。另外,Betatrophin对于DR预测高于VEGF,Betatrophin可能作为一个新的DR诊断因子以及新的治疗靶点。但由于本实验为小样本试验,且未对照降脂药物是否对于Betatrophin水平有影响作用,需要进一步基因及细胞试验进行验证。

