胰岛素低血糖-生长激素激发试验中采用不同胰岛素计算方法在矮身材儿童中的临床效果对比
郑鑫,郝莉,豆丽园,郭丰
郑州大学第一附属医院内分泌及代谢病科,郑州 450000
矮身材是指在相似的生活环境下,儿童身高显著低于同龄、同性别、同种族以及同地区的正常健康儿童平均身高的2个标准差,或生长曲线低于第3个百分位数[1]。生长激素(growth hormone,GH)缺乏是导致矮身材的重要因素之一,而胰岛素低血糖-生长激素激发试验(insulin tolerance test,ITT)是诊断GH缺乏的重要确认试验[2]。《成人生长激素缺乏症诊治专家共识》(2020版)[3]推荐ITT的胰岛素用量为0.1~0.15U/kg。由于超重或肥胖患者存在胰岛素抵抗,易造成血糖下降幅度不足,往往会使用更高剂量的胰岛素,甚至需要多次追加胰岛素用量才能激发成功,这会增加严重低血糖、癫痫等的发生风险[4]。因此,如何选择胰岛素的适宜剂量,使得在单次注射激发成功的同时确保患儿的安全是临床研究的重点内容。基于此,本研究对2019年6月~2023年3月期间某院内分泌及代谢病科收治的107例矮身材患儿使用不同剂量的胰岛素行ITT的结果进行回顾总结,就不同胰岛素算法所致的试验差异及安全性进行分析和探讨,现报道如下。
1 资料与方法
1.1 一般资料
选取2019年6月~2023年3月期间于某院内分泌及代谢病科因矮身材就诊,并需要行ITT的107例患儿作为研究对象,按照胰岛素计算方法分为传统ITT组(n=30)和优化ITT组(n=77)。本研究已经过医院伦理委员会审查通过(伦理批号2022-KY-1117-001)。
纳入标准:①年龄≤18岁者。②符合《儿童特发性矮身材诊断与治疗中国专家共识》[1]中诊断标准者。
排除标准:①合并甲状腺功能减退者。②合并肾上腺功能减退者。③严重肝肾功能损害者。④严重贫血及营养不良者。⑤患有严重心脑血管疾病或癫痫者。
对患儿及父母人口学资料和试验相关资料进行调查与分析。其中患儿及父母人口学资料包括:患儿性别、年龄、出生时身高体重、目前身高体重、出生及喂养方式、父母身高、母亲孕期用药史和流产史等;试验相关资料包括:试验所用胰岛素计算方式、各个时间点的血糖值、试验是否激发成功、GH峰值及发生时间、试验期间不良反应的发生情况、住院天数等。
1.2 研究方法
1.2.1 ITT所用胰岛素剂量的计算方法
(1)传统算法:《成人生长激素缺乏症诊治专家共识》(2020版)[3]推荐ITT胰岛素剂量为0.1~0.15U/kg。由于超重或肥胖患儿存在胰岛素抵抗,易激发失败,往往会视情况使用更高剂量的胰岛素来诱导适度的低血糖[5]。若用药后45min内未激发低血糖,则需追加胰岛素(0.3U/kg)再次激发,并重新记录激发时间。
(2)优化算法[6]:上海交通大学医学院附属瑞金医院内分泌代谢病团队根据口服糖耐量试验的血糖及血清胰岛素水平,计算稳态模型评估的胰岛素抵抗指数、胰岛素敏感指数、葡萄糖曲线下面积、胰岛素释放曲线下面积,发现胰岛素释放曲线下面积和BMI是ITT中胰岛素剂量的独立影响因素,进而提出ITT优化剂量系数,得出优化后的个体化胰岛素激发剂量;若用药后45min内未激发低血糖,则需追加首次胰岛素注射剂量的2倍,并重新记录激发时间。
优化ITT胰岛素注射剂量算法:胰岛素用量(U)=体重×{- 0.034+0.000176×[0.5×(空腹胰岛素+180min胰岛素)+60min胰岛素+120min胰岛素]+0.009846×BMI}。
1.2.2 ITT
根据胰岛素剂量的计算方法,将患儿分为传统ITT组(n=30)和优化ITT组(n=77)。优化ITT组需在ITT前进行口服葡萄糖耐量试验,获取患儿胰岛素释放水平等数据。两组患儿行ITT前1天,由护士对患儿及家属进行ITT相关的宣教,家属签署知情同意书。受试患儿禁食8~14h,禁水6h,在清晨空腹、保持清醒和安静的状态下平卧于病床上,采用PM-7000心电监护仪(深圳迈瑞生物医疗电子股份有限公司)监测生命体征,遵医嘱将对应量的胰岛素注射液(江苏万邦生化医药集团有限责任公司,国药准字H10890001,规格:10ml∶400单位)加至2ml氯化钠注射液(扬州中宝药业股份有限公司,国药准字 H32024047,规格:10ml∶90mg)中一次性静脉注射。于注射前及注射后15、30、60、90min和120min各采集患儿静脉血约3ml用于检测GH;采血的同时检测指尖血糖水平,指尖血糖下降至≤2.6mmol/L且低于基础值的50%定义为试验激发成功[7]。试验时间从采血开始,试验期间保持禁食,并密切监测患儿的神志情况及生命体征变化。
1.3 观察指标
1.3.1 GH检测
分别于注射前及注射后15、30、60、90min和120min采集患儿静脉血约3ml,采用012116R0320台式高速冷冻离心机(力康生物医疗科技控股有限公司,r=12cm),以3000r/min于20℃~25℃离心3min,取上清。使用IMMULITE1000 全自动化学发光免疫分析仪[西门子(中国)有限公司]检测血清GH。血清GH判定标准[8]:GH峰值≥10ng/ml表示GH不缺乏,ITT阴性;5ng/ml≤GH峰值<10ng/ml表示GH部分缺乏,GH峰值<5ng/ml表示GH完全缺乏,后两者为ITT阳性。通过检测血清GH比较两组患儿的GH峰值、达峰时间、单次注射胰岛素成功率及试验阳性率。
1.3.2 不良反应发生情况
在ITT期间,患儿若出现心悸、冒冷汗、头晕、肌肉抽搐、震颤、精神症状、行为改变、昏迷等任一种症状即判定为不良反应[9]。观察并记录两组患儿ITT期间不良反应的发生情况。
1.3.3 住院天数
记录两组患儿ITT期间的住院天数。
1.4 统计学方法
应用SPSS 24.0软件对数据进行分析。采用单样本K-S法进行正态分布检验,符合正态分布且方差齐的计量资料以±s表示,组间比较采用独立样本t检验;非正态分布的计量资料以M(P25,P75)表示,组间比较采用Mann-WhitneyU检验;计数资料以n(%)表示,组间比较采用χ2检验;检验水准α= 0.05。P<0.05为具有统计学差异。
2 结果
2.1 基线资料
男性79例(73.8%),女性28例(26.2%);年龄4~17岁,平均年龄(11.28±2.77)岁;平均骨龄为(10.21±3.47)岁;身高98~168cm,平均身高(138.02±14.90)cm;父亲平均身高(169.2±5.61)cm,母亲平均身高(157.84±6.50)cm。98例(96.3%)患儿无窒息、缺氧不良史,81例(79.4%)患儿为母乳喂养。两组性别、年龄、骨龄、身高、体重指数(body mass index,BMI)、基线血糖值水平等比较均无统计学差异(P>0.05),具有可比性(表1)。
表1 两组基线资料及ITT情况比较 ±s,n(%),M(P25,P75)
ITT:胰岛素低血糖-生长激素激发试验;BMI:体重指数;GH:生长激素
项目传统ITT组(n=30)优化ITT组(n=77)χ2/t/Z值P值性别1.9480.163男性25(83.3)54(70.1)女性5(16.7)23(29.9)年龄(岁) 11.13±2.8711.34±2.740.3420.733骨龄(岁) 9.65±3.8810.46±3.290.9300.356身高(cm)139.77±15.30137.34±14.79-0.7550.452 BMI(kg/m2)19.79±3.8820.45±4.411.8060.074发现患儿生长缓慢时长(年) 4.12±3.764.38±3.390.3500.722基线血糖值(mmol/L)5.13±0.475.05±0.490.7590.450 GH峰值(ng/ml)5.04(3.03,8.98)6.38(4.40,8.82)-1.3290.184 60min内GH达峰0.0200.889是23(76.7)60(77.9)否7(23.3)17(22.1)发生不良反应是8(26.7)8(10.4)4.4980.034否22(73.3)69(89.6)所用胰岛素剂量(U)9.48±4.417.46±4.492.0970.038住院时长(天) 4.23±1.785.43±2.00-2.8250.006
2.2 单次注射激发成功率和试验阳性率
本研究共30例患儿采用传统ITT算法,6例患儿给予0.1~0.15U/kg胰岛素,10例患儿给予0.15~0.2U/kg胰岛素,14例患儿给予0.2~0.3U/kg胰岛素。首次注射胰岛素激发成功者28例(93.3%),需追加胰岛素者2例(6.7%)。其中1例追加1次,最终使用胰岛素剂量为0.6U/kg;另外1例追加2次,最终使用胰岛素剂量为1.05U/kg。这2例患儿的BMI分别为26.0kg/m2和30.4kg/m2。本研究共77例患儿采用优化ITT算法,首次注射激发成功者74例(96.1%),需追加胰岛素者3例(3.9%)。这3例患儿均追加1次,BMI分别为24.8kg/m2、26.3g/m2和28.2kg/m2。两组单次注射激发成功率和试验阳性率比较均无统计学差异(P>0.05)(表2)。
表2 两组单次注射激发成功率和试验阳性率比较 ±s,n(%)

表2 两组单次注射激发成功率和试验阳性率比较 ±s,n(%)
项目传统ITT组(n=30)优化ITT组(n=77)χ2/t/Z值P值单次注射激发成功0.0100.920是28(93.3)74(96.1)否2(6.7)3(3.9)试验结果是否阳性0.5760.448是25(83.3)59(76.6)否5(16.7)18(23.4)
2.3 GH峰值、达峰时间
传统ITT组的GH峰值为5.04(3.03,8.98)ng/ml,优化ITT组的GH峰值为6.38(4.40,8.82)ng/ml,两组比较无统计学差异(P>0.05)。两组各个时间点的达峰占比详见表3,以60min为时间观察点,两组60min达峰率分别为76.7%和77.9%,无统计学差异(P>0.05)。
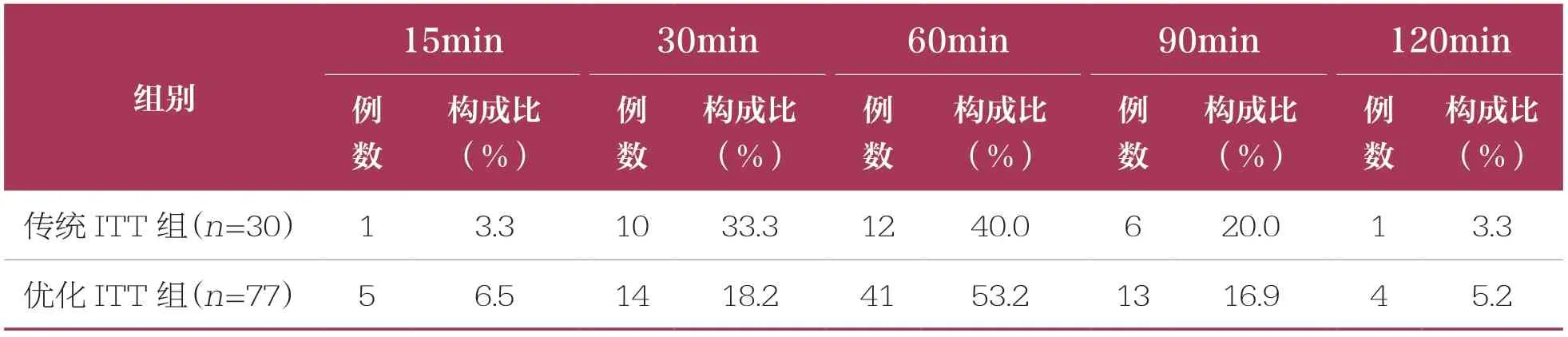
表3 两组达峰时间比较
2.4 ITT所用胰岛素剂量及不良反应发生情况
传统ITT组所用胰岛素剂量[(9.48±4.41)U/kg]高于优化ITT组所用胰岛素剂量[(7.46±4.49)U/kg,P<0.05]。传统ITT组有7例患儿出现心悸、出冷汗、头晕等不良反应,1例患儿出现思维或语言迟钝等神志改变,经休息、进食或静推葡萄糖后其症状消失,不良反应发生率达26.7%。优化ITT组有8例患儿出现心悸、出冷汗、头晕等不良反应,未发生思维或语言迟钝等神志改变,经休息或进食后其症状消失,不良反应发生率为10.4%。两组不良反应发生率比较具有统计学差异(P<0.05)。
2.5 住院天数
优化ITT组患儿住院天数[(5.43±2.00)天]长于传统ITT组[(4.23±1.78)天,P<0.05]。
3 讨论
GH缺乏是引起儿童生长迟缓、身材矮小的常见病因之一。GH的自然分泌呈脉冲式,具有明显的个体差异性,不仅与下丘脑、垂体、神经递质及大脑结构和功能的完整性有关,还会受到睡眠、运动和应激等影响,故单次测定血清GH水平不能真正反映机体GH的分泌情况[2]。临床上诊断GH缺乏症必须行ITT才能确定,ITT采用GH峰值5μg/L为诊断切点;通过ITT诊断GH缺乏症不仅是最可靠的,而且可同时测定下丘脑-垂体-肾上腺轴功能,其在诊断GH缺乏症中起到重要作用[10]。ITT易发生严重低血糖、癫痫、冠心病等不良反应,故进行此试验时胰岛素用量应谨慎。《成人生长激素缺乏症诊治专家共识》(2020版)[3]推荐ITT胰岛素注射剂量按照0.1~0.15U/kg计算。但国内外的一些研究及临床工作中发现[6,11],对于一些超重或肥胖者,可能由于胰岛素抵抗造成血糖下降幅度不够,易出现ITT激发失败,即不充分低血糖。如一项研究[6]中,采用0.1~0.15U/kg作为初始胰岛素用量,诱发低血糖的成功率仅42.8%。出现不充分低血糖时需追加胰岛素用量单次甚至数次,这不仅会延长试验时间,增加临床工作量,还增加了患儿及家属的心理负担,甚至可能由于胰岛素在体内蓄积诱发严重低血糖而危及生命[7]。
研究发现[12],高BMI、高基线血糖是不充分低血糖的影响因素,建议BMI>24.012kg/m2的受试者适当增加首次胰岛素注射剂量,可有效诱发低血糖,避免追加胰岛素。因此,在实际临床中,为了通过单次注射胰岛素达到充分低血糖的目的,根据患儿BMI、基线血糖等情况酌情增加胰岛素用量。本研究中,采用传统ITT算法的30例患儿中,6例患儿给予0.1~0.15U/kg胰岛素,10例患儿给予0.15~0.2U/kg胰岛素,14例患儿给予0.2~0.3U/kg胰岛素,首次激发成功者28例,成功率达93.3%,高于其他研究全部按照0.1~0.15U/kg计算量的单次激发成功率[4,10,13]。优化ITT算法用量较传统ITT 算法更具有确定性和个体化。本研究中,优化ITT组的胰岛素用量[(7.46±4.49)U/kg]小于传统ITT组胰岛素用量[(9.48±4.41)U/kg],这也可能是导致优化ITT组不良反应发生率(10.4%)低于传统ITT组(26.7%)的最主要原因。
有研究建议[5],患胰岛素抵抗的肥胖患者通常需要使用更高剂量的胰岛素(0.15~0.21U/kg)来诱导适度的低血糖,同时需警惕可能增加迟发性低血糖的发生风险。本研究中,为了提升传统ITT组患儿单次注射激发成功率又不增加不良事件的发生率,根据患儿情况及临床经验,在指南推荐的0.1~0.15U/kg的基础上酌情增加了胰岛素用量。然而,0.15~0.2U/kg或0.2~0.3U/kg的使用剂量适用于哪些患儿尚未有明确的统一标准。虽然ITT单次注射激发成功率有所升高,但同时因胰岛素剂量增加而导致不良反应的发生率升高。优化ITT组的胰岛素用量具有明确的计算方程式,可得到确切且符合患儿情况的胰岛素数值,因此更具有针对性和个体化。本研究结果显示,优化ITT组单次注射胰岛素激发成功率、60min达峰率和试验结果阳性率与传统ITT组比较均无统计学差异(P>0.05),传统ITT组不良反应发生率(26.7%)高于优化ITT组(10.4%,P<0.05)。以上结果表明,优化ITT组在达到相同试验效果的同时,更具有合理性和安全性。优化ITT组需要患儿提前1天行口服葡萄糖耐量试验,因此在同等条件下,会比传统ITT组患儿多花费1天的时间,这也可能是导致优化ITT组患儿住院天数长于传统ITT组的原因。
综上所述,进行ITT时,采用优化后的个体化胰岛素激发量与参照指南推荐计算的胰岛素剂量相比,在达到相同试验效果的同时更能保障患儿的安全。鉴于纳入为回顾性研究且纳入样本量偏少,今后需要更大样本的队列或前瞻性研究加以论证。

