梅干腹综合征发病机制及诊断与治疗研究进展
孙曼銮,姜惠跃,宋欣怡,刘丽丽,卜 佳
(1.山西大同大学医学院,山西大同 037009;2.大同市第三人民医院产科,山西大同 037046)
梅干腹综合征(Prune Belly Syndrome,PBS),也被称为Eagle-Barrett 综合征,是一种罕见的先天性发育异常,该病症的主要特征是“三联征”:①腹壁肌肉组织缺失或不足,腹肌无力,导致腹壁皮肤松弛,呈“梅脯样”;②泌尿系统畸形,表现为巨膀胱、尿路扩张、肾发育不良等;③双侧隐睾[1-2]。除“三联征”外,PBS 还可在非生殖—泌尿系统(如肺、心血管、胃肠、肌肉骨骼组织等)合并其他畸形。1839 年,Frolich 首次报道了该病症的特点[3]。但直到1901 年,Osler 才将这种合并有膀胱扩张、肾积水、输尿管扩张等畸形,形象的命名为PBS[4]。据先前研究报告,新生儿的发病率为1/2.9 万至1/4 万,该病主要见于男性(95%),但在女性中也有报道[2]。此外,PBS临床表现的严重程度有很大差异,轻者肾功能正常,在成长过程中无明显障碍;重者肾发育不良,肺功能障碍,出生后不能存活[5]。近年来,通过大量科研人员广泛和深入地研究,关于PBS 发病机制虽尚未明确,但在诊断和治疗方面已取得了一定的进展[6]。就该病的发病机制、病理及临床表现、临床分类、产前诊断、治疗及预后等进行了总结与讨论。
1 发病机制
自PBS 被首次报道以来,对本疾病的发病机制一直没有明确的结论,目前主要有尿道梗阻假说、胚源性假说和染色体基因异常假说等。
1.1 尿道梗阻假说
尿道梗阻假说认为在正常情况下,胎儿自妊娠11~14 周时,肾脏已经具备排尿功能;但患病胎儿由于尿道梗阻,导致尿液的引流和排出障碍,进一步造成膀胱和输尿管极度扩张。由于腹壁长期受到压迫,导致肌肉萎缩使腹壁变薄。在胎儿发育后期,膀胱过度膨胀使膀胱壁肌层出现改变,同时影响睾丸的下降,导致双侧隐睾[7]。
一般来说,尿路梗阻按性质可分为机械性梗阻和功能性梗阻。根据梗阻的部位,又可分为上尿路梗阻和下尿路梗阻,而PBS 表现多为下尿路梗阻。2001 年,Volmar 等通过尸检11 例病例,发现其中8 例出现下尿路机械性梗阻,并且具有不同类型的阻塞表现,如尿道前列腺和阴茎部分交界处的异常形成的瓣阀结构、后尿道瓣膜、双尿道等[8];其余3 例均未发现解剖学的梗阻,而是膀胱壁明显增厚伴有间质纤维化和平滑肌束杂乱无章。也有研究认为,PBS患者的尿道梗阻还可以是功能性尿道梗阻,即由于神经、肌肉发育或者膀胱功能障碍,没有解剖学上的阻塞,而功能性尿道梗阻又是前列腺发育不良的结果[9]。如在Frank 等人的研究中,许多梅干腹综合征标本和所有后尿道瓣膜标本均出现后尿道梗阻性病变;此外,该研究还对21 例标本进行了尸检,发现只有1 个标本的前列腺清晰可见,其余9 例前列腺管缺失,11 例前列腺管稀疏[10]。因此,“尿道梗阻假说”这一理论并不能解释所有的PBS表现。
1.2 胚源性假说
胚源性假说的主要内容是胚胎发育中胚层阻滞,表现为患者的尿路无明显梗阻,而是出现间质纤维增生和平滑肌束紊乱[11]。在人类胚胎的发育过程中,胚胎发育分为三个不同的层次:内胚层、中胚层和外胚层。根据目前研究显示,PBS主要累及泌尿系统,而泌尿系统(如肾脏、前列腺)以及腹壁肌肉组织等都是由体节外侧的间质中胚层发育而来的[1],当其发育不良时,腹壁、泌尿道肌肉会发生异常或缺失,导致肌肉无法正常收缩,继而阻碍睾丸正常下降到阴囊,形成双侧隐睾[7]。该假说得到了组织切片分析的支持[12],并且能够解释“尿道梗阻假说”不能解释的情况,因此得到了多数学者的支持。Nunn 等认为在妊娠6~10周时,胎儿中胚层腹壁和泌尿生殖系统肌肉发育中止[13]。正常情况下,间质中胚层出现在胚胎发育的第3~4 周,与此同时,肾脏的前肾开始发育,在第4周末退化消失,并向尾部延伸形成中肾管。中肾管通常在妊娠第6周形成于中胚层,并继续向胚体尾侧延伸,终止于泄殖腔[14]。在这个阶段,中胚层会发育出腹膜、外生殖器、泌尿系统等器官,若此时发生中胚层发育异常可能会导致多种缺陷,出现腹部扩张,尿道梗阻等症状,与PBS 表现出的相关症状相吻合。
1.3 染色体基因异常假说
PBS常见于男性和双胎妊娠,且黑人发病率高于白人[13],这些提示可能与遗传因素有关。尽管大多数PBS 病例是散发的,具有正常的核型,但是有报道异常的核型,包括环状X 染色体,13、18 和21 三体[15]。Granberg 等报道了两例非家族性梅干腹综合征17q12 染色体间质缺失(包括HNF1β基因),提示HNF1β突变会干扰正常的中胚层分化[16]。近年来,除HNF1β外,还发现ACTA2、ACTG2、STIM1、CHRM3等14个基因具有潜在的DNA 突变,其中,MYOCD和FLNA突变是可能导致PBS 的一个新发现的因素[2]。Houweling等通过研究证明MYOCD结合血清反应因子(Serum Response Factor,SRF)能够激活平滑肌(Smooth Muscle,SM)和心肌发育中关键的基因表达程序。当MYOCD突变或缺失时,膀胱壁的平滑肌受损,组织切片表现为平滑肌肌束杂乱无章、不紧凑,继而出现巨膀胱[17]。由于PBS多发于男性,因此有人也认为可能与X 染色体的突变有关。IQBAL 等人发现FLNA突变会导致患者出现PBS 的一些症状。在研究中,他们分析了4 名PBS 患者,对其中2 名同父异母的兄弟进行了全外显子测序,发现在染色体Xq28 上,FLNA出现一个新的错义点突变,导致表现出PBS相关症状[15]。但在女性中,当其中的一条X染色体发生FLNA突变时,另一条X 染色体仍可以补偿功能缺失,从而临床表现出的症状较轻。
2 临床表现及分类系统
2.1 病理学及临床表现
梅干腹综合征的临床表现主要体现在三个方面:腹肌缺失或松弛、双侧隐睾以及泌尿系统异常。除此以外,患者还会出现肌肉骨骼、心血管系统、呼吸系统、消化系统等方面的问题,常会由于羊水过少而出现早产的情况。
常见的临床症状包括:
(1)腹部:腹肌缺失或松弛,PBS患者腹肌发育不良,导致腹部肌肉松弛和膨胀,呈梅干状。出现腹部侧翼隆起、上覆盖褶皱、松弛多余的皮肤、巨大的腹壁疝、腹内压大等特征。
(2)生殖系统异常:男性患者会出现双侧隐睾、逆行性射精、前列腺发育不全、精囊异常、阴茎勃起组织发育不足等。
(3)泌尿系统异常:肾脏方面,患者常会因肾积水或肾脏发育不良、复发性肾炎、梗阻性肾病、肾收集系统扩张、肾盏畸形等逐渐发展为肾功能衰竭从而导致死亡。而膀胱及输尿管等方面会出现膀胱输尿管反流(vesicoureteral reflux,VUR)、脐尿管憩室、巨膀胱、尿道假憩室、巨输尿管、输尿管曲折或冗余、输尿管平滑肌缺少或发育不良、尿道狭窄、尿路梗阻、尿道扩张、尿道闭锁、复发性尿路感染(recurrent urinary tract infection,UTI)、尿路感染、尿脓毒症等。
(4)呼吸系统:常见肺发育不全或异常、肺炎。
(5)消化系统:肠旋转不良、肠系膜闭锁或狭窄、胃食管反流病(Gastroesophageal reflux disease,GERD)、十二指肠穿孔、巨结肠、肠梗阻、肛门闭锁、便秘等。
(6)四肢:由于泌尿系统出现障碍,导致排出的胎儿尿液量少,从而引起羊水过少,引发胎儿死亡或导致胎儿膝关节外侧、足马蹄内翻、髋关节发育不良、先天性脊柱侧凸、肋缘外翻等。
(7)心血管系统:易出现法洛四联征(Tetralogy of Fallot,TOF)、房间隔缺损、心室中膈缺损等。
(8)耳-腭-指谱系障碍(Otopalatodigital spectrum disorder,OPDSD):患者出现明显的颅面和骨骼异常、眶上脊突出、齿缺、下斜睑裂、眼球突出、眼距增宽、面部不对称、听力下降、发育迟缓、腭裂、树蛙足等。
2.2 临床分类系统
在早期,WOODARD 根据临床参数和患者需手术的即时性,于1985 年提出了一种分类系统[18],该系统将梅干腹综合征的儿童患者分为三类,见表1。

表1 WOODARD 提出的分类系统
随后,为了更好地区分Ⅱ类患者和Ⅲ类患者的严重程度,2019 年Wong 等人[19]提出了RUBACE 系统,其中,R代表肾、U代表输尿管、B代表膀胱、A代表腹壁、C 代表隐睾、E 代表泌尿生殖外的,该系统以评分的方式(0~ 31 分)对PBS 患者的严重程度进行了分级,将患者分为“isolated PBS”“syndromic PBS”以及“PBS-plus”三个组别,详情见表2。该系统为临床手术提供了评估依据。
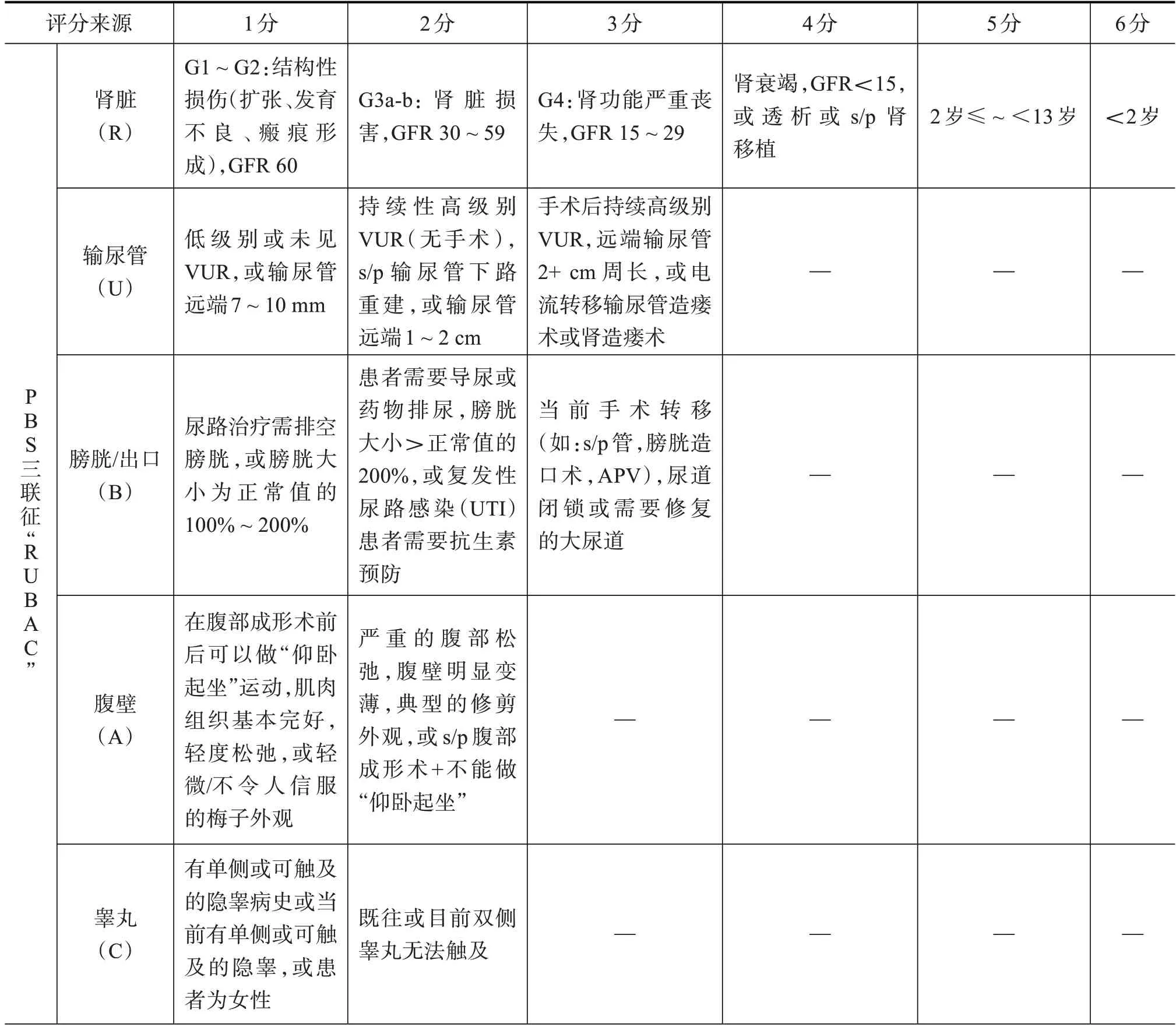
表2 RUBACE 评分系统
3 产前诊断
3.1 超声检查
超声检查是产前诊断PBS 最常用的非侵入性方法之一。通常在妊娠期间进行结构性超声检查时,可以发现PBS 的特征性异常。产前超声可以提供有关胎儿腹部肌肉发育的信息以及肾脏和泌尿系统的情况,对于诊断PBS 非常重要。一般来说,当患有PBS 时,超声检查可能会出现以下特征:①胎儿腹壁菲薄。在超声检查中,医生会观察胎儿腹壁的厚度、强度和均匀性。通常,患有PBS的胎儿腹壁会比正常胎儿更薄。但是需要注意的是,不完全型梅干腹综合征不会出现腹壁菲薄症状。Bellah等报告了8例不完全型梅干腹综合征的患者,影像显示他们有正常的腹壁[20]。因此,在诊断时应特别注意这种情况,以防误诊和漏诊。②羊水过少。由于PBS 患儿的肾脏和泌尿系统发育异常,导致尿液无法正常排出,从而引起羊水过少的情况。产前超声诊断可以通过测量羊水深度来判断是否羊水过少。来蕾等分析了5 例进行产前超声诊断的PBS胎儿,结果发现5例均出现羊水过少的情况[21]。周彩云等也在产前彩色多普勒超声诊断的结果中检查出患有PBS 的胎儿大部分出现了羊水过少[22]。可见,羊水过少也是PBS的常见表现之一。③巨膀胱。巨膀胱是指膀胱的异常扩张,由于尿液潴留所致。在超声检查中可看到胎儿腹腔内有一巨大的囊性占位,40~ 60 min 后膀胱无明显缩小,并且在彩色多普勒超声检查中还可探及膀胱周围的脐血管的血流走行[23]。④双肾回声增强,提示肾积水。⑤阴囊内空虚,无睾丸显示。说明睾丸降入阴囊,出现PBS“三联征”中的隐睾。需要注意的是,中孕早期胎儿睾丸尚未下降到阴囊,所以超声诊断并不能检测出[23]。⑥合并其他畸形:在产后还可发现足内翻、肛门直肠闭锁、肠旋转不良、脊柱侧弯等其它畸形。
在产前超声检查中,对于同时满足①②③的胎儿,应高度怀疑PBS,建议进行进一步的检查,必要时行羊水穿刺。对于仅满足一条标准的胎儿建议进行定期产检和密切随访,根据严重程度采取进一步措施。PBS 常与后尿道瓣膜症(posterior urethral valve,PUV)、尿道闭锁等先天畸形相混淆,易造成误诊。
3.2 羊水穿刺
羊水穿刺是一种侵入性产前诊断方法,用于收集胎儿羊水样本进行遗传学分析。这种方法可以用于检测染色体异常、基因突变和其他遗传疾病。对于怀疑患有PBS 的胎儿,羊水穿刺在超声检查结果不明确或存在其他遗传疾病风险的情况下可以帮助确认诊断。
4 治疗和预后
4.1 尿路重建
一般来说,PBS 患者的尿路系统存在异常,常见的异常包括肾盂积水、输尿管狭窄、膀胱肥大和尿道下裂等。尿路重建手术的目的是修复尿路异常,减轻尿路症状,防止肾功能损害。
尿路重建手术的方法包括肾盂成形术、远端输尿管切除术、输尿管膀胱造瘘术等。手术方法的选择取决于尿路畸形的类型和严重程度。肾盂成形术是一种重建肾盂的手术,它可以改善肾盂积水、肾功能损害等症状。由于输尿管扩张或者VUR,需要进行远端输尿管切除术,对通常扩张较小的近端予以保留,然后再进行膀胱输尿管移植[2]。此外,尿路重建手术的成功率取决于患者的年龄、尿路畸形的类型和手术技术的熟练程度。因此,建议在患儿6~8月左右进行尿路重建,以改善尿路系统的异常,减轻肾脏功能的损害[24]。术后应密切监测并及时处理并发症,包括尿路感染、尿失禁等。有研究发现,大多数患者接受手术后预后良好,经长期随访来看,40 名接受尿路重建的儿童中有35名肌酐水平保持正常,2名发展为中度肾功能衰竭,3 名重度肾功能衰竭而进行肾移植[24]。
4.2 睾丸固定术
睾丸固定术是PBS 患者治疗的另一种方法。PBS患者常伴有睾丸下降或隐睾等问题,这会导致睾丸受损和生育能力下降。睾丸固定术是指在寻得睾丸后,松解精索、扩大阴囊将睾丸固定于阴囊内,以改善睾丸功能和避免潜在的并发症。睾丸固定术的方法包括开放式手术和腹腔镜手术。
如若胎儿的隐睾出现了萎缩的现象,则需要进行睾丸切除术。Fallat 等人证明,2 岁的儿童萎缩率更高[1],故目前认为患儿6~12 月是进行睾丸固定术的最佳时间[25]。
4.3 腹壁重建术
腹壁肌肉萎缩是PBS 的主要特征之一,这会导致腹部膨胀和腹壁功能障碍。腹壁重建术是在切除或不切除缺乏的中央肌肉和筋膜部分的情况下,推进这些神经支配良好、血管通畅的外周肌肉层,使膀胱得到排空[1]。
腹壁重建术的方法包括腹壁皮瓣移植术、腹直肌转移术和人工材料修复术等。目前最广泛接受的方式是1998 年报道的Firlit 技术,该技术在中线以双排扣方式复制外侧筋膜层,无需外侧筋膜剥离或切开中线筋膜板,具有腹膜外入路的优势[26]。大多数患者在接受该手术后,膀胱排空得到了改善,能够更有效的进行咳嗽和排便[27]。
5 小结
PBS常危害患者的泌尿系统、消化系统以及引起多种器官及脏器功能降低和丧失,对患者的生活质量和生存构成威胁,主要发生于婴儿和儿童,常见于男性。虽然目前对PBS 的病因还不完全清楚,但有几个假说得到了广泛关注。其中包括尿道梗阻假说、胚源性假说、染色体基因异常假说等。对于PBS的治疗,则需要综合考虑患者的病情和具体情况。尿路重建术、睾丸固定术和腹壁重建术是最常见的手术方法,可以缓解患者的症状,改善生活质量。治疗效果和预后也因个体差异而不同,有的患者可能需要长期管理。但在我国,目前关于PBS 的研究和认识相对较少,临床诊断和治疗的水平仍有待提高。研究发现,PBS 患者在围产期死亡率高达29%,婴儿死亡率为20%,并且大部分患者有合并症[28]。

