高温芝麻饼粕蛋白酶解液的2种美拉德反应产物组分特性差异
芦鑫,张丽霞,孙强,3,高锦鸿,金璐,黄纪念,3*
1(河南省农业科学院农副产品加工研究中心,河南 郑州,450002)2(河南省农产品生物活性物质工程技术研究中心,河南 郑州,450002)3(农业部油料加工重点实验室,湖北 武汉,430062)4(河南工业大学 粮油食品学院,河南 郑州,450001)
高温芝麻饼粕是芝麻香油生产过程的副产物[1]。我国高温芝麻饼粕资源丰富,据测算,我国每年产生约50万t高温芝麻饼粕[2]。高温芝麻饼粕富含蛋白,但蛋白受高温变性影响,水溶性差,难以提取与应用[3]。为利用高温芝麻饼粕蛋白资源,有必要开展加工应用研究。
将蛋白酶解后,经美拉德反应制备香精是蛋白利用的途径之一。研究表明芝麻蛋白酶解液可以通过美拉德反应制备肉味香精[4],但尚未探究高温芝麻饼粕蛋白酶解液(high temperature sesame meal protein hydrolysate,HTSPH)制备肉味香精的可能性。高温芝麻饼粕蛋白与芝麻蛋白在组成与性质上存在差异[5],二者经酶解后多肽与游离氨基酸组成有区别,故有必要探索HTSPH经美拉德反应制备肉味香精的可行性。此外,伴随美拉德反应,体系内还发生蛋白降解、多糖降解、焦糖化反应等[3],上述反应对于高温芝麻饼粕蛋白制备香精的影响尚未讨论。因此,有必要分析反应前后,体系内物质的组成性质的变化,以便推断各种反应的影响与作用。
本文以HTSPH为原料,对比添加木糖与添加木糖和Cys两种美拉德反应后,反应产物特性、挥发性组分、多肽与氨基酸组成、抗氧化活性的差异,以便为调控HTSPH制备香精提供理论依据与数据支持。
1 材料与方法
1.1 材料与试剂
高温芝麻饼粕,河南省久创科技有限公司,蛋白含量(40.44±0.96)%;胰糜蛋白酶[(400 349±4 576) U/g],上海阿拉丁生化科技股份有限公司;风味蛋白酶[(197 042±2 477) U/g],安琪酵母股份有限公司;Alcalase[(178 152±1 267) U/g],Sigma-Aldrich公司;其他试剂,分析纯,国药集团化学试剂有限公司。
1.2 仪器与设备
Infinite M Nano酶标仪,瑞士TECAN公司;K1100全自动凯氏定氮仪,海能未来技术集团股份有限公司;7890A气相色谱、5975C质谱仪,美国安捷伦有限公司;XSR205DU电子天平、FE20实验室pH计,梅特勒-托利多仪器有限公司;ROTANTA460R离心机,德国Hettich科学仪器公司。
1.3 试验方法
1.3.1 高温芝麻饼粕蛋白提取与酶解
将高温芝麻饼粕粉碎后,石油醚(沸程30~60 ℃)脱脂,获得脱脂饼粕。按照料液比1∶25(g∶mL)加入蒸馏水,搅拌均匀,采用3 mol/L NaOH溶液调节pH到10.8,40 ℃以400 r/min搅拌1 h,采用4 000 r/min离心20 min,收集上清液,采用3 mol/L HCl溶液调节pH至4.30,4 ℃静置过夜,以6 000 r/min离心20 min,收集沉淀,用截留分子质量3 000 Da的透析袋4 ℃透析24 h,冻干,获得高温芝麻饼粕蛋白,其蛋白含量(84.72±0.71)%。取高温芝麻饼粕蛋白配成50 g/L蛋白溶液,调节pH 8.6,加入混酶量11 860 U/g(混酶由Alcalase、胰糜蛋白酶、风味蛋白酶组成,酶活力比0.34∶0.41∶0.25),45 ℃酶解5 h,中和,8 000 r/min离心20 min,收集上清液,冻干,获得HTSPH。
1.3.2 美拉德反应
参考SHEN等[4]方法,HTSPH加入100 mL蒸馏水配成100 g/L HTSPH溶液(样品A),加入3 g木糖,搅拌均匀,调节pH至7.5,转移到旋塞耐压玻璃管后,加入转子,120 ℃搅拌加热2 h后,冰水浴冷却,获得美拉德反应物(样品B)。另外,100 mL 100 g/L HTSPH溶液,加入3 g木糖与1.2 g Cys,随后按照上述条件进行美拉德反应,获得反应产物(样品C)。
1.3.3 样品性质分析
采用pH计测定样品A、B、C的pH。为考察褐变程度,用蒸馏水将A、B与C的固形物质量浓度稀释至1 mg/mL,采用分光光度计测定420与294 nm的吸光度[4]。为评价糖基化程度,取A、B、C稀释至0.3 mg/mL,采用荧光分光光度计340 nm激发,在360~600 nm进行扫描[6]。
1.3.4 挥发性组分测定
参考CAI等[7]的方法并做适当修改,分别取8 mL的A、B、C,加入30 mL顶空进样瓶后,利用微量注射器加入0.1 μL间二甲苯,加入磁力搅拌子,旋紧盖子,设置转速200 r/min,65 ℃平衡20 min,随后采用的气相柱为HP-5MS Phenyl Methyl Siloxane(30 m×250 μm,0.25 μm)弹性石英毛细管柱,升温程序:55 ℃保持5 min,以4 ℃/min从55 ℃升到115 ℃,8 ℃/min升温至195 ℃,10 ℃/min升温至235 ℃,并保持3 min。进样口温度250 ℃,载气为高纯度He,流速1 mL/min,不分流。质谱检测条件:离子源温度230 ℃,离子化能量70 eV,四级杆温度150 ℃,质量扫描范围30~550(m/z)。参照NIST08.LIT谱库对风味组分进行鉴定,取匹配度大于800的组分进行定量,以间二甲苯的峰面积计算其他组分的浓度,采用正交偏最小二乘法判别分析法(orthogonal partial least squares discriminant analysis,OPLS-DA)解析挥发性组分。
1.3.5 多肽组分测定
分别取3 mL A、B、C,均加入0.9 mg多肽EGDIKW,混匀后,采用LC-MS/MS检测多肽组分[8]。以Score>90为标准,确定鉴定出多肽,并依据EGDIKW的峰面积,计算其他多肽组分浓度。浓度前十的多肽录入ToxinPred(https://webs.iiitd.edu.in/raghava/toxinpred/design.php)预测多肽的疏水性、亲水性、两亲性、空间位阻、净氢、电极性,利用典型判别函数进行判别分析。
1.3.6 游离氨基酸组分测定
样品A、B、C中游离氨基酸组分测定方法参考WANG等[9]与LI等[10]的方法。
1.3.7 多肽浓度测定
取0.5 mL样品液加入0.5 mL 100 g/L三氯乙酸溶液,混匀,8 000 r/min离心10 min,取上清液15 μL加入到96孔板,加入20 μL水,加入200 μL双缩脲溶液,混匀后,37 ℃反应20 min,540 nm测定吸光度[11]。以马尿酰-组胺酰-亮氨酸(hippuryl-histamine-leucine,HHL)为标样,计算酶解液中多肽浓度。
1.3.8 游离氨基酸浓度测定
取10 mL样品加入10 mL 100 g/L三氯乙酸溶液,混匀,8 000 r/min离心10 min,收集上清液,加入蒸馏水定容到200 mL,加入到配有纳滤膜NF1的膜过滤套件中,以3 MPa运行压力,200 r/min搅拌,收集透过液,采用茚三酮法测定氨基酸浓度,标样采用GBW(E) 100062标准氨基酸,570 nm测定吸光度[12]。
1.3.9 抗氧化活性测定
为探究美拉德反应前后样品的抗氧化活性变化,测定样品A、B、C与样品Bo(操作同B,未做美拉德反应)与Co(操作同C,未做美拉德反应)的DPPH自由基与ABTS阳离子自由基清除率,具体操作参考文献[13]的方法。采用GB/T 10345—2022《白酒分析方法》的重量法,测定样品液的固形物浓度,计算IC50。
1.3.10 数据统计与分析
无特殊说明,实验平行测定3次。同一图中同一列上带有相同小写字母的数据间,在0.05水平无显著差异;SIMCA 14.1进行OPLS-DA;SPSS 25中判别式进行判别分析。
2 结果与分析
2.1 样品pH、褐变与糖基化分析
如图1-a所示,经过高温美拉德反应后,产物的pH较原料有显著下降,其中样品C的pH最低。这与游离氨基酸参加美拉德反应后,生成酸性物质有关[14]。图1-b中294 nm吸收峰反映美拉德反应的无色中间产物如醛、酮等有关[15],与原料A相比,B在294 nm的吸光度有显著提高,而C无显著变化,推测在B的美拉德反应体系中,由于未添加游离L-Cys,存在木糖过剩现象,这部分木糖经脱水、降解生成糠醛等醛酮化合物[16]。观察420 nm的吸光度发现:C的吸光度较B有显著下降,由于420 nm吸收峰与美拉德反应生成的褐色物质有关,推测Cys具有高活性的巯基,它在反应中起主导地位,阻碍其他物质参加美拉德反应,从而减少褐色物质的生成[17]。由图1-c,样品A、B、C的荧光曲线相似,其峰值分别在416.06、418.03、418.03 nm,峰高分别是412.57、417.36、434.50。鉴于420~440 nm的荧光波长与蛋白糖基化终产物有关[6],推测B、C的美拉德体系中,仅少量蛋白参加了美拉德反应。
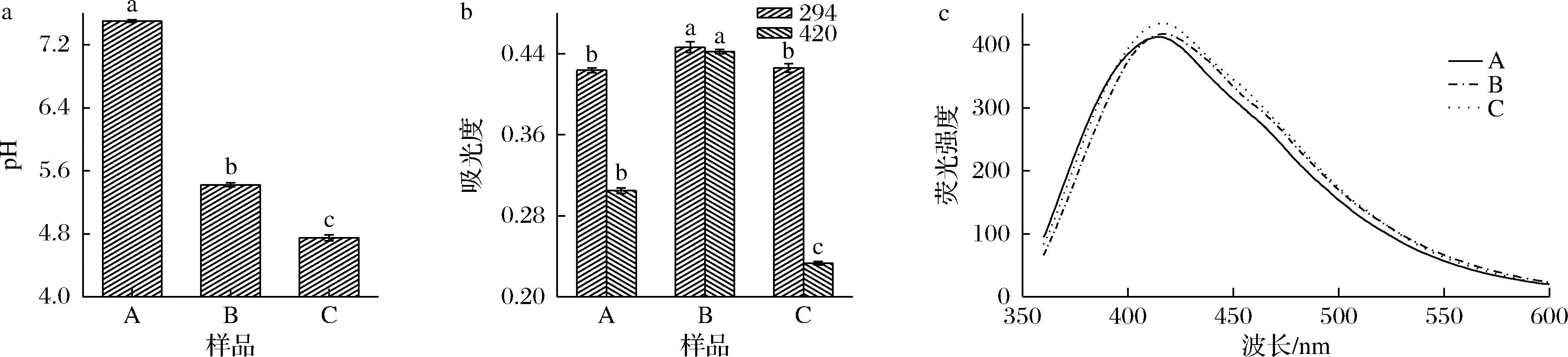
a-pH;b-褐变;c-糖基化
2.2 样品的风味特征分析
由电子版增强出版附表1(https://doi.org/10.13995/j.cnki.11-1802/ts.034933)可知,采用GC-MS从3个样品中共检测出95个样品,主要由烯炔类、醛酮类、酚类、羧酸类、酯类、杂环类、含硫化合物、其他类组成。3种样品中的挥发性组成有明显差异,如样品A有31种挥发性成分,以醛酮类(12种)、羧酸类(4种)组分为主,杂环类与含硫化合物较少;样品B有49种挥发性成分,以醛酮类(14种)、杂环类(20种)为主;样品C有53种组分,其中含硫类化合物(20种)较丰富。
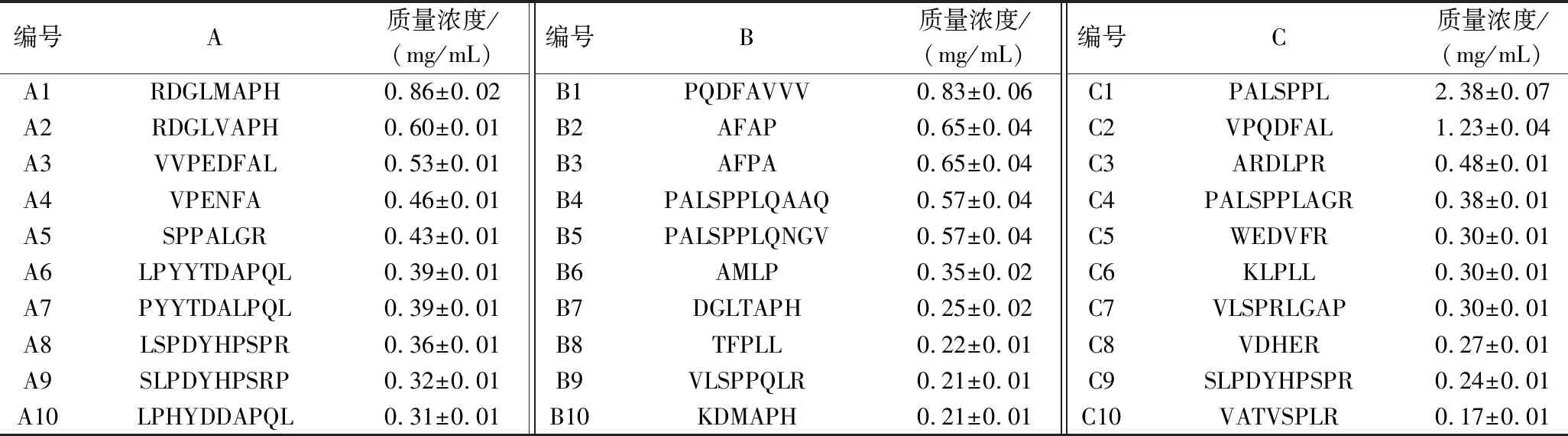
表1 样品A、B、C中浓度前十的多肽表

利用OPLS-DA找到55种特征挥发性标志物(VIP>1),具体见电子版增强出版附表1。将上述特征挥发性标志物进行聚类热图分析(图2),3种样品分成3类,样品A与样品B关系较近。样品A中挥发性标志物主要是简单的醛酮类物质(图中红色区域);样品B中挥发性标志物杂环化合物、长链脂肪酸(红橙区域),其中糠醛浓度最高;样品C中挥发性标志物以含硫化合物为主(红色区域)。通过对比样品B与样品C的挥发标志物可知,添加Cys改变了美拉德反应的反应历程与生产物。Cys与木糖进行美拉德反应,初期主要形成2-糖基噻唑烷-4-羧酸与半胱氨酸-Amadori,随后2-糖基噻唑烷-4-羧酸转化成Cys-Amadori化合物,随之该化合物发生降解,生成2-甲基-3-呋喃硫醇、2-糠硫醇等含硫肉香化合物[19]。由于Cys的竞争效应,削弱了其他含氮化合物与木糖的美拉德反应,造成其他杂环化合物生成量降低。上述硫化物呈现肉味,故样品C具有浓郁煮肉香味,可以用于制作肉味香精。
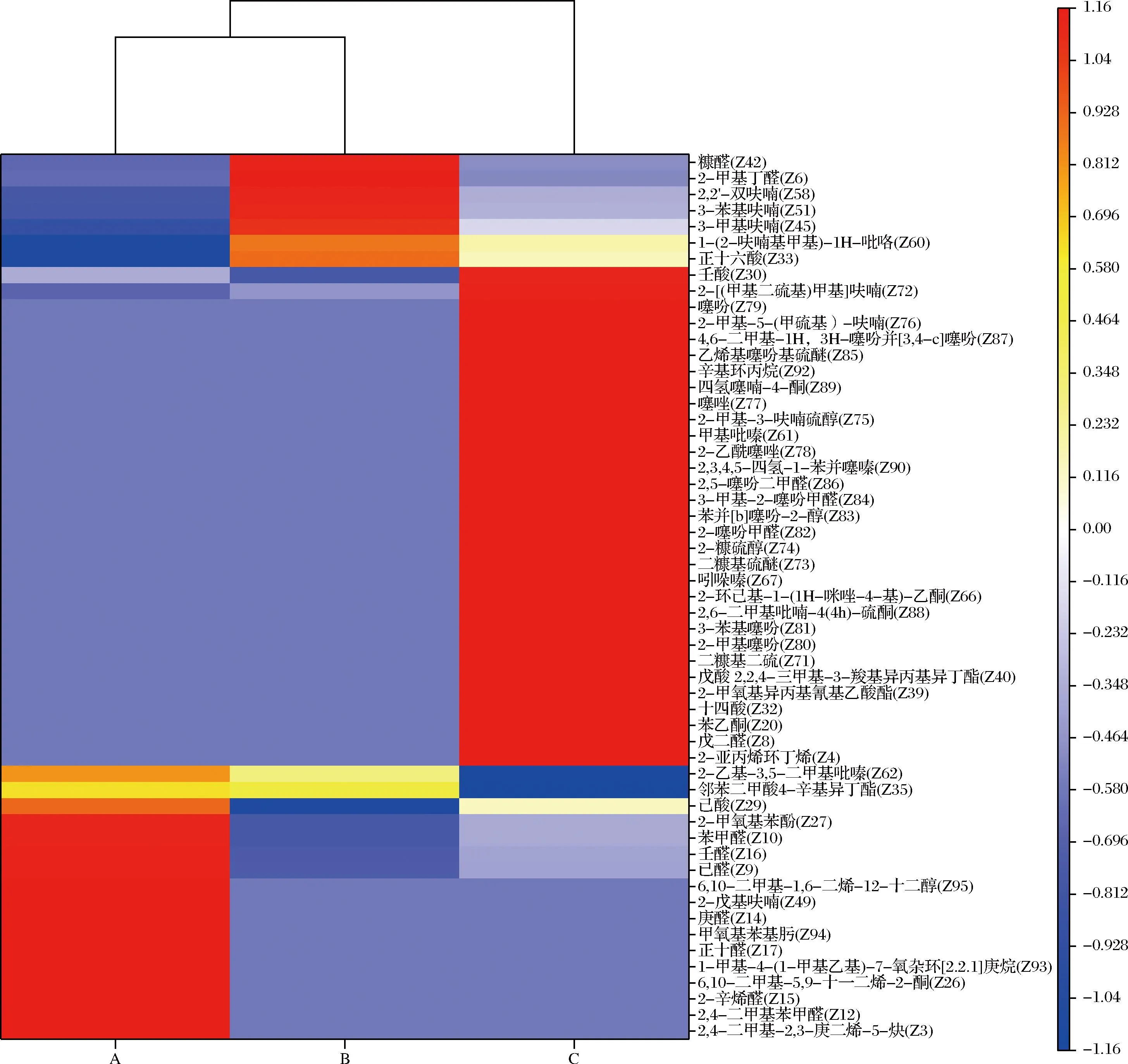
图2 样品中特征风味物聚类热图
SHEN等[4]报道芝麻蛋白酶解液添加木糖与Cys的美拉德反应产物,有6种含硫化合物(以噻吩类化合物为主,3-甲基-2-噻吩甲醛含量最高),6种醛类(3种脂肪醛、2种芳香醛与糠醛),4种酚类(丁香酚含量最高),5种酸酯类(酸类含量高),与2种呋喃类、1种吡嗪、1种吡啶与3种烷烃类组成。上述组成与样品C美拉德反应产物有明显差别,尤其在含硫化物组成方面,样品C中的含硫化合物以糠基硫化物(硫醚、硫醇)、噻吩类、噻唑类等20种组成。产生上述差异的原因与2种体系中多肽、游离氨基酸种类差别有关,由于N源组成差异导致美拉德反应产物的挥发性成分也有差异[20-21]。鸡肉肽制作肉味香精也有类似结果报道[22]。
2.3 反应前后多肽组成变化
由图3可知,反应前后多肽组成与浓度有显著变化。A中有383条多肽经反应后消失,B和C中有386条多肽生成(图3-a),这表明高温条件下,多肽参于美拉德反应被消耗的同时,也有蛋白、多肽由断裂或重排生成新多肽[1,3]。高温会导致蛋白或多肽在酸性氨基酸残基处断裂[23],也会加速Cys、Met、Trp的分解,导致肽链断裂[24],形成新的肽段或其他化合物。B和C中多肽浓度显著增加,且多肽分子质量向800 Da以下集中(见图3-b),也验证了蛋白与多肽在高温作用下发生断裂生成新多肽的现象。

a-多肽韦恩图;b-多肽浓度与分布图
单因素方差分析样品中浓度前十的多肽(表1)特性发现:原料与产物中浓度前十的多肽在疏水性、亲水性、两亲性、空间位阻、电极性、净氢上无显著差异(电子版增强出版附表2,https://doi.org/10.13995/j.cnki.11-1802/ts.034933),说明依靠单一指标不能有效区分原料与产物中多肽。将上述性能指标通过典型判别分析后,建立如下辨别函数:
判别函数1(F1)=30.40×疏水性-15.76×空间位阻+0.27×两亲性+12.88×净氢+0.24×电极性+5.12×亲水性+3.95
判别函数2(F2)=8.77×疏水性-0.73×空间位阻+3.02×两亲性+0.13×净氢+0.72×电极性+0.68×亲水性-0.68
如图4所示,利用上述辨别函数对A、B、C中多肽进行判别,基本能区分原料与产物的多肽(总体正确率为80%)。上述结果表明原料与产物中多肽在理化性质上存在某些特征规律,需要后续加以研究。

图4 样品中浓度前十多肽的典型判别分布图
观察样品A、B、C多肽的N与C端氨基酸分布发现,原料A中N端Leu、Val、Thr的多肽与C端Arg、Leu、Gln、Tyr的多肽在高温反应过程中大量消耗,在未添加Cys的美拉德反应体系(样品B)中,多肽以N端Asp、Ala、Pro、Trp、Gln和C端Glu、His、Lys居多;添加Cys的美拉德反应体系(样品C)中,多肽以N端Phe、Ser、Asn,C端Pro、Ala居多(见图5)。以上多肽N与C端的氨基酸残基分布差异可能与多肽参与美拉德反应的活性、氨基酸稳定性有关[25],ZOU等[26]发现N端Leu的多肽具有高美拉德反应活性,NI等[27]研究参与美拉德反应的菜籽多肽,其N端多为Val、Asp、Gln、Glu、Gly等,美拉德反应活性前十多肽的C端Leu、Pro为主。故多肽参与美拉德反应活性差异,导致A与B、C的多肽组成有明显差异。

a-N端氨基酸;b-C端氨基酸
2.4 反应前后游离氨基酸组成变化
由图6-a可知,相较于样品A的游离氨基酸浓度,样品B的游离氨基酸浓度下降29.75%。样品C的游离氨基酸浓度是(11.31±0.66)mg/mL,与其反应前游离氨基酸浓度是(20.62±0.37)mg/mL(在100 mL样品A中添加了1.2 g Cys)相比,下降了45.15%。上述结果表明,游离氨基酸参与美拉德反应与其他反应。

a-总氨基酸;b-酸碱氨基酸;c-非极性不带电荷氨基酸;d-非极性带电荷氨基酸
在未添加Cys的美拉德反应体系中,除Pro与Tyr外,其他游离氨基酸经反应后均有显著下降,其中Arg、His、Met、Trp、Cys的浓度下降幅度在80%以上(图6-b~图6-d),推测上述氨基酸更易参加美拉德反应,Arg与His有2个以上的氨基,增加参于美拉德反应的机率;Met与Cys中有性质活泼的硫甲基与巯基,在高温环境下,更易发生裂解,参于美拉德反应与其他反应。而Pro与Tyr的浓度增加,表明高温加热导致部分蛋白与多肽的肽链断裂,生成游离氨基酸,而Pro是环状的亚氨基酸,其亚氨基只有1个氢原子,难以参加美拉德反应,同时,Tyr可能受3-对羟苯基的空间干扰,使氨基难以与单糖的羰基接近发生反应,故上述2种氨基酸浓度有所上升。研究表明,Met、His、Arg参与美拉德反应分别生成熟土豆味、烤面包味、焦糖味[18],这与样品B挥发性成分的风味特征一致。
添加Cys的美拉德反应体系中,除Glu、Met、Trp外,其他游离氨基酸在样品C的浓度高于样品A。考虑到反应前添加Cys至体系中终质量浓度12.19 mg/mL,而反应后Cys质量浓度为0.63 mg/mL,这表明大量游离Cys参加美拉德反应时,抑制其他氨基酸参加美拉德反应。由于Cys的美拉德反应产物的风味以肉味为主[28],这造成样品C的挥发性成分的风味特征以肉味为主。另外,蛋白与多肽加热分解产生的游离氨基酸,导致其他氨基酸浓度呈现上升趋势。Met与Trp性质活泼,在高温作用时,会发生氧化裂解[23],导致浓度下降。Glu的羰基能促进分子内发生环化、缩合等反应[29],造成浓度下降。
2.5 反应前后抗氧化活性变化
如图7所示,相较于原料A,美拉德反应产物B、C的抗氧化活性有显著提升,这与美拉德反应过程中产生的类黑精、还原酮及一些杂环化合物具有良好的抗氧化活性有关[30]。在未添加Cys的美拉德反应体系中,产物B的抗氧化活性强于反应前Bo,这表明美拉德反应过程中生成的抗氧化物,提升了产物的抗氧化性;与添加Cys的美拉德反应的样品Co相比,产物C的抗氧化活性有所下降。Co中添加了半胱氨酸,半胱氨酸具有强抗氧化性,对Co的抗氧化活性起重要作用。虽然美拉德反应过程中,生成抗氧化物,但半胱氨酸大量消耗,严重削弱了体系抗氧化性,表现出IC50上升。
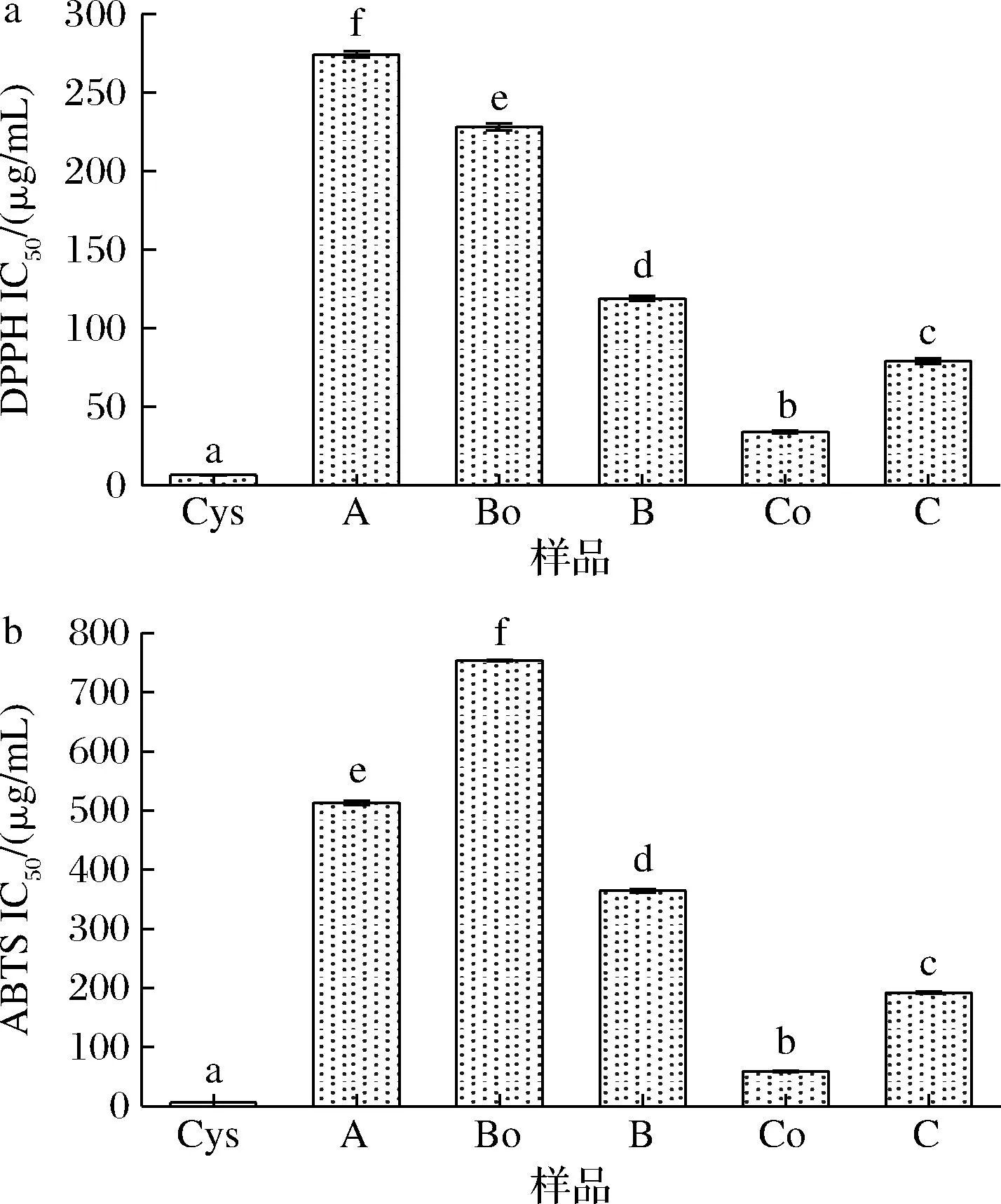
a-DPPH自由基清除能力;b-ABTS阳离子自由基清除能力
3 结论
综上所述,HTSPH在添加木糖与添加木糖和Cys后,经美拉德反应得到产物在挥发性组分、多肽与氨基酸组成、抗氧化特性等方面有明显差异,其中仅添加木糖的美拉德反应产物有烘烤坚果味,挥发性标志物是杂环化合物、长链脂肪酸,添加木糖与Cys的美拉德反应产物具有浓郁肉味风味,可以用于制作肉味香精,挥发性标志物味为含硫化合物;在美拉德反应与蛋白肽链断裂共同影响下,多肽浓度上升且组成也有变化,生成的多肽与原有多肽在疏水性、亲水性、两亲性等性质上有差别;反应后,游离氨基酸浓度下降,未添加Cys的美拉德反应体系中,所有氨基酸均呈现下降趋势,而添加Cys的美拉德反应体系,Cys同其他氨基酸竞争,抑制其他氨基酸参与美拉德反应,加之蛋白与多肽断裂生成氨基酸,造成部分氨基酸浓度上升;美拉德反应可以提升原料的抗氧化活性,但生成的抗氧化物的抗氧化活性要弱于Cys。在后续研究中,要探明多肽参与美拉德反应的规律与反应动力学,探究多肽、游离氨基酸组成对挥发性组分的影响,为精准调控美拉德反应奠定理论基础。