枯草芽胞杆菌重组表达的Pantoea dispersa UQ68J蔗糖异构酶制备异麦芽酮糖的研究
赵文冲,吴敬,张康*,陈晟*
1(江南大学 食品科学与技术国家重点实验室,江苏 无锡,214122)2(江南大学 生物工程学院,江苏 无锡,214122)
异麦芽酮糖(isomaltulose),俗称帕拉金糖,分子式为C12H22O11,由葡萄糖分子和果糖分子以α-1,6键连接而成,是蔗糖(α-1,2键)的同分异构体[1]。异麦芽酮糖有着与蔗糖相似的外观和口感,甜度只有蔗糖的一半[2]。异麦芽酮糖不被大多数微生物分解利用,因此它能够防治龋齿;异麦芽酮糖被食用后,不会在口腔和胃中被分解消化,而是在小肠内被蔗糖酶和异麦芽糖酶缓慢水解为单糖,然后被吸收利用,因而它具有提神抗疲劳、不致腹泻、不刺激血糖迅速升高、加速脂肪代谢等优点[3]。美国食品药品管理局(Food and Drug Administration,FDA)将异麦芽酮糖列为公认安全食品(generally recognized as safe,GRAS),在欧洲日本等地区异麦芽酮糖也已被用作蔗糖代替品而广泛使用[4]。作为一种新型的功能糖,异麦芽酮糖在食品领域有着广阔的应用前景。
异麦芽酮糖天然存在于蜂蜜、甘蔗等食物中,但含量较低,提取困难,不能满足异麦芽酮糖庞大的市场需求量。因此,如何高效制备异麦芽酮糖成为了研究的热点内容。目前异麦芽酮糖的制备方法有化学合成法、植物转基因法、微生物转化法、酶转化法。化学合成法制备异麦芽酮糖反应困难且成本较高,植物转基因法制备异麦芽酮糖会严重影响植物自身生长发育[5],微生物转化法制备异麦芽酮糖受到微生物细胞活力以及底物浓度的限制,酶转化法一般没有上述问题,因而是制备异麦芽酮糖的主要方法。蔗糖异构酶(sucrose isomerase,SIase,SI,EC.5.4.99.11)是酶法制备异麦芽酮糖所使用的酶,主要来源于微生物,它可以将蔗糖异构为异麦芽酮糖,同时水解生成一定量的单糖[6]。吴琦等[7]将Klebsiellasp.LX3蔗糖异构酶在解脂耶氏酵母中进行表面展示,其转化蔗糖时异麦芽酮糖产率为77%;LI等[8]将ErwiniarhaponticiNX-5来源的蔗糖异构酶在大肠杆菌中表达后制备异麦芽酮糖,其产率可达87%;程胜等[9]将SerratiaplymuthicaAS9蔗糖异构酶在大肠杆菌中重组表达后制备异麦芽酮糖,异麦芽酮糖产率最高可达87.9%;WU等[10]将PantoeadispersaUQ68J来源的蔗糖异构酶在大肠杆菌中表达后制备异麦芽酮糖,产率可达91%。
枯草芽孢杆菌(Bacillussubtilis)是一种革兰氏阳性菌,遗传背景清晰,不含内毒素,无致病性,FDA将其列为公认安全微生物。枯草芽孢杆菌有着优秀的胞外分泌蛋白能力,它可以将目的蛋白释放到胞外上清液中,便于产物的分离纯化,降低生产成本[11]。枯草芽孢杆菌是工业酶制剂生产的常用宿主,多种外源蛋白如α-淀粉酶[12]、脂肪酶[13]、普鲁兰酶[14]、β-葡萄糖苷酶[15]等都已成功地在枯草芽孢杆菌中实现了重组表达。异麦芽酮糖作为一种食品甜味剂,有必要在食品安全级微生物中表达,因此本研究将P.dispersaUQ68J蔗糖异构酶在枯草芽孢杆菌中重组表达,对重组蔗糖异构酶进行纯化并测定了酶学性质,最后用重组酶制备异麦芽酮糖并对酶法制备异麦芽酮糖的转化条件进行了优化。本研究为工业生产异麦芽酮糖提供了一定的参考。
1 材料与方法
1.1 实验材料
1.1.1 菌株与质粒
穿梭质粒pHY300PLK,大连宝生物工程有限公司;克隆宿主BacillussubtilisSCK6[16]、表达宿主BacillussubtilisWS9[17]、带有PantoeadispersaUQ68J蔗糖异构酶基因sim的重组质粒pET-24a (+)-sim为本实验室保存;重组质粒pHY300PLK-sim和重组菌株WS9/pHY300PLK-sim为本研究构建。
1.1.2 主要试剂
DP209普通琼脂糖凝胶DNA回收试剂盒、DP103质粒小提试剂盒,北京天根生化科技有限公司;2×Phanta Max Master Mix,南京诺唯赞生物科技股份有限公司;SDS-PAGE凝胶配制试剂盒,上海碧云天生物技术有限公司;DNA Maker、标准分子质量蛋白Maker,大连宝生物工程有限公司;异麦芽酮糖、海藻酮糖标准品,Sigma公司;其他常见试剂,上海国药集团有限公司。
1.1.3 主要培养基
LB液体培养基(g/L):蛋白胨10,酵母粉5,NaCl 10。
LB固体培养基(g/L):蛋白胨10,酵母粉5,NaCl 10,琼脂粉15~20。
TB培养基(g/L):蛋白胨12,酵母粉24,甘油5,K2HPO4·3H2O 16.43,KH2PO42.31。
以上培养基均在121 ℃,灭菌20 min后使用。
1.1.4 仪器与设备
PCR仪、Mini Protein 3蛋白胶电泳仪,美国Bio-Rad公司;DYY-6C型核酸电泳仪,北京六一电泳仪厂;台式离心机,德国Eppendorf公司;Waters高效液相色谱,美国沃特世科技有限公司;空气摇床、水浴摇床、恒温培养箱,上海知楚仪器有限公司;Agilent Polaris 3 NH2柱,美国安捷伦公司;紫外可见分光光度计,上海美谱达仪器有限公司;分析天平、pH计,瑞士梅特勒托利多有限公司;恒温水浴锅,上海森信仪器有限公司。
1.2 实验方法
1.2.1 重组菌WS9/pHY300PLK-sim的构建
以重组质粒pET-24a (+)-sim和穿梭载体pHY300PLK为模板,设计引物,将蔗糖异构酶基因sim连接到穿梭质粒pHY300PLK上,引物序列如表1所示。

表1 引物序列
重组质粒pHY300PLK-sim的构建方法为:以SI-F、SI-R为上下游引物,在重组质粒pET-24a (+)-sim上扩增出蔗糖异构酶基因sim;以ZAI-F、ZAI-R为上下游引物将穿梭载体pHY300PLK线性化;将扩增出的sim基因和线性化的载体片段胶回收后,用POE-PCR法[18]进行连接,连接产物转化克隆宿主B.subtilisSCK6,涂布于含有四环素(20 μg/L)抗性的固体平板上,在37 ℃培养箱中培养10 h,挑取重组子到LB培养基培养10~12 h后保菌提质粒,将重组质粒进行酶切和测序验证,验证正确的重组质粒即为pHY300PLK-sim。
将重组质粒pHY300PLK-sim电转B.subtilisWS9感受态,涂布于含有四环素(20 μg/L)抗性的平板上,37 ℃恒温培养箱培养10~12 h后,挑取转化子进行酶切验证,验证正确的转化子即为重组菌WS9/pHY300PLK-sim,同时将验证正确的重组菌保存在-80 ℃冰箱中。
1.2.2 重组菌的摇瓶发酵以及重组蔗糖异构酶的制备
从超低温冰箱中取出重组菌甘油管,解冻后将重组菌以0.2%(体积分数)的接种量接种到LB液体培养基中,同时在LB培养基加入0.1%(体积分数)的四环素,在37 ℃、200 r/min摇床中培养10~12 h;将培养好的LB种子液以5%(体积分数)的接种量接种到TB培养基中,同时加入0.1%(体积分数)的四环素,在37 ℃、200 r/min摇床培养2 h后,换到33 ℃、200 r/min摇床中培养48 h。培养完成的发酵菌液8 000 r/min离心20 min,离心后的发酵上清液即为蔗糖异构酶酶液。
1.2.3 蔗糖异构酶酶活力的测定方法
本研究采用3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)法[19]测定蔗糖异构酶的酶活力:用50 mmol/L、pH 6.0的柠檬酸-Na2HPO4缓冲液配制200 g/L的蔗糖溶液,吸取1.8 mL到15 mL的具塞试管中,在30 ℃水浴锅中温浴10~15 min。将酶液用缓冲液稀释一定的倍数,吸取200 μL,加入到蔗糖底物中准确反应15 min;反应结束后立刻加入3 mL的DNS溶液,沸水煮沸10 min,放在冰水上待其温度降至常温后,加入10 mL去离子水,并在540 nm波长下测定反应液的吸光度。
将DNS溶液加入不同浓度的异麦芽酮糖标准品中,煮沸显色,在540 nm波长下测定吸光值并制作标准曲线,用标准曲线将吸光值换算为异麦芽酮糖浓度。
酶活力定义:在30 ℃、pH 6.0条件下,1 min内生成1 μmol异麦芽酮糖所需要的酶量定义为1个酶活力单位(1 U)。
1.2.4 重组蔗糖异构酶的纯化
首先在蔗糖异构酶C末端加6个连续的组氨酸(His标签),然后用镍离子亲和层析柱对重组蔗糖异构酶进行纯化。
A液(mol/L):NaCl 0.5,Tris-HCl 0.025,调节pH值至7.4。
B液(mol/L):NaCl 0.5,Tris-HCl 0.025,咪唑0.3,调节pH值至7.4。
首先用100 mL的A液平衡镍柱,然后将粗酶液缓慢流过镍柱,之后用0%、5%、10%、20%、30%、50%、100%体积分数的B液(50~100 mL)依次流过镍柱,收集流出液,将流出液进行SDS-PAGE分析,确定重组酶的最适洗脱浓度。使用30 kDa的超滤管对最适浓度洗脱液进行超滤,浓缩至洗脱液剩余800 μL左右时,继续加入10~15 mL的50 mmol/L、pH 6.0的柠檬酸- Na2HPO4缓冲液置换洗脱液中的咪唑,用缓冲液反复超滤3~4次,最后得到的酶液即为纯化后的蔗糖异构酶。
1.2.5 重组蔗糖异构酶的酶学性质测定
最适pH:配制50 mmol/L,pH值分别为4.0、5.0、5.5、6.0、6.5、7.0、8.0的柠檬酸- Na2HPO4缓冲液,用不同pH的缓冲液配制200 g/L的蔗糖溶液,并用不同pH的缓冲液将蔗糖异构酶稀释一定倍数后测定酶活力。
pH稳定性:用50 mmol/L,pH值分别为4.0、5.0、6.0、7.0、8.0的柠檬酸- Na2HPO4缓冲液将蔗糖异构酶稀释合适的倍数后置于25 ℃水浴锅中,放置24 h后测定其剩余酶活力。
最适温度:以pH 6.0、200 g/L的蔗糖溶液为底物,将底物分别放在20、25、30、35、40、45 ℃的水浴锅中温浴10 min,然后将酶液加入不同温度的底物溶液中测定酶活力。
温度稳定性:将重组蔗糖异构酶置于45 ℃的水浴锅中,定时取样,并测定酶活力,研究蔗糖异构酶的温度稳定性并确定半衰期。半衰期为酶活力降为最高酶活力一半时所用时间。
以上酶学性质均设定最高酶活力为100%,其余酶活力与最高酶活力的比值即为相对酶活力。
1.2.6 重组蔗糖异构酶制备异麦芽酮糖的反应条件优化
加酶量优化:将重组蔗糖异构酶分别以5~30 U/g(每5 U/g设置一个梯度)的加酶量加入到pH 6.0、200 g/L的蔗糖溶液中,在30 ℃、150 r/min的水浴摇床中反应10 h,HPLC法检测各糖含量并计算异麦芽酮糖产率。
温度优化:配制pH 6.0、200 g/L的蔗糖底物,加酶量为20 U/g,将反应体系在25~45 ℃(每5 ℃设置一个梯度)、150 r/min反应10 h,HPLC法检测各糖含量并计算异麦芽酮糖产率。
底物蔗糖浓度优化:以pH 6.0的柠檬酸- Na2HPO4溶液配制终质量浓度分别100~700 g/L(每100 g/L设置一个梯度)的蔗糖溶液,加酶量为20 U/g,将反应体系在30 ℃、150 r/min条件下反应10 h,HPLC法检测各糖含量并计算异麦芽酮糖产率。
1.2.7 异麦芽酮糖含量的检测
将酶转化结束的样品高温煮沸20 min,12 000 r/min离心3 min,取离心后的上清液稀释一定倍数,之后用0.22 μm的水相滤头过滤,最后用Waters高效液相色谱仪检测样品中各组分含量。
采用示差折光检测器(refractive index detector,RID),色谱柱为Agilent公司、Polaris 3 NH2(150 mm×4.6 mm),流动相为80%(体积分数)的乙腈,柱温40 ℃,流速0.8 mL/min,进样量10 μL。
异麦芽酮糖产率的计算如公式(1)所示:
(1)
2 结果与分析
2.1 蔗糖异构酶在B.subtilis中的表达与纯化
按1.2.1节所示方法,获得重组菌B.subtilisWS9/pHY300PLK-sim,将重组菌摇瓶发酵48 h,测得发酵上清液中蔗糖异构酶的酶活力为9.51 U/mL,然后按1.2.4节所示方法,将重组蔗糖异构酶纯化,将纯化后的蔗糖异构酶、重组菌发酵上清液和对照菌发酵上清液进行SDS-PAGE分析。蔗糖异构酶理论分子质量为65.7 kDa[10],如图1所示,泳道1和2都在理论分子质量附近有清晰的蛋白条带,对照菌在理论分子质量附近没有相应的条带,表明蔗糖异构酶成功在B.subtilis中重组表达,且重组蔗糖异构酶达到电泳纯级别。
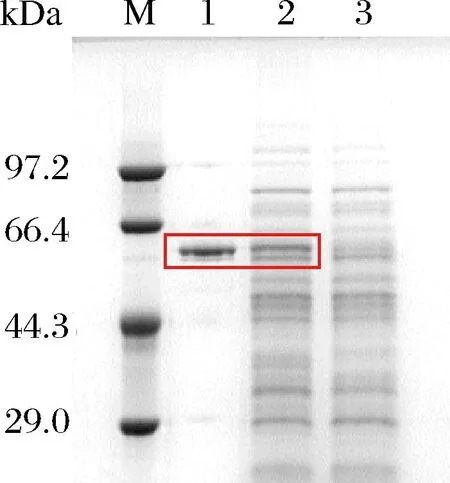
M-蛋白质低分子质量标准Marker;泳道1、2、3分别为纯化后的蔗糖异构酶、重组菌发酵上清液、对照菌发酵上清液
2.2 重组蔗糖异构酶的酶学性质
2.2.1 重组蔗糖异构酶的最适pH
pH是影响酶活力的重要因素之一。一方面pH通过影响酶活性中心相关基团的解离状态影响酶的催化活性;另一方面pH会影响底物的解离状态,继而影响酶与底物的结合与催化能力。将蔗糖异构酶放在pH值为4.0~8.0的条件下测定酶活力,如图2所示,当pH 4.0时酶活力只有10.50%,随着pH的增加酶活力逐渐提高,pH 6.0时,蔗糖异构酶的酶活力达到最高,pH>6.0之后,酶活力开始下降,pH值在5.5~7.0,蔗糖异构酶能保留80%以上的酶活力;pH偏酸或偏碱酶活性损失较大。
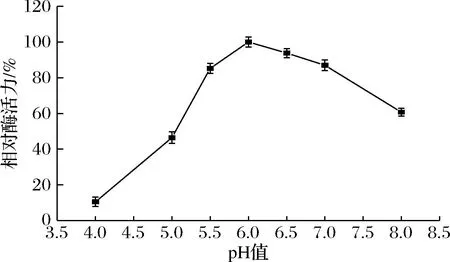
图2 重组蔗糖异构酶的最适pH值
2.2.2 重组蔗糖异构酶的pH稳定性
pH稳定性用酶分子在某一pH条件下放置一段时间后的剩余酶活力来衡量。将重组蔗糖异构酶用不同pH的缓冲液稀释一定倍数,在25 ℃水浴锅中静置24 h后,测其剩余酶活力。如图3所示,重组蔗糖异构酶在pH 4.0的缓冲液中放置24 h后酶活力只剩16.36%,在pH 6.0的缓冲液放置24 h酶活力基本不变,说明该蔗糖异构酶在pH 6.0的条件下稳定性最好;在pH 5.0~8.0的环境中放置24 h后酶活性皆能保留80%以上,说明该酶在较宽pH范围内稳定性良好。
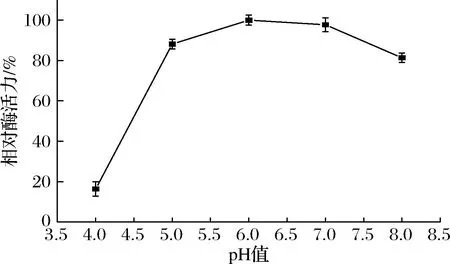
图3 重组蔗糖异构酶的pH稳定性
2.2.3 重组蔗糖异构酶的最适温度
温度对酶活力有着显著的影响。一方面温度升高,底物中活化分子数量增加,加快酶反应速率;另一方面,温度升高伴随着酶逐渐变性,2种因素共同影响了酶的反应速率。将重组蔗糖异构酶在20~45 ℃下测定酶活力,结果如图4所示。随着温度的升高,酶活力逐渐提高,30 ℃时,酶活力达到最高,随着温度的继续升高,蛋白变性对酶活力的影响超过了反应速率对酶活力的影响,酶活力开始下降。因此重组蔗糖异构酶的最适温度为30 ℃。

图4 重组蔗糖异构酶的最适温度
2.2.4 重组蔗糖异构酶的温度稳定性
将重组蔗糖异构酶置于45 ℃的水浴锅中静置处理,每隔20 min取1次样并测定酶活力。如图5所示,随着处理时间的增加,重组酶的酶活力逐渐下降,在60 min时,重组酶的酶活力保留率为60.53%,在80 min时酶活力仅剩37.56%,重组酶在45 ℃下的半衰期为68 min。
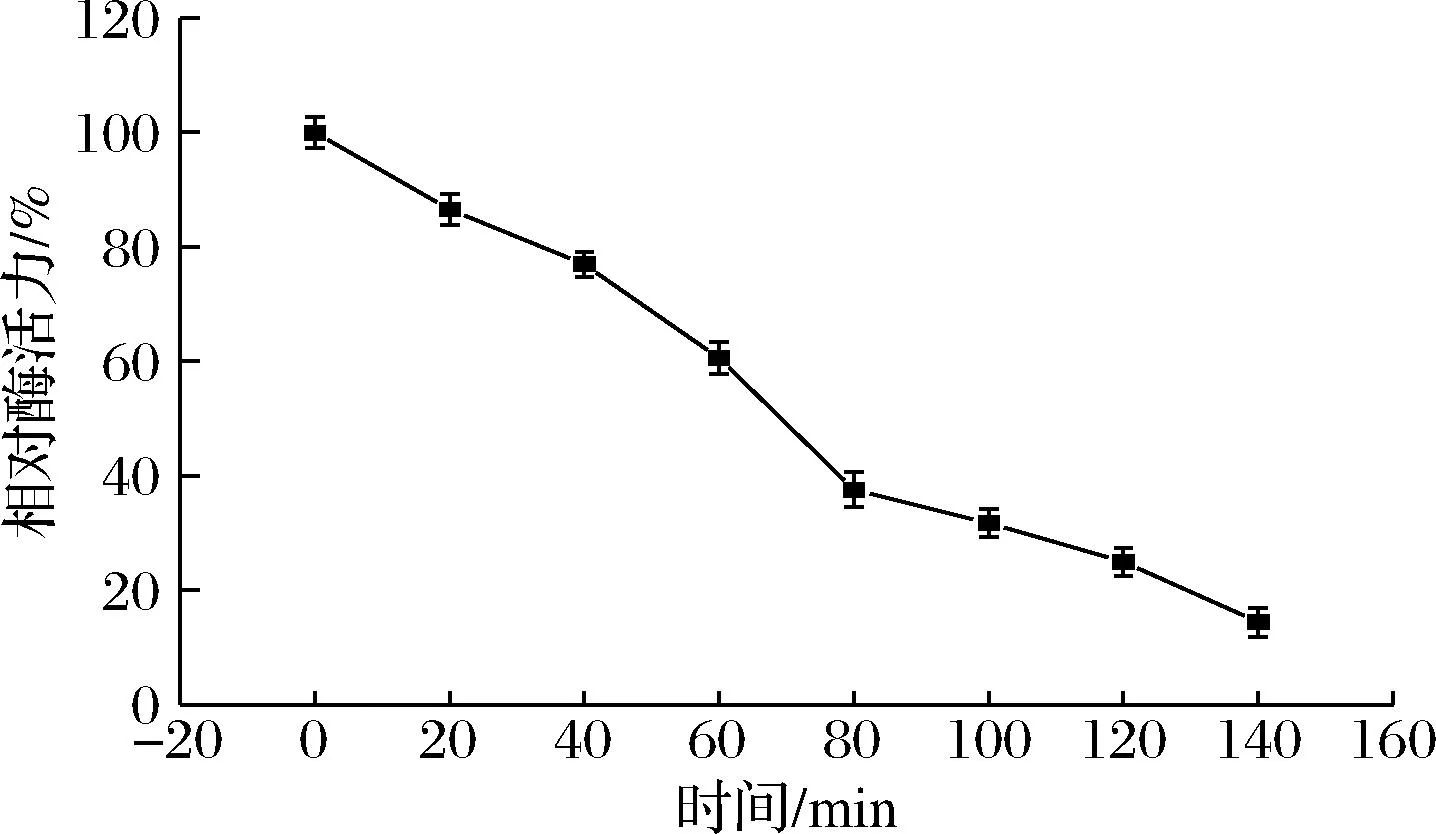
图5 重组蔗糖异构酶的温度稳定性
2.3 酶转化制备异麦芽酮糖的转化条件优化
2.3.1 加酶量对异麦芽酮糖产率的影响
将重组蔗糖异构酶按不同加酶量(5~30 U/g)加入pH 6.0、200 g/L的蔗糖底物中,在30 ℃下转化10 h。结果如图6所示,随着加酶量的增加,异麦芽酮糖产率逐渐升高,加酶量为20 U/g时,异麦芽酮糖产率达到最高83.17%,随着加酶量的进一步提高,异麦芽酮糖产率反而下降,推测原因与蔗糖异构酶的催化特性有关:蔗糖异构酶除了将蔗糖异构为异麦芽酮糖,同时还将蔗糖水解为葡萄糖和果糖,当加酶量超过20 U/g时,生成异麦芽酮糖的异构反应基本到达平衡状态,而蔗糖异构酶的水解反应会继续消耗蔗糖导致用于异构为异麦芽酮糖的蔗糖量减少,所以异麦芽酮糖产率下降。因此制备异麦芽酮糖的最适加酶量为20 U/g。
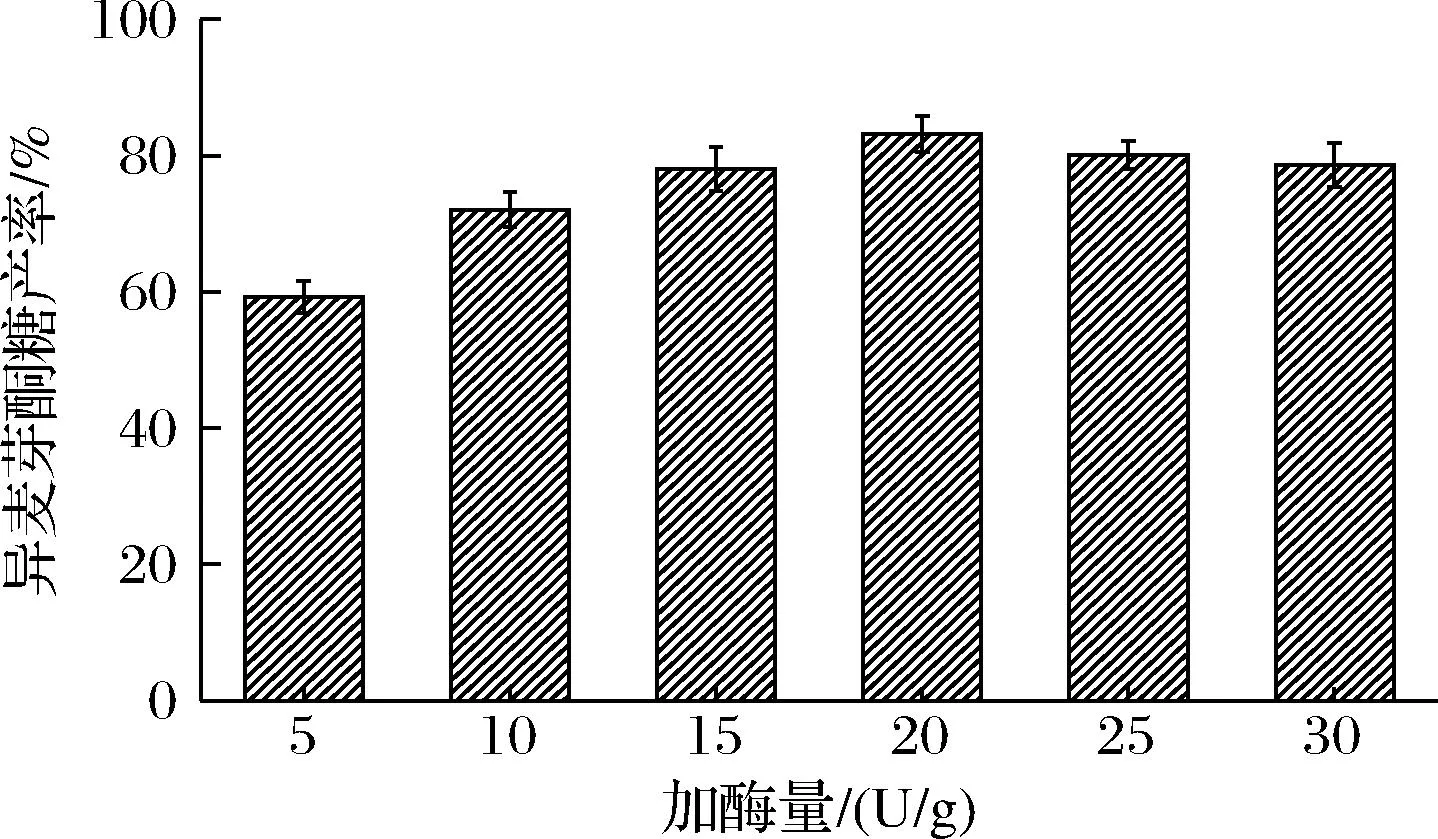
图6 加酶量对异麦芽酮糖产率的影响
2.3.2 反应温度对异麦芽酮糖产率的影响
反应温度对异麦芽酮糖产率的影响体现在2个方面:一是温度会显著影响酶的催化活力和稳定性;二是温度影响着蔗糖异构酶异构反应和水解反应的平衡性,温度较低时蔗糖异构酶的水解反应较弱,但有利于海藻酮糖生成,温度较高时,海藻酮糖的生成受到抑制,但蔗糖异构酶的水解能力会增强[10,20]。因此,合适的温度有利于异麦芽酮糖的生产。以pH 6.0、200 g/L的蔗糖溶液为底物,加酶量为20 U/g,将反应体系分别在20~45 ℃条件下反应10 h,结果如图7所示。随着温度的升高,异麦芽酮糖产率逐渐升高,到30 ℃时,异麦芽酮糖产率最高为83.17%,虽然在20 ℃和25 ℃下异麦芽酮糖产率与30 ℃时产率相近,但低温更有利于海藻酮糖的产生,而35 ℃下异麦芽酮糖产率下降到80.32%,综上制备异麦芽酮糖的最适温度为30 ℃。

图7 反应温度对异麦芽酮糖产率的影响
2.3.3 底物浓度对异麦芽酮糖产率的影响
以pH 6.0、100~700 g/L(梯度为100 g/L)的蔗糖溶液为底物,加酶量为20 U/g,在30 ℃下转化10 h,结果如图8所示。随着蔗糖浓度的升高,异麦芽酮糖产率逐渐升高,当蔗糖质量浓度为400 g/L时,产率最高可到90.61%,当继续采用更高质量浓度的蔗糖(500、600、700 g/L)进行酶转化时,异麦芽酮糖产率基本持平且可以维持在89.20%左右。因此,虽然底物质量浓度为400 g/L时异麦芽酮糖产率最高,但采用700 g/L的蔗糖进行酶转化能获得异麦芽酮糖产量更高,且此时几乎没有蔗糖残留,能更好地降低生产成本,因此更适合工业化制备异麦芽酮糖的蔗糖质量浓度为700 g/L。

图8 底物浓度对异麦芽酮糖产率的影响
3 结论与讨论
本研究将P.dispersaUQ68J蔗糖异构酶在B.subtilis中重组表达,对重组蔗糖异构酶进行纯化并研究其酶学性质,结果表明,该重组酶在30 ℃、pH 6.0的条件下酶活力最高,在pH 5.0~8.0的条件下稳定性良好。用该重组酶制备异麦芽酮糖,以pH 6.0、400 g/L的蔗糖为底物,加酶量为20 U/g,在30 ℃下转化10 h时,异麦芽酮糖产率最高可达90.61%,采用更高质量浓度的蔗糖(700 g/L)转化时异麦芽酮糖产率仍可达89.20%,实现了酶法制备异麦芽酮糖高产率。
LI等[8]将E.rhaponticiNX-5蔗糖异构酶在大肠杆菌中重组表达后制备异麦芽酮糖,蔗糖质量浓度为550 g/L时,异麦芽酮糖产率为87%;程胜等[9]将S.plymuthicaAS9蔗糖异构酶在大肠杆菌中重组表达后制备异麦芽酮糖,蔗糖质量浓度400 g/L时异麦芽酮糖产率达到最大(87.9%),而蔗糖质量浓度提高到500 g/L时异麦芽酮糖产率下降到83.2%;耿梦华等[21]将短小芽胞杆菌表达的重组蔗糖异构酶固定化后制备异麦芽酮糖,在600 g/L蔗糖质量浓度下异麦芽酮糖产率可达87.8%;相较于其他微生物来源的蔗糖异构酶,本研究得到的重组蔗糖异构酶安全性好,在高底物浓度下高异麦芽酮糖产率更高,工业应用潜力巨大。综上所述,本研究提供了一种优秀的重组蔗糖异构酶和简单高效的酶转化工艺,为异麦芽酮糖的工业化生产奠定了坚实的基础。