利用InDel分子标记鉴定杂交籼稻中籼粳交杂株
潘伟芹,马卉,许学,鲍翔宇,麦霄黎,林玲,吴爽,汪秀峰
(安徽省农业科学院水稻研究所,合肥 230031)
0 引言
水稻是中国主要粮食作物,杂种优势在水稻中的利用大幅度地提高了单产水平,有力地保障了国家粮食安全。目前中国杂交水稻主要是利用“两系法”与“三系法”培育而成[1],杂交水稻在制种过程中,环境温度的改变、外来花粉造成的生物学混杂和机械混杂会导致杂交稻种子纯度降低[2],直接影响了杂交稻的品质与产量[3]。若在制种过程中,籼型不育系接受了外来的粳稻花粉,产生的F1因杂交不亲和而在田间种植时表现为大青棵,反之亦然。大青棵分蘖力强、生长繁茂,在与正常杂交稻竞争中占较大的优势,影响周边植株正常生长。正季长日高温下,它的营养生育期一般较长,抽穗迟,甚至不能抽穗,进而不能正常成熟、结实,从而造成产量损失[4-5]。此外,大青棵在田间很扎眼,即使只有1‰也会影响种子的推广。
目前,杂交水稻纯度鉴定主要是依靠在海南进行田间种植,通过对水稻全生育期进程的农艺性状观察、比对,以鉴别F1及杂株[6]。该方法不仅鉴定费用高、周期长、时效性低[7];更重要的是海南短日照高温的气候使育性和生育期等发生变化,从而引起鉴定结果产生偏差[8]。例如正季表现为不能抽穗的大青棵单株在海南却能够正常抽穗结实,所以很难被准确地鉴定[9]。因此,建立快速准确的杂交稻种子纯度检测及籼粳交杂株鉴定的分子检测体系,不仅可以预估杂交稻种子纯度和预判杂株类型,而且可以及时发现生产制种环节中的问题从而指导制种生产,同时对配组亲本的选择也提供参考。
SSR(Simple Sequence Repeats,简单重复序列)因其具有数量丰富、重复性好、多态性高、遗传上呈共显性、实验操作简单、结果稳定可靠等优点而被广泛用于主要农作物真实性与纯度的辅助鉴定[10-12]。虽然有学者将SSR 标记用于水稻籼粳分化的研究[13-14],但是研究所用SSR 标记数量较多,工作量大,耗时、耗力,且该部分标记并非籼、粳特异性标记,不具有广适性。随着SHEN等[15]完成粳稻日本晴与籼稻9311全基因组测序,建立包含479 406 个InDel(Insetion/Deletions)数据库,并证实了InDel 标记在籼、粳亚种间具有多态性,从此InDel标记开始越来越多地被应用于水稻籼粳分化属性的判定、亲缘关系、杂种优势的预测[16-18]。蔡星星等[19]开发出45 对InDel 标记,可准确地对92 份水稻进行籼粳属性的界定。LU等[20]进一步研究发现34个InDel 位点与籼、粳遗传分化密切相关,并针对水稻籼粳属性判定提出了“InDel 分子指数法”。王林友等[21]利用19对InDel标记准确地鉴别出48份籼稻、粳稻以及中间型材料的籼粳属性,与程式指数法的结果完全一致。以上研究说明InDel标记用于水稻籼粳鉴定是完全可行的。目前关于大青棵产生的分子水平的研究较少,亦未见InDel 分子标记用于籼粳交杂株分子鉴定的报道。
本研究以三系杂交稻粤泰A/R2020 为研究对象,利用亲本间22 对多态性SSR 标记对田间的疑似杂株进行基因型分析,同时利用筛选出的适用于本组合的13对InDel标记对8株杂株进行串粉来源分析,为指导杂交水稻制种技术以提高种子纯度和亲本选择提供理论支撑。
1 材料与方法
1.1 试验材料
粤泰A/R2020是本单位小面积试制的红莲型杂交稻,粤泰A/R2020的F1和双亲、8株田间表型鉴定为大青棵的杂株以及23 份典型籼稻(‘9311’、‘桂99’、‘恒丰A’、‘粤泰A’、‘荃9311A’、‘粤禾丝苗’、‘五山丝苗’、‘盛泰A’、‘华占’、‘粤农丝苗’)和粳稻(‘日本晴’、‘辽粳1415’、‘云粳30号’、‘盐粳172’、‘武育粳3号’、‘郑稻CB26’、‘南农6427’、‘连粳9823’、‘泰粳4366’、‘南粳53015’、‘秀水42’)以及籼粳交杂交稻(‘嘉优中科1号’、‘甬优1540’)均由安徽省农业科学院水稻研究所提供。
1.2 田间鉴定
粤泰A/R2020 于2021 年5 月10 日在合肥市岗集基地播种。6 月3 日单苗移栽,种植500 株,栽插密度为16.7 cm×26.7 cm,田间管理基本同常规方法,化肥、除草剂减量使用。在整个生长阶段观察每个单株的表型,在抽穗期或成熟期取疑似杂株的叶片用于分子检测。
1.3 室内检测
1.3.1 亲本间多态性标记筛选DNA的制备、引物序列参照行业标准《水稻品种鉴定技术规程SSR 标记法》(NY/T 1433—2014)。PCR 扩增采用10 µL 体系:25 mmol/LMgCl21µL,10µmol/L上、下游引物各0.5µL,5×PCR缓冲液2µL,2.5 mmol/L dNTPs混合溶液1µL,20 ng/µL DNA溶液2µL。PCR扩增程序:94℃预变性4 min;94℃变性45 s,55℃退火45 s,72℃延伸60 s,共进行30 次循环;72℃延伸8 min;4℃保存。PCR 产物采用3730 DNA 分析仪进行电泳;电泳程序:预电泳15 kV,3 min,1.6 kV电压上样15 s,15 kV电压运行26 min,Data Collection收集原始数据。GeneMapper软件对原始数据进行分析并记录两个亲本在48 对标记下的片段大小。
1.3.2 疑似杂株SSR 真实性检测剪取F1以及田间疑似杂株1 cm 左右叶片。采用CTAB 法提取水稻基因组DNA,Nanodrop2000 核酸检测仪检测DNA 样品浓度和质量,统一将样品稀释至20 ng/µL 左右的终浓度,-20℃保存,备用。采用1.3.1筛选得到的22对多态性标记对F1及杂株进行PCR 扩增,PCR 反应体系、程序同1.3.1。扩增产物采用10%非变性聚丙烯酰胺胶进行电泳;电泳条件:电压180 V,电流80 mA,时间1 h,电泳结束后银染。制胶及银染操作参照行业标准《水稻品种鉴定技术规程SSR 标记法》(NY/T 1433-2014)进行,银染结束后拍照,统计疑似杂株在每对标记下的带型。
1.3.3 籼粳特异性InDel 标记筛选验证利用已公开的InDel标记[19-21]对本实验保存的23份籼稻、粳稻以及籼粳杂交稻的籼粳属性进行筛选验证。PCR 扩增采用10µL体系:25 mmol/L MgCl21µL,10µmol/L上、下游引物各0.5µL,5×PCR缓冲液2µL,2.5 mmol/L dNTPs混合溶液1µL,20 ng/µL DNA溶液2µL。PCR扩增程序:94℃预变性5 min;94℃变性30 s,58℃退火30 s,72℃延伸40 s,共进行35次循环;72℃延伸10 min;4℃保存。PCR产物用3%琼脂糖凝胶电泳检测。
1.3.4 籼粳交杂株的分子鉴定选取1.3.3 中扩增条带清晰且能明显区分籼粳类型的18 对InDel 引物(表1)对父本、母本、F1及疑似杂株的籼粳属性进行鉴定。PCR反应体系、程序等同于1.3.3。

表1 用于水稻籼粳属性鉴定的InDel引物信息
2 结果与分析
2.1 亲本间多态性标记筛选
母本‘粤泰A’与父本‘R2020’在3730 DNA 分析仪毛细管电泳检测的结果见表2:父本与母本在16 个标记下的扩增片段大小一致,10个标记下父本与母本片段大小差异小于5 bp(片段差异过小,PAGE胶上不易判读结果),22个标记下扩增片段差值在6~51 bp之间,可用于该组合的真实性和纯度鉴定(图1)。
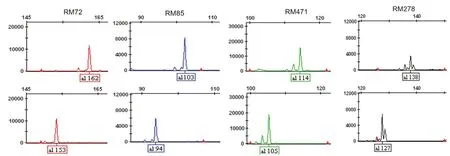
图1 部分多态性引物PCR产物3730电泳图谱
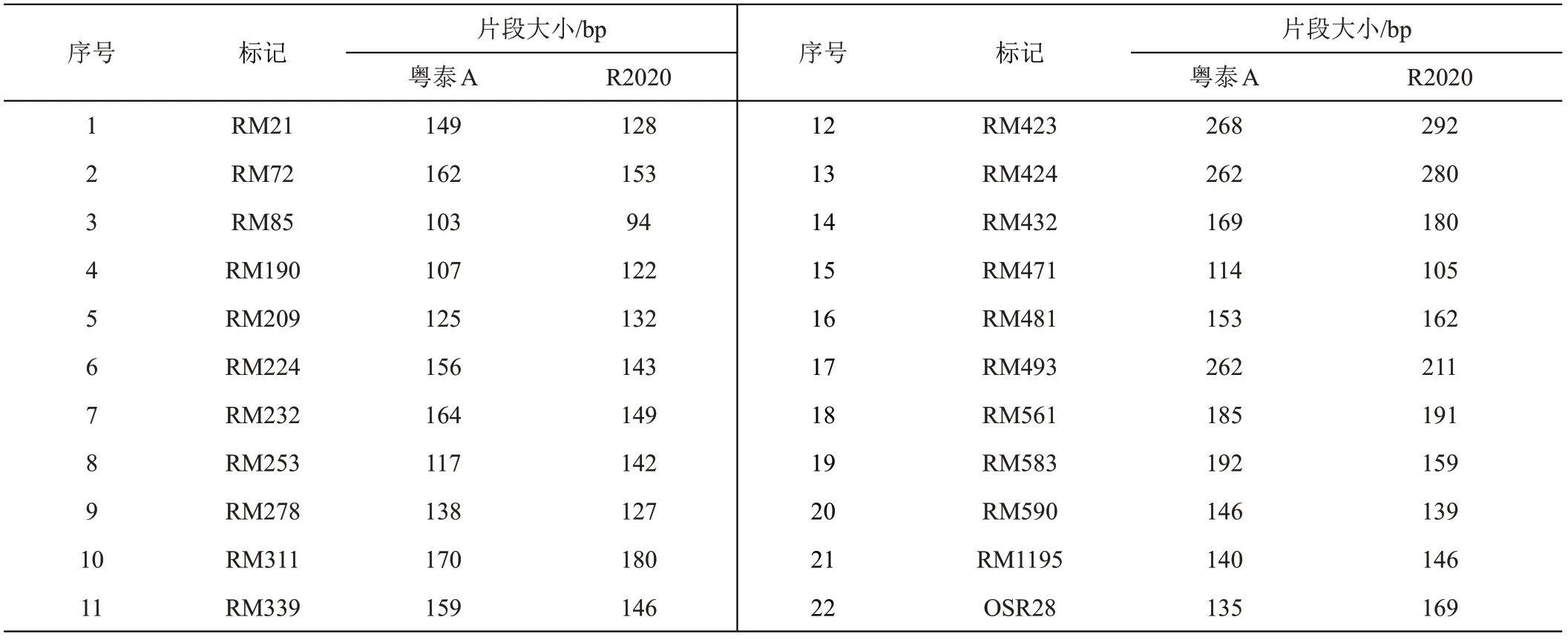
表2 亲本间多态性引物及PCR扩增产物大小
2.2 疑似杂株SSR标记分子检测
8 个杂株在22 对标记下有3 种带型:母本带型、F1带型、串粉带型(母本带+非父本带)。从表3可以看出22对标记中,8对标记检测出杂株1-5为串粉带型,9对标记检测出杂株6为串粉带型,11对标记检测出杂株7为串粉带型,10对标记检测出杂株8为串粉带型;8个杂株在3对标记(RM278、RM493、OSR28)下均为F1带型(图2A),6 对标记(RM72、RM85、RM224、RM253、RM424、RM481)下均为串粉带型(图2B),以上结果证明了8个杂株均为串粉株。

图2 疑似杂株的SSR标记电泳图(部分)

表3 疑似杂株的SSR标记真实性鉴定
2.3 籼粳特异性InDel标记的筛选
利用本实验室保存的籼稻、粳稻以及籼粳杂交稻等23份水稻品种进行InDel标记筛选,其中有18对引物如R2M10标记能较好的扩增出籼稻特带异、粳稻特异带以及籼-粳交杂合带(图3),可用于下一步研究。

图3 InDel标记R2M10在籼稻、粳稻以及籼粳杂交稻中PCR扩增电泳图
2.4 籼粳交杂株分子鉴定
利用筛选到的18 对InDel 标记对亲本、F1及疑似杂株进行籼粳属性的鉴定,母本‘粤泰A’均为籼稻特异带,其籼型基因频率为1,为典型籼稻。父本‘R2020’在R1M37、R2M50、R6M44、R9M42等标记下为粳稻特异带,粳稻基因频率为0.22,籼型基因频率0.78,表明‘R2020’是一个以籼稻为背景掺有少量粳稻血缘的恢复系;在R6M14标记下6号杂株表现为籼稻纯合带型(图4B),因此这5 个标记不适于粤泰A/R2020 中杂株的籼粳属性判定。初步筛选出13对特异性的InDel标记用于杂株的籼粳属性判定:R1M7、R2M10、R3M10、R3M53、R4M17、R5M13、R5M30、R7M7、R7M37、R8M33、R10M17、R11M23、R12M27。
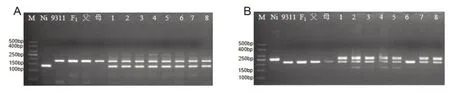
图4 串粉株在R2M10标记(A)、R6M14标记(B)PCR扩增电泳图
3 讨论
3.1 提高杂交水稻纯度鉴定准确性的途径
SSR标记检测主要基于串联重复序列重复次数差异进行的DNA水平的检测,结果稳定、重复性好;而田间鉴定是根据植株表型差异来判定,表型受基因与环境共同影响,田间情况复杂,病害、自然环境条件以及技术人员经验差异都可能会导致室内检测与田间结果的产生差异[22-23]。赵虹等[24]认为单个引物纯度鉴定时,利用每个品种特异性SSR 标记才能检测出混杂的相近品种;彭锁堂等[25]用引物RM17 对‘汕优63’、‘两优培九’的室内纯度检测,其结果与田间结果一致。本研究中8 株疑似杂株在RM72、RM85、RM224、RM253、RM424、RM481 等标记下均表现为串粉带型(图2B),这些标记可以区分F1与串粉株。然而,研究者发现部分田间异株在室内纯度鉴定时未被检出。例如陈荣林等[26]发现RM17可快速鉴定‘桂两优2号’种子纯度,但是田间表现为变异株的个体未能检出;王立广等[27]通过对‘荃两优2118’纯度检测,发现SSR标记对串粉混杂和变异株较难区分;廖芳丽等[28]发现田间的异形株被多个标记都判为正常株。本研究也有8 个杂株在RM278、RM493、OSR28 等标记下表现F1带型而未被检出的现象(图2A);因为串粉杂株在这些引物标记下基因型与父本恢复系基因型相同而无法检测出,此类标记不能区分真实的F1与串粉杂株,导致室内鉴定结果偏高,这与朱国奇等[2]研究结果一致。宗凯等[29]利用不同引物对同一样品进行纯度鉴定时,结果存在差异,进而提出为控制误差,宜用多对引物同时进行实验;赵虹等[30]亦通过田间鉴定与室内多引物检测结果比对发现纯度低样品应采用多对引物鉴定,否则差异较大。本研究中表3可以看出,不同引物鉴别能力不同,多对引物可提高杂株检测率。所以在进行杂交稻纯度鉴定时,若对亲本稳定性、田间制种环境、收获运输过程的机械混杂类型等不了解,可选取选择合适的、多对引物,以降低误差,提高室内分子检测准确率。
3.2 水稻籼粳交杂株类型的鉴定
杂交稻制种过程中,如果制种基地附近为粳稻种植区,难以避免粳稻花粉窜入而产生籼粳交杂株,所以在杂交水稻室内分子纯度检测中,有必要对来源于籼粳混栽区的杂交种中检出的串粉株再进行籼粳属性鉴定,从而发现制种生产过程中存在的问题,避免籼粳交杂株的产生。张馨月[31]利用广亲和基因S5-n的功能标记对籼粳交亚种间组合进行鉴定,但方法具有一定的局限性,仅适用于父本与母本仅一方具有广亲和基因的配组方式。桂君梅等[32]证实了InDel 分子标记对判定参试组合是属于粳粳杂交稻,还是属于籼粳杂交稻是十分有效的。本研究从18对InDel分子标记中成功筛选出13对InDel标记可用于粤泰A/R2020组合中杂株的籼粳属性的鉴定。结果显示8株大青棵均来源于粳稻花粉混入到制种田的籼型不育系柱头上并能正常受精结实,这与制种田附近种植有常规粳稻相吻合,与RM72、RM85、RM224、RM253、RM424、RM481等SSR标记下表现为串粉带型结果也一致,说明InDel 分子标记用于水稻籼粳属性鉴定的准确性、可靠性。杂交稻制种时为避免籼粳交类大青棵的产生,应选择无粳稻种植的区域或远离粳稻种植区作为制种基地、花期尽可能错开。如果以上条件达不到就必须采用屏障隔离或在基地四周栽插父本等措施以减少粳稻的影响。通过本研究可推测杂交稻亲本选择时,如果双亲在以上InDel位点上存在差异就有可能产生大青棵。由于本研究只调查了粤泰A/R2020 这个组合,结果存在较大的局限性,还需要进一步研究以筛选出更精准和广适的分子标记。
4 结论
本研究将田间表型与室内分子检测相结合,增加室内检测结果准确性。筛选得到的13对InDel标记用于田间大青棵籼粳属性的验证,证实了粳稻花粉的窜入是产生大青棵的分子证据,从而对制种基地的选择和隔离措施都提出了更高的要求,也为亲本的选择提供分子依据。

