四种臭椿不同叶位叶片色素组成及分布变化
郑聪慧,徐振华,王玉忠,张蔓蔓,杜克久,李向军,刘春鹏
(1河北省林业和草原科学研究院,河北省林木良种技术创新中心,石家庄 050061;2河北农业大学林学院,河北保定 071001)
0 引言
彩叶植物在城市园林绿化中的应用越来越广泛,挖掘彩叶植物资源和选育彩叶植物品种具有重要的意义。彩叶植物不同品种(系)、不同叶位(叶龄)间的叶色常常存在差异。植物叶片色素种类和含量、叶绿体发育程度、叶片表皮结构、叶片细胞间空隙等因素均与叶色有关[1-4],其中色素是叶色的内在决定物质。高等植物叶片色素主要分为3类,包括类黄酮类(以花色素苷类为主)、类胡萝卜素类和叶绿素类[5]。为了合理应用和配置景观树木,有必要研究园林树种不同叶位叶色变化规律,解析叶片呈色化学基础和叶色调控机制[6]。已有学者对金叶榆(Ulmuspumila‘Jinye’)、紫叶紫薇(Lagerstroemiaindica)、金叶女贞(Ligustrum vicaryi)、金叶连翘(Forsythiakoreana‘Sun Gold’)等彩叶植物进行了相关研究[7-10]。
臭椿(Ailanthusaltissima(Mill) Swingle)原产于中国,是中国北方地区常见的乡土树种,全株可利用,抗逆性强。国内外对臭椿的研究多集中在繁育技术、药用价值、叶片表面结构特征、花器官分化发育等方面[11]。近年来,中国学者选育得到几个观果和观叶的新品种。其中,‘朝阳椿’、‘千红椿’为臭椿观叶新品种,前者春季嫩叶为橘红色、后渐变为杏黄色、叶片成熟后为黄绿色,后者春季嫩叶为紫红色、后渐变为棕褐色、叶片成熟后为深绿色;‘聊红椿’为臭椿观果新品种,红色果皮是其最显著的特征,同时其枝叶颜色亦异于‘普通臭椿’,春季嫩叶为红棕色,后渐变为绿棕色,叶片成熟后为深绿色;‘普通臭椿’相对而言叶色变化较小,嫩叶为黄棕色,后转为深绿色。徐卉[12]对‘红果臭椿’果实呈色机理进行了报道。有关臭椿叶色表现和呈色机理尚未见研究。本研究以上述4种臭椿为研究对象,分叶位测定了叶片色素含量、叶色参数,观察了叶片显微结构及主要呈色色素的分布位置,分析了上述指标随品种、叶位的变化规律,为探讨臭椿叶色变异机制奠定基础。
1 材料与方法
1.1 材料及取样
4种叶色的一年生臭椿苗木:‘朝阳椿’、‘千红椿’、‘聊红椿’和‘普通臭椿’均来自河北省林业和草原科学研究院臭椿种质资源圃(见图1)。2021年7月,各种臭椿分别随机选取5 株树木,每株树木选定一个当年生向阳枝条,于顶梢部开始、由上而下依次选取5个存在叶色明显转换的叶位进行叶片采集。其中,叶位1、2为位于枝条顶部的未舒展的幼叶,叶位3 为位于枝条中上部的部分舒展的叶片,叶位4、5 为位于枝条中部的完全舒展的健康功能叶片。4 种臭椿5 个叶位叶片的上表面颜色描述见表1。将同种臭椿5 株树木相同叶位的叶片进行混合,一部分用于叶片显微结构及颜色的观察,另一部分置于-40℃冰箱中保存待测。

表1 叶片颜色描述

图1 四种臭椿一年生苗木外观
1.2 色素含量及比值的测算
1.2.1 叶绿素和类胡萝卜素对不同品种臭椿,分叶位各称取采集的叶片0.2 g,磨成匀浆后用80%丙酮定容至20 mL,4000 r/min离心15 min,取上清液,以80%丙酮为空白对照,用TU-1901 型双光束紫外分光光度计在波长470、645、663 nm 下测定吸光度值,根据冯露等[13]的公式计算叶绿素a(Chla)、叶绿素b(Chlb)、总叶绿素(Chl)及类胡萝卜素(Car)的含量(单位均为“mg/g”)。以上测定均重复9次。
《自然》近日发表的一项研究称,全球变暖可能会导致“海洋热浪”(即海洋表面长时间的反常高温)的发生频次更高、袭击范围更广、强度更大。研究人员指出,1982年至2016年期间,海洋热浪天数增加了1倍。
图2 显示各个叶色参数随臭椿品种和叶位的变化。同一品种,亮度L*值、黄蓝属性色相b*值与彩度C*值随叶位的变化趋势基本相同,‘朝阳椿’不同叶位的L*、b*、C*值均差异显著(P<0.05,均以叶位4 最大),另外3 种臭椿的L*、b*、C*值随叶位的变化多不显著(P>0.05);‘朝阳椿’、‘千红椿’、‘聊红椿’的红绿属性色相a*值均随叶位下降而显著减少(P<0.05,均以叶位1最大),‘普通臭椿’的a*值随叶位的变化不显著(P>0.05)。同一叶位,4 种臭椿的L*、b*、C*值均存在显著差异(P<0.05),各叶位L*、b*、C*值多以‘朝阳椿’最大、‘千红椿’较小;4种臭椿的a*值,在叶位1时差异显著(P<0.05),在其余叶位时差异不显著(P>0.05),叶位1~4的a*值排序均为‘朝阳椿’>‘千红椿’>‘聊红椿’>‘普通臭椿’。
(3)凌文辁、张治灿与方俐洛通过对5000名员工的7轮预测和2000名员工的正式测验,编制出了由情感承诺、理想承诺、规范承诺、机会承诺和经济承诺五因素构成的“中国职工组织承诺量表”。该量表的总方差解释量达66.11%,相关分析也表明,各因素与效标的相关均达到非常显著水平,各因素的信度在0.7-0.89之间,量表的信度和效度良好。因为此份量表是在中国文化背景下编制的,因而对国内的研究有很大的指导意义。
1.3 叶色参数的测算
对不同品种臭椿,分叶位各取采集的叶片3个,使用便携式分光色差仪NF555(日本)测算叶色参数,包括亮度L*、红绿属性色相a*(由负变正表明由绿变红)、黄蓝属性色相b*(由负变正表明由蓝变黄)和彩度C*(由(a*2+b*2)1/2算得)[16]。每个叶片测3次,共9次重复。
1.4 叶片显微结构及颜色的观察
1.4.1 表皮对不同品种臭椿,分叶位各取叶6片,在体式显微镜SZ61(日本)和正置荧光显微镜Ni-U(日本)下,对表皮结构进行观察拍照,测量腺毛直径(GH)。各叶片选5个视野进行观测。
总之,随着社会经济水平的不断提高和科学技术的不断发展,农业在发展过程中得到了先进的科学技术的支持,农业机械化的应用得到了有效的推广,不管是农业机械设备的各项技术创新,还是对农机设备的推广渠道,都需要建立一个完善的制度,这样才能够使农业机械设备的发展得到保证,从而促进社会的和谐进步。
1.4.2 横切面对不同品种臭椿,分叶位各取叶6片,采用徒手切片法制取横截面切片[13],在正置荧光显微镜Ni-U(日本)下观察拍照。测量叶片厚度(LB)、叶肉厚度(LM)、上表皮厚度(UE)、下表皮厚度(LE)、栅栏组织厚度(PT)、海绵组织厚度(ST)等指标,计算PT:ST。各横切面选5个视野进行观测。
1.5 数据分析
使用SPSS 19.0进行数据统计和Kruskal-Wallis检验,采用Nemenyi 检验法对数据进行两两比较(P<0.05)。图表中数据为平均值±标准差。
2 结果与分析
2.1 叶片色素含量及比值
顺着叶位从上到下:‘朝阳椿’的Chl 含量渐增(P<0.05),Car 含量先增(P<0.05,叶位4 最大)后减(P>0.05),Car:Chl 先增(P>0.05,叶位2 最大)后减(P<0.05),Ant 含量和Ant:Chl 渐减(P<0.05),Chla:Chlb 先增(P<0.05,叶位4 最大)后减(P>0.05);‘千红椿’的Chl 含量渐增(P<0.05),Car 含量先增(P<0.05,叶位3最大)后减(P>0.05),Ant 含量、Car:Chl 和Ant:Chl 均渐减(P<0.05),Chla:Chlb 先增(P<0.05,第4 叶位最大)后减(P>0.05);‘聊红椿’的Chl、Car 含量渐增(P<0.05),Ant 含量、Car:Chl 和Ant:Chl 均渐减(P<0.05),Chla:Chlb 渐增(P>0.05);‘普通臭椿’的Chl、Car 含量均先增(P<0.05,第3 叶位最大)后减(P>0.05),Car:Chl 渐减(P<0.05),Ant 含量和Ant:Chl 均先减(P<0.05,第3 叶位最小)后增(P>0.05),Chla:Chlb 渐增(P>0.05)。

表2 叶片色素含量及比值的变化
相同叶位时:对于Chl 和Car 含量,‘普通臭椿’均高于‘朝阳椿’(P<0.05)、‘聊红椿’(叶位3 和4 时,P<0.05);‘普通臭椿’与‘千红椿’无显著差异。Ant 含量以‘千红椿’最高(P<0.05)、‘普通臭椿’最低(P<0.05)。就Car:Chl 而言,‘朝阳椿’高于‘普通臭椿’(P<0.05)、‘千红椿’(P<0.05)、‘聊红椿’(叶位4和5时,P<0.05),为该比值最高的品种;‘千红椿’和‘普通臭椿’差异不显著;‘聊红椿’在叶位1 和2 时显著高于‘普通臭椿’(P<0.05)。就Ant:Chl而言,‘朝阳椿’高于‘普通臭椿’(P<0.05)、‘千红椿’(P>0.05)、‘聊红椿’(叶位1~3时P<0.05),为该比值最高的品种;‘普通臭椿’低于‘聊红椿’(P>0.05)和‘千红椿’(P<0.05)。Chla:Chlb 以‘朝阳椿’最高(P<0.05),‘聊红椿’与‘普通臭椿’差异不显著,‘千红椿’仅在叶位1时显著低于‘普通臭椿’(P<0.05)、其余叶位二者均无显著差异。
由表2 可知,Chla、Chlb、Chl、Car 和Ant 含量及Car:Chl、Ant:Chl 在同一叶位不同品种间和同一品种不同叶位间均存在显著差异(P<0.05);Chla:Chlb 在同一叶位不同品种间差异显著(P<0.05),‘朝阳椿’、‘千红椿’的该值在叶位间均差异显著(P<0.05),‘普通臭椿’、‘聊红椿’的该值在叶位间均无显著差异(P>0.05)。
2.2 叶色参数
1.2.2 花青素对不同品种臭椿,分叶位各称取采集的叶片1 g,剪碎后用0.1 mol/L HCl 定容至10 mL,于32℃温箱中浸提6 h,4000 r/min 离心15 min,取上清液,以0.1 mol/L HCl为空白对照,用TU-1901型双光束紫外分光光度计在波长530 nm下读取吸光度,用吸光度值乘以10 代表花青素(Ant)的相对浓度(单位为“色素单位”)[8,14]。以上测定均重复9次。
本研究基于叶片解剖和色素测定的结果,完成了对臭椿不同品种、不同叶位叶色呈现原因的初步研究。4种臭椿叶色差异的出现与叶片表皮结构及细胞排列方式无关,色素为其叶色差异形成的决定性物质,色素种类、含量及分布为造成臭椿不同品种及叶位叶色差异的主要原因。‘聊红椿’、‘千红椿’中高含量的花青素为其叶色发红的关键色素。‘朝阳椿’上叶位高含量的花青素和各叶位低含量的总叶绿素可能为其叶片艳丽的直接原因,至于‘朝阳椿’叶片叶绿体结构及发育程度对叶色的影响需通过进一步研究来加以确定。4 种臭椿中,‘朝阳椿’的亮度、黄色度、彩度观赏性最显著,且以叶位4、5 时最佳;‘朝阳椿’、‘千红椿’的红色度观赏性较显著,均以叶位1时最佳。
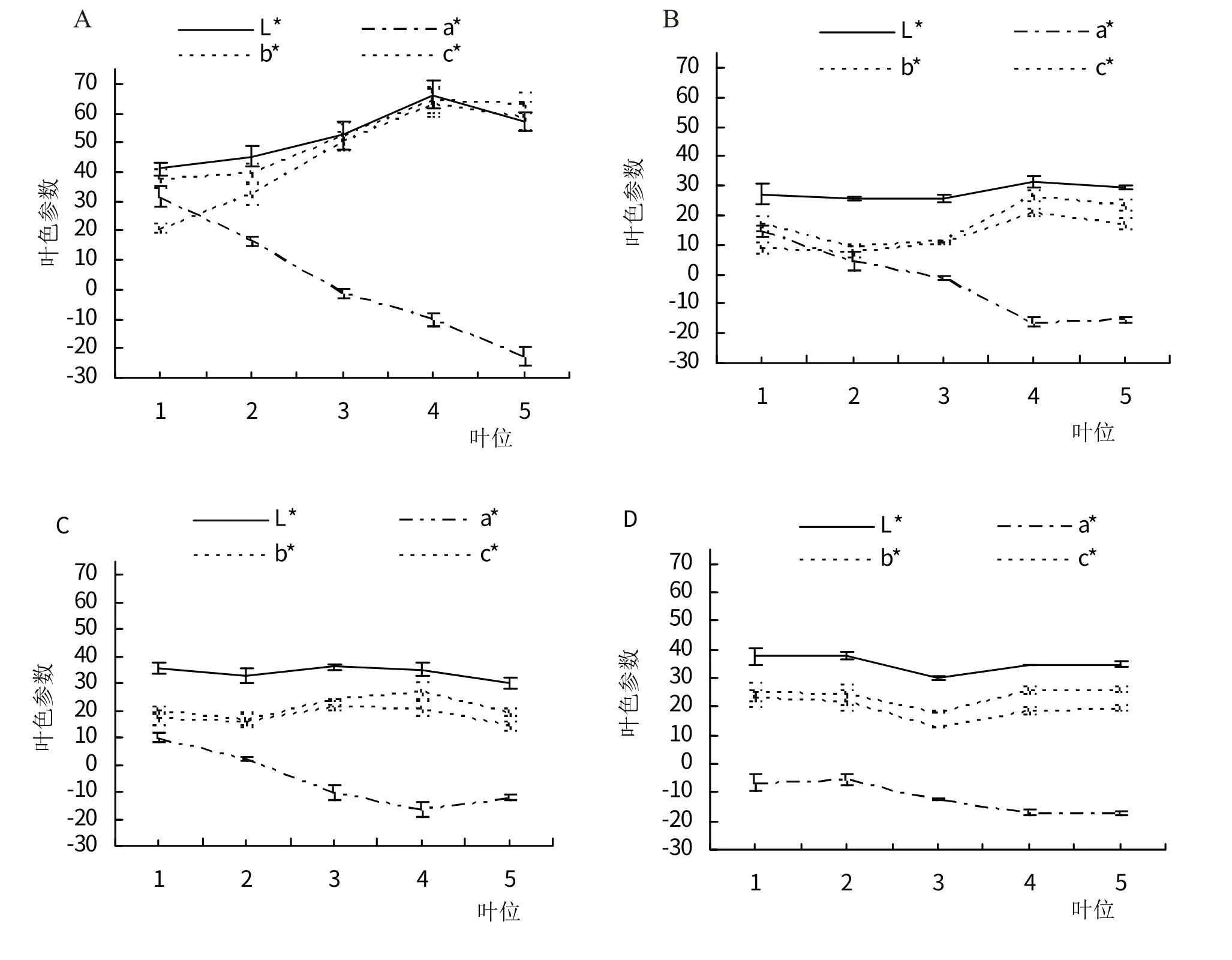
图2 叶色参数的变化
2.3 叶片显微结构及颜色
4 种臭椿各叶位叶片上、下表皮均为排列紧密的单细胞,下表皮的气孔密度大于上表皮;均分布有两种表皮毛(无色的单细胞非腺毛、有色或无色的多细胞头状腺毛),表皮毛分布密度都随叶位下降而减少,腺毛密度均以叶片上表面较高;栅栏组织均为排列紧密的柱状细胞,海绵组织均为排列疏松的不规则细胞。
叶片腺毛颜色、横切面颜色及栅栏组织细胞层数因臭椿品种和叶位的不同而有所区别。‘朝阳椿’1~3叶位腺毛以粉或紫色为主、4~5 叶位多呈无色透明,‘千红椿’各叶位腺毛均以紫红色为主,‘聊红椿’各叶位腺毛以无色透明为主、少数粉或紫色,‘普通臭椿’各叶位腺毛以无色透明为主、少数橘、粉或紫色,4 种臭椿叶位1 叶片的腺毛形态见图3A,F,K,P。各种臭椿叶片横切面的结构及颜色如图3所示:叶片表皮颜色,4种臭椿均随叶位降低而逐渐变浅,由叶位1时的橘红色(‘朝阳椿’)、紫红色(‘千红椿’)、橘粉色(‘聊红椿’)、杏黄色(‘普通臭椿’)逐渐转变为叶位5 时的近无色,上叶位表皮颜色按深浅排序为‘千红椿’>‘朝阳椿’>‘聊红椿’>‘普通臭椿’;叶肉主体颜色,4 种臭椿均随叶位降低而逐渐加深,‘朝阳椿’表现为由杏黄色逐渐向黄绿色转变,其余3 种臭椿则由黄绿色逐渐向绿色转变,且4种臭椿海绵组织的绿色度均较栅栏组织浅;上位叶靠近表皮的叶肉(尤其是海绵组织),‘千红椿’、‘朝阳椿’、‘聊红椿’分别显现出橘色、橘色、杏黄色的条带,‘普通臭椿’无明显异于叶肉主体颜色的条带出现;栅栏组织的细胞层数,‘朝阳椿’、‘聊红椿’为1~2层(叶位1)、2层(叶位2~3)或1层(叶位4~5),‘千红椿’、‘普通臭椿’各叶位均为1层。

图3 叶片横切面
理论研究和实践进路是相辅相成、相互促进的耦合互动关系。在对就地就近城镇化研究现状进行爬梳的基础上,笔者结合在江苏丰县的实地访谈调研,从理念意识、动力机制、发展模式、推进路径、制度供给等方面着眼,试图建构一个整体性框架,从而形成一条“理念—驱动—模式、路径和制度”的人口就地就近城镇化推进路径(见图1)。
1.2.3 色素比值 计算Chla:Chlb、Car:Chl 和Ant:Chl。因Ant与Chl的单位不同,需采用极差标准化法对原始数据作无量纲处理[15]后再计算Ant:Chl。
3 结论
根据学生学习教材,制作与学生学习密切相关的写字微课,把重点课文中难写字、易错字挑选出来,作为微课制作的主要内容。依据各个学段对写字要求不同,在制作写字微课时难易程度也不一样。如低年级生字“木”的微课制作,注重字的间架结构以及在田字格的位置,同时强调笔画顺序,让学生先观看运笔演示,然后模仿在田字格中练习,教师从中巡视给予纠正,直至完全会写,要求学生课下适当练习巩固。又如制作生字“猕”的微课重点强调字的间架结构,明白“猕”左右穿插避让,左边反犬旁写的窄小避让右边,这样整个字看起来匀称得体,给人以美的感觉。
各个叶片显微结构指标,包括LB、LM、UE、LE、PT、ST、PT:ST、GH 等,在不同品种(同一叶位)间或不同叶位(同一品种)间大多存在显著差异(P<0.05)(表3)。各种臭椿顺着叶位从上到下,叶片逐渐成熟,UE、LE、GH 大致呈下降趋势;LB、LM、PT、ST 及PT:ST 大体呈上升趋势。与‘普通臭椿’相比:‘千红椿’叶片较薄,腺毛较小,PT、ST、UE、LE 和PT:ST 均较小;‘朝阳椿’叶片较厚,腺毛较大,PT、ST 和LE 均较大,UE(叶位2、3 除外)和PT:ST(叶位2 除外)较小;‘聊红椿’叶片较厚,腺毛较小,PT(叶位3、4 除外)、ST 和LE 均较大,UE(叶位3、4除外)和PT:ST较小。
4 讨论
自然界中的彩叶植物大体上有4 种类型,分别为叶绿素型、色素型、表皮型和空隙型。叶绿素(Chl)是高等植物进行光合作用的主要色素,可使植物叶片呈现绿色,类胡萝卜素(Car)作为植物叶色构成的主要色素,可使植物呈现橙黄色,而叶片的变红常与类黄酮中花青素(Ant)的合成代谢和组成有关[6]。类黄酮、叶绿素和类胡萝卜素在叶片中的比例和种类是叶片表现为红色或者黄色的主要因素。表皮型和空隙型为结构型变异[17],表皮细胞结构、叶肉细胞之间的大空隙、及叶肉细胞与表皮细胞之间的大空隙会引发光的薄膜干涉、反射、折射或漫射等现象,进而产生叶色变异[5]。除此之外,外界环境条件及色素在叶片中的空间分布也是影响植物叶片呈色的因素[18]。本研究的臭椿样品均取自同一圃地,其生长环境条件一致,因此本研究暂未考虑外界环境对叶色的影响。徐卉[12]在研究‘红果臭椿’果实呈色机理时发现,与‘普通臭椿’相比,变红的‘红果臭椿’翅果内富含高含量的Ant。因此,本研究重点就3大色素(Chl、Car、Ant)含量及叶片显微结构对叶色的影响进行了研究探讨。
以机械制图为例,教学中,教师不必急于告诉学生应该怎样做,到底怎样做才是对的,而应该关注学生的实际,引导学生思考,并在引导中帮助学生了解知识,鼓励学生自主探索。当学生得出答案的时候,教师不应该直接回答对错,而应该肯定学生的努力,弱化对结果的评价。无论对错,都要给予充分地肯定,从而为学生学习提供源源不断的动力,促进学生能力的提升。
排除标准:(1)已发生严重并发症者;(2)精神异常、自理能力差或意识障碍者;(3)伴有心、肝及肾脏等功能严重异常者;(4)不能配合护理干预者。
笔者综合叶片表型观测、色素测定、显微结构及颜色观察结果得出,叶片栅栏组织的细胞层数、叶片表面腺毛的密度和颜色、以及叶片横切面各部分结构的厚度和颜色等均因品种和叶位的不同而有所区别,除此之外,4 种臭椿各叶位叶片显微结构之间无其它明显差异,由此得出,4种臭椿叶色差异的出现与叶片表皮结构及细胞排列方式无关,色素种类、含量及分布为造成臭椿不同品种及叶位的叶片颜色差异的主要原因。具体为:
‘聊红椿’和‘普通臭椿’上位叶表皮细胞及叶肉细胞(尤其是海绵组织)略微发红(或棕黄)的物质主要是Ant,叶位由上而下,Ant、Car:Chl、Ant:Chl 的逐渐减少与Chl的增加使两种臭椿叶片由棕色向绿色转变。‘聊红椿’叶色较‘普通臭椿’略微发红亦由高含量Ant 直接引起。即,‘聊红椿’高含量的花青素为其叶色略微发红的关键色素。姜新强等[18]、姜文龙等[19]研究风箱果、观赏海棠的紫红色叶片呈色机理时,也得出Ant是使叶片呈现紫红色的主要原因,与本研究此处结论一致。
‘千红椿’叶片表皮细胞及叶肉细胞(尤其是海绵组织)中的红色物质主要为Ant,叶位由上而下,Ant、Ant:Chl的逐渐减少和Chl的增加,使其叶片由红色向绿色逐渐转变。‘千红椿’各叶位叶片较另3 类臭椿发紫红亦由高含量Ant和高Ant:Chl造成。即,‘千红椿’高含量的花青素为其叶色发紫红的关键色素。姜文龙等[19]在观赏海棠叶色变化研究中指出,紫红色海棠的上位叶具有最多的Ant,而中位叶有所淡化。Ant的合成与降解因素可分为外因(光照、温度、水分、施肥元素配比等)和内因(结构基因和转录因子的调控),通过低氮胁迫、低温诱导、调节光照等方法可减缓叶片生长过程中色素的淡化,使整株叶片达到“全红”效果[19]。日后,可对‘千红椿’叶色稳定性的保持及改良策略作进一步研究,以发挥其更大的观赏价值。
‘朝阳椿’上位叶表皮细胞及叶肉细胞(尤其是海绵组织)中的高含量Ant及高Ant:Chl使上位叶呈橘红色;叶位逐渐往下,Ant 减少使叶片表皮红色渐褪,叶片显现出叶肉细胞可能因高Car:Chl导致的亮黄色;之后可能随Ant的持续减少、及Chl较Car更大幅度地渐增(使Car:Chl渐减),叶片又转为黄绿色。与另3种臭椿相比,‘朝阳椿’各叶位叶肉发黄亦可能由高Car:Chl造成。潘晶晶等[20]、郁万文等[21]研究金叶复叶槭、金叶银杏在整个生长季的叶色变化时,也得出Car:Chl值会影响叶片黄色呈现的结论。相同叶位时,‘朝阳椿’的Chl 含量和Car 含量均低于另3 种臭椿,但Chl 低下的程度更甚,因此‘朝阳椿’的Car:Chl 均较另3 种臭椿高,这与张振宇等[22]的研究结果一致。换言之,‘朝阳椿’的高Car:Chl更直接地是由低含量Chl而引起。同时,‘朝阳椿’Chlb含量较‘普通臭椿’的低下较Chla更甚,推测‘朝阳椿’可能属于总叶绿素及叶绿素b 合成减少突变体[10]。由叶片叶绿素含量减低引起的叶色变异(即叶绿素型变异)是一种常见的叶色变异类型[17],前人在对彩叶竹种、中华金叶榆、鑫叶栾、金叶银杏、水稻等叶色突变体的研究中发现,叶绿体结构异常或发育成熟度均可造成光合色素的积累差异,进而引发叶色变异[1-2,17,21,23-24]。综上,‘朝阳椿’上叶位高含量的花青素和各叶位低含量的总叶绿素可能为其叶片艳丽的直接原因。突变的黄色叶植株是研究叶绿体发育、叶绿素代谢、光合特性的理想材料[25],日后应对‘朝阳椿’叶片叶绿体结构、发育程度及光合特性作进一步研究,为叶色变异机制提供细胞学依据,为推进‘朝阳椿’的栽培和推广奠定理论基础。
本研究仅测定了类黄酮中Ant 的含量,而未测定其它类型的类黄酮,如能够使得叶片呈现黄色或橙色的黄酮、黄酮醇、查尔酮等组分。因此,未来应基于类黄酮代谢组、叶绿体超微结构、转录组等结果对臭椿的叶片成色机理作更深入的研究,这对观赏臭椿叶色育种及良种选育具有重要意义。

