近三年高考化学试题“电化学”知识点考查启示
□焦运涛
在2023 年新课标、新高考、新教材的背景下,作者结合近三年部分高考真题,分析“电化学”考点的命题方向,把握命题“脉搏”,为备考提供参考。在近三年的高考化学试题中,有关“电化学”的内容是热点,原电池原理、金属的防腐、电池的应用、电解原理及应用、电极的判断、电极方程式的书写等题目的难度以中等较为常见。本文通过考查方式及考查内容的对比,给学生提供指导。
一、试题对比
从近三年高考试题中可以看出,“电化学”知识在考查时主要以选择题的形式出现,在试题情境设置上常与生产、科技前沿知识相联系,并且渗透STSE教育理念。
二、典例分析
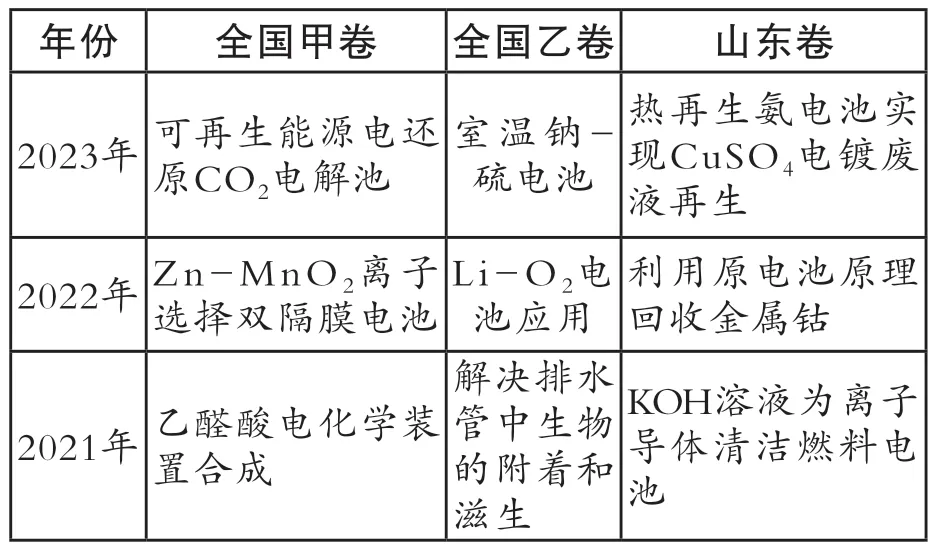
例1.(2023 年全国乙卷)室温钠-硫电池被认为是一种成本低、比能量高的能源存储系统。一种室温钠-硫电池的结构如图所示。将钠箔置于聚苯并咪唑膜上作为一个电极,表面喷涂有硫黄粉末的炭化纤维素纸作为另一电极。工作时,在硫电极发生反应:
下列叙述错误的是:
A.充电时Na+从钠电极向硫电极迁移
B.放电时外电路电子流动的方向是a→b
C.放电时正极反应为:2Na++S8+2e-→Na2Sx
D.炭化纤维素纸的作用是增强硫电极导电性能
这道题的情境新颖,答案为A,学生较容易提取出关键信息。从硫电极发生的反应不难看出,硫电极在放电过程中得到电子,作原电池的正极,而钠电极则为负极。学生得出此结论即可对B、C选项进行判断。而A选项则需要学生对二次电池充放电关系理解得比较清楚才能判断,充电时钠电极接外接电源的负极作电解池的阴极,Na+应向阴极钠电极移动。D选项需要学生认真读题给信息,在新信息中利用化学思维得出结论,充分考查了学生证据推理与模型认知的化学学科素养。该试题包含了原电池正负极的判断、电极方程式的书写、二次电池充电时与电解池的关系等知识点。
例2.(2021年山东卷)以KOH溶液为离子导体,分别组成清洁燃料电池,下列说法正确的是:
A.放电过程中,K+均向负极移动
B.放电过程中,KOH物质的量均减小
C.消耗等质量燃料,(CH3)2NNH2-O2燃料电池的理论放电量最大
D.消耗1molO2时,理论上N2H4-O2燃料电池气体产物的体积在标准状况下为11.2L
此题主要考查了清洁燃料电池,以KOH溶液为离子导体,分别组成CH3OH-O2、N2H4-O2、(CH3)2NNH2-O2清洁燃料电池,答案为C。试题涉及的内容主要为碱性条件下的燃料电池,学生需要根据已学的燃料电池模型书写出甲醇、肼、偏二甲肼的总反应方程式,并根据方程式对以上四个选项进行判断。
例3.(2023年全国甲卷)用可再生能源电还原CO2时,采用高浓度的K+抑制酸性电解液中的析氢反应来提高多碳产物(乙烯、乙醇等)的生成率,装置如下图所示。下列说法正确的是:
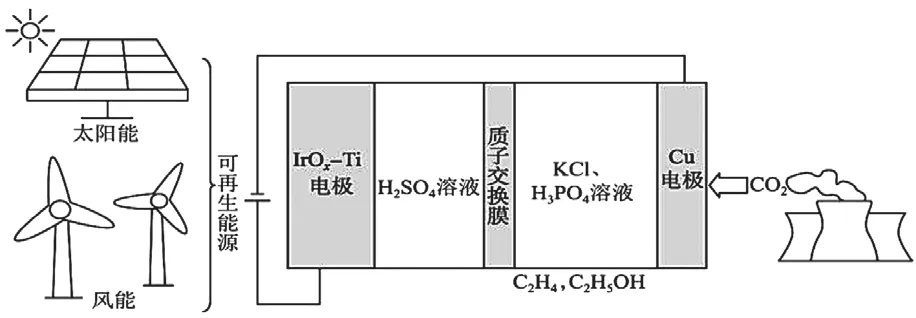
A.析氢反应发生在IrOx-Ti电极上
B.Cl-从Cu电极迁移到IrOx-Ti电极
C.阴极发生的反应有:2CO2+12H++12e-=C2H4+4H2O
D.每转移1mol电子,阳极生成11.2L气体(标准状况)
答案为C,通过图中给出的外接电源可以判断出电解池的阴阳极,阳极电极材料比较新颖,学生在判断电极反应时存在困难。此题考查的电解池放电过程其实并不复杂,阳极为水中氢氧根离子放电,而阴极则为二氧化碳还原为乙烯、乙醇等。
通过以上三道题目,我们可以看出高考电化学试题考查的一些特点,有对原电池或电解池知识点单独进行考查的,有两部分知识混合考查的,还有对生活生产实际应用如燃料电池进行考查的。
三、备考建议
“电化学”知识对于高中生来说较为抽象,简单电池的题目好理解,但是与实际电池相融合的题目对于学生来说难度较大。笔者与学生交流了解了产生这些困难的原因,给予以下针对性建议。
首先,此部分内容因与物理中的电学知识相关联,学生的思维定式让其无法与化学反应建立比较好的联系。因此,要找到“电化学”发生的“源动力”,在氧化还原反应复习中狠下功夫,建立“电子转移”与“电子移动形成电流”的电化学模型,体会化学中电子流动和物理学科中的差别。
其次,在“电化学”内容中有多组基本概念和规则,知识点的记忆和灵活运用比较困难。复习时可总结一些“小技巧”“顺口溜”帮助记忆。比如:在原电池中有“负极氧化,正极还原,正正负负”,即在原电池中,负极发生氧化反应,正极发生还原反应,电解质溶液中带正电的阳离子向正极移动,带负电的阴离子向负极移动;而电解池中则可以记成“阳氧阴还,阴阳阳阴”,即在电解池中,阳极发生氧化反应,阴极发生还原反应,电解质溶液中阴离子向阳极移动,而阳离子则向阴极移动。
最后,学生对合理理解和运用题目中的新信息存在较大困难。“电化学”题目中的新物质、新信息总会让学生感到无从下手,因此,在平时练习中要多分析新物质是否影响电池的原理。如果题给信息较多涉及新物质,则要关注这些信息在题目中的运用;如果涉及新物质相关信息较少,且用常规原理能解释清楚此电池放电过程,则新物质多是在题目中混淆视听,并不影响电化学中氧化还原反应原理。

