雷公藤红素苷对子痫前期大鼠肝肾细胞凋亡的影响及其保护作用
门少杰,刘旭
1. 夏邑华光精神病医院,河南 商丘 476400;2. 新乡医学院第二附属医院,河南 新乡 453002
子痫前期(PE)是一种以胎盘缺血、外周血管损伤和急性肝肾损伤等功能障碍为特征的异质性多器官疾病[1]。PE 引起的肝肾损伤可导致患者预后不良,探索同时具有PE 治疗作用及肝肾保护功能的药物对控制PE 病情具有重要意义。雷公藤红素苷(Cel)是一种从雷公藤根皮中提取的天然三萜类化合物[2]。Cel 通过抑制炎症和氧化应激来缓解高血压[3],还可抑制原代人骨关节炎软骨细胞中热休克蛋白90β 的表达,并抑制环氧合酶-2(COX-2)和基质金属蛋白酶-9(MMP-9)的表达,减轻炎症反应[4]。此外,负载Cel 的纳米胶束能够减少巨噬细胞中细胞因子的分泌[5]。这些研究提示Cel有可能成为治疗PE 的新型药物。另外,已有文献报道了Cel 的肝肾保护作用,例如,Cel 能够减轻二乙基亚硝胺诱导的大鼠肝纤维化[6],通过抑制IgA 肾病大鼠肾组织中Notch 信号通路减少蛋白尿的生成[7]。本研究观察Cel 对PE 大鼠肝肾细胞凋亡的影响,报道如下。
1 材料与方法
1.1 实验动物50 只7~9 周龄雌性Sprague-Dawley(SD)大鼠,体质量200~240 g,25 只7~9 周龄雄性SD 大鼠,体质量240~300 g,均购自长春市亿斯实验动物技术有限责任公司,生产许可证:SCXK(吉)2020-0002。饲养于无特定病原体(SPF)级动物房12 h/12 h 的光暗周期下,给大鼠提供标准饲料和水。将雌性和雄性大鼠按照2∶1 比例同笼饲养,观察到雌性大鼠阴栓脱落为孕第1 天。
1.2 实验试剂与仪器脂多糖(LPS)购自美国Sigma公司;Cel 购自滁州仕诺达生物科技有限公司;干扰素-γ(IFN-γ)、白细胞介素-4(IL-4)、白细胞介素-17(IL-17)、白细胞介素-10(IL-10)酶联免疫吸附法(ELISA)试剂盒购自武汉菲恩生物科技有限公司;蛋白抗体均购自美国Abcam 公司;流式抗体均购自美国BD 公司;脱氧核糖苷酸末端转移酶介导的缺口末端标记法(TUNEL)试剂盒购自碧云天生物技术研究所;原位细胞死亡检测试剂盒购自青旗(上海)生物技术发展有限公司。日立7600-020 全自动生化分析仪购自日本日立公司;BD FACSCalibur 流式细胞仪购自美国贝克曼库尔特公司。
1.3 动物分组及给药方法将50 只妊娠SD 大鼠随机分为对照(Control)组、PE 组、PE+低剂量Cel(PE+L-Cel)组、PE+中剂量Cel(PE+M-Cel)组、PE+高剂量Cel(PE+H-Cel)组5 组,每组10 只。参照参考文献[8],在孕第14 天时,将2 mL 的LPS(1 mg/kg)无菌生理盐水溶液尾静脉注射到PE 组、PE+L-Cel组、PE+M-Cel 组和PE+H-Cel 组大鼠体内来诱导PE大鼠模型,Control 组注射2 mL 0.9%氯化钠溶液。从孕第14 天到孕第20 天,PE+L-Cel 组、PE+M-Cel组和PE+H-Cel 组大鼠每天分别腹腔注射5、10、20 mg/(kg·d)的Cel。Control 组和PE 组注射等体积0.9%氯化钠溶液。
1.4 各观察指标检测方法①收缩压(SBP)和尿白蛋白。治疗结束后,使用美国KENT 公司CODA 系列动物无创血压测定系统测定大鼠SBP。收集大鼠尿液样本,室温2 000 ×g离心15 min,取上清液。使用全自动生化分析仪测定尿蛋白浓度。②血管内皮生长因子(VEGF)、基质金属蛋白酶-2(MMP-2)、基质金属蛋白酶-9(MMP-9)和β-肌动蛋白(β-actin)水平。使用放射免疫沉淀试验(RIPA)裂解液裂解胎盘组织并分离总蛋白。通过蛋白质定量试剂盒(BCA)测定总蛋白。将蛋白在10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离并转移到聚偏二氟乙烯膜(PVDF)上。使用5%的牛血清白蛋白封闭膜1 h后,将膜与VEGF、MMP-2、MMP-9、β-actin 一抗在4 ℃孵育过夜。第2 天与羊抗小鼠(IgG-HRP)二抗室温孵育2 h。抗体稀释浓度均为1∶2 000。使用BeyoECL Plus 显色。以β-actin 作为内参。③肝、肾组织细胞凋亡情况。采用TUNEL 法检测各组大鼠肝、肾组织中的凋亡细胞。大鼠肝、肾组织用4%多聚甲醛固定,石蜡包埋,按照TUNEL 试剂盒的说明对组织切片进行染色。在放大200 倍的光学显微镜下观察切片,并随机选择5 个视野计算TUNEL 阳性细胞百分比。④免疫组织化学检测。断头处死大鼠,取肝、肾,用4%多聚甲醛固定,制作肝肾组织切片(4 μm)。用二甲苯脱蜡30 min,梯度乙醇(100%乙醇10 min、95%乙醇10 min、80%乙醇5 min、75%乙醇5 min、蒸馏水5 min)水化。切片在室温下用0.5%的过氧化氢(H2O2)处理10 min 封闭内源性过氧化物酶,然后用冷水清洗。切片与一抗在4 ℃下孵育过夜。一抗为1∶1 000 稀释的B 淋巴细胞瘤-2 基因(Bcl-2)、活化半胱胺酸蛋白酶蛋白-9 抗体(Caspase-9)。然后使用链霉亲和素-生物素化二抗(1∶1 000 稀释)室温孵育1 h。在放大400 倍的光学显微镜下观察切片。⑤血清IFN-γ、IL-4、IL-17、IL-10 水平。大鼠眼眶静脉丛采血,室温2 000×g离心15 min,分离血清。采用ELISA 法严格按照试剂盒说明书检测。⑥外周血辅助性T 细胞1/辅助性T 细胞2(Th1/Th2)、辅助性T 细胞17/调节性T 细胞(Th17/Treg)。通过流式细胞仪检测外周血Th1/Th2、Th17/Treg 比例。检测方法参照参考文献[9]。所用抗体包括CD3(Percp)、CD4(FITC)、CD8(APC)、CD25(APC)、FoxP3(PE)、Th17(PE)、IFN-γ(FITC)、IL-4(PE)。
1.5 统计学方法使用SPSS21.0 统计学软件分析数据。所有数据采用均数±标准差(±s)表示,2 组间比较采用单因素方差分析及LSD 事后检验。P<0.05表示差异有统计学意义。
2 结果
2.1 各组大鼠SBP、尿白蛋白水平比较见图1。与Control 组比较,PE 组SBP、尿白蛋白水平均升高(P<0.05);与PE 组比较,PE+L-Cel 组、PE+MCel 组、PE+H-Cel 组SBP、尿白蛋白水平均降低(P<0.05);与PE+L-Cel 组比较,PE+M-Cel 组、PE+H-Cel 组SBP、尿白蛋白水平均降低(P<0.05);与PE+M-Cel 组比较,PE+H-Cel 组SBP、尿白蛋白水平降低(P<0.05)。
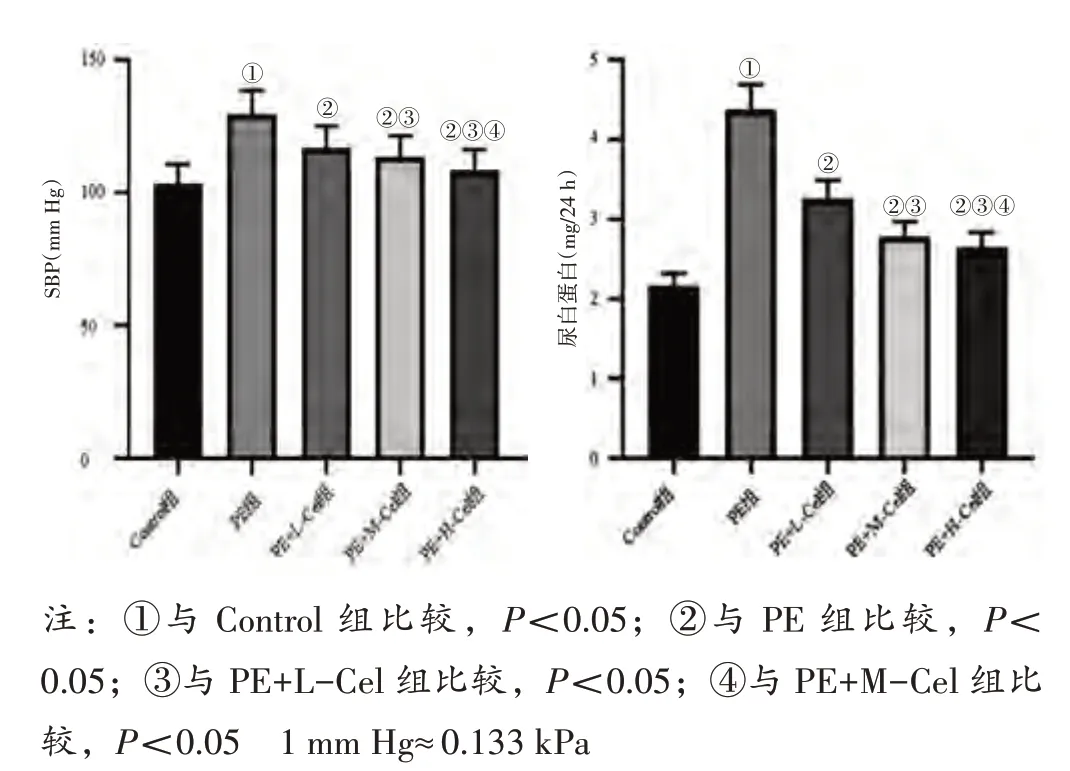
图1 各组大鼠SBP、尿白蛋白水平比较
2.2 各组大鼠胎盘组织VEGF、MMP-2、MMP-9蛋白表达水平比较见图2。与Control 组比较,PE组胎盘组织VEGF、MMP-2、MMP-9 蛋白表达水平均降低(P<0.05);与PE 组比较,PE+L-Cel 组、PE+M-Cel 组、PE+H-Cel 组胎盘组织VEGF、MMP-2、MMP-9 蛋白表达水平均升高(P<0.05);与PE+LCel 组比较,PE+M-Cel 组、PE+H-Cel 组胎盘组织VEGF、MMP-2、MMP-9 蛋白表达水平均升高(P<0.05);与PE+M-Cel 组比较,PE+H-Cel 组胎盘组织VEGF、MMP-2、MMP-9 蛋白表达水平升高(P<0.05)。
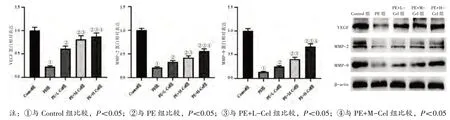
图2 各组大鼠胎盘组织VEGF、MMP-2、MMP-9 蛋白表达水平比较
2.3 各组大鼠肝、肾组织细胞凋亡比较见图3、图4。TUNEL 染色显示,与Control 组比较,PE 组肝、肾组织细胞凋亡率均升高(P<0.05)。与PE 组比较,PE+L-Cel 组、PE+M-Cel 组、PE+H-Cel 组肝、肾组织细胞凋亡率均降低(P<0.05);与PE+LCel 组比较,PE+M-Cel 组、PE+H-Cel 组肝、肾组织细胞凋亡率均降低(P<0.05);与PE+M-Cel 组比较,PE+H-Cel 组肝、肾组织细胞凋亡率降低(P<0.05)。
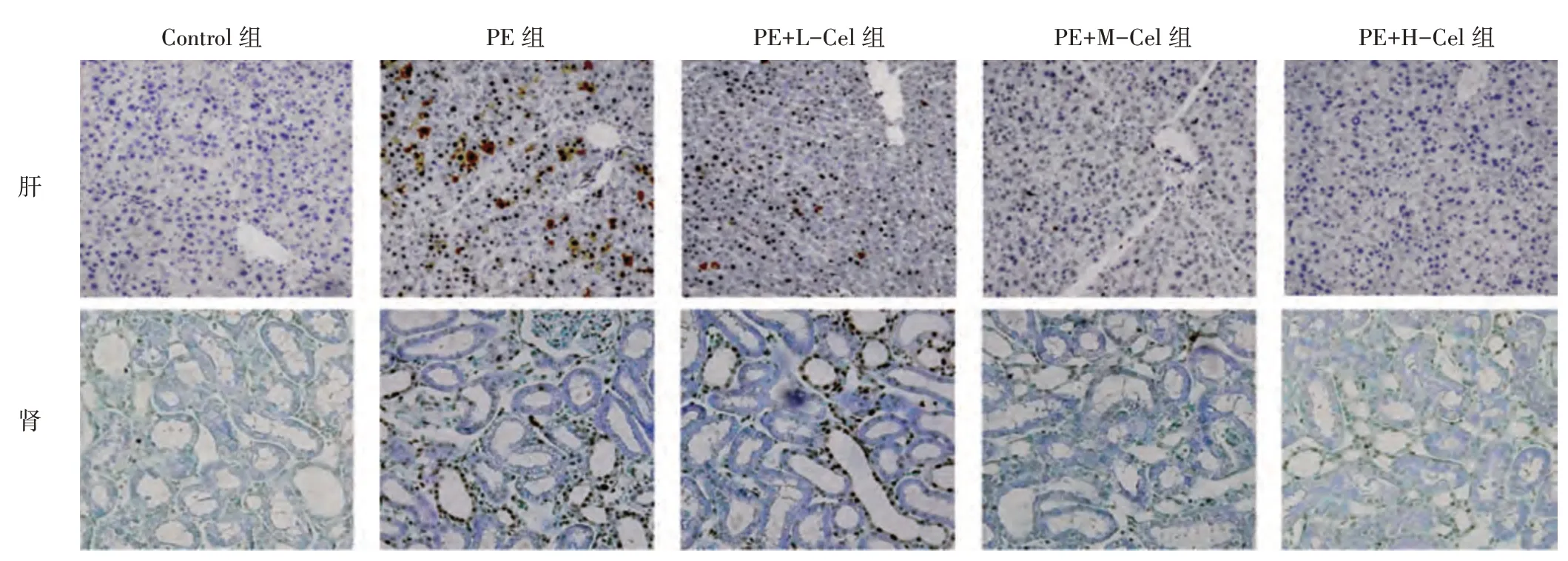
图3 各组大鼠肝、肾组织细胞凋亡比较(×200)
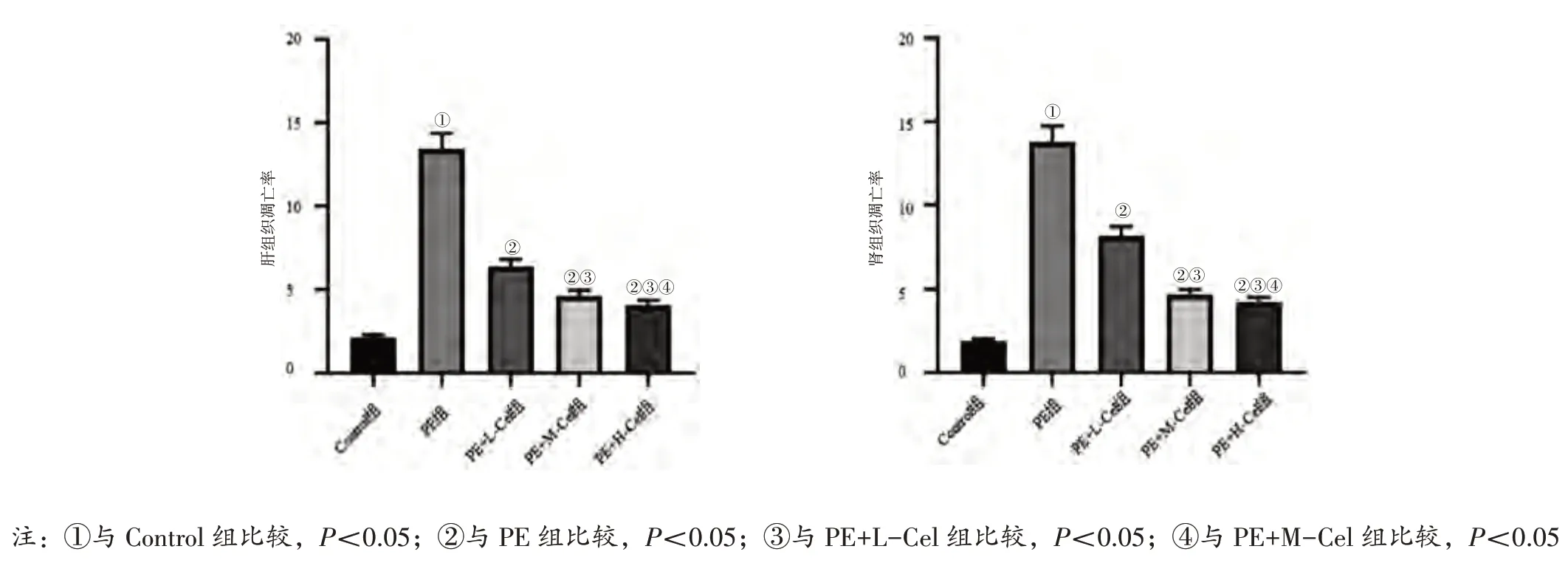
图4 各组大鼠肝、肾组织细胞凋亡比较
2.4 各组大鼠肝、肾组织Caspase-9、Bcl-2 相对表达水平比较见表1、图5。免疫组织化学染色显示,与Control 组比较,PE 组肝、肾组织Caspase-9表达均升高(P<0.05)、Bcl-2 表达均降低(P<0.05);与PE 组比较,PE+L-Cel 组、PE+M-Cel 组、PE+H-Cel 组Caspase-9 表达均降低(P<0.05),Bcl-2 表达均逐渐升高(P<0.05);与PE+L-Cel 组比较,PE+M-Cel 组、PE+H-Cel 组肝、肾组织Caspase-9 表达均升高(P<0.05),Bcl-2 表达均降低(P<0.05);与PE+M-Cel 组比较,PE+H-Cel 组肝、肾组织Caspase-9 表达均升高(P<0.05),Bcl-2表达均降低(P<0.05)。

表1 各组大鼠肝、肾组织Caspase-9、Bcl-2 相对表达水平比较
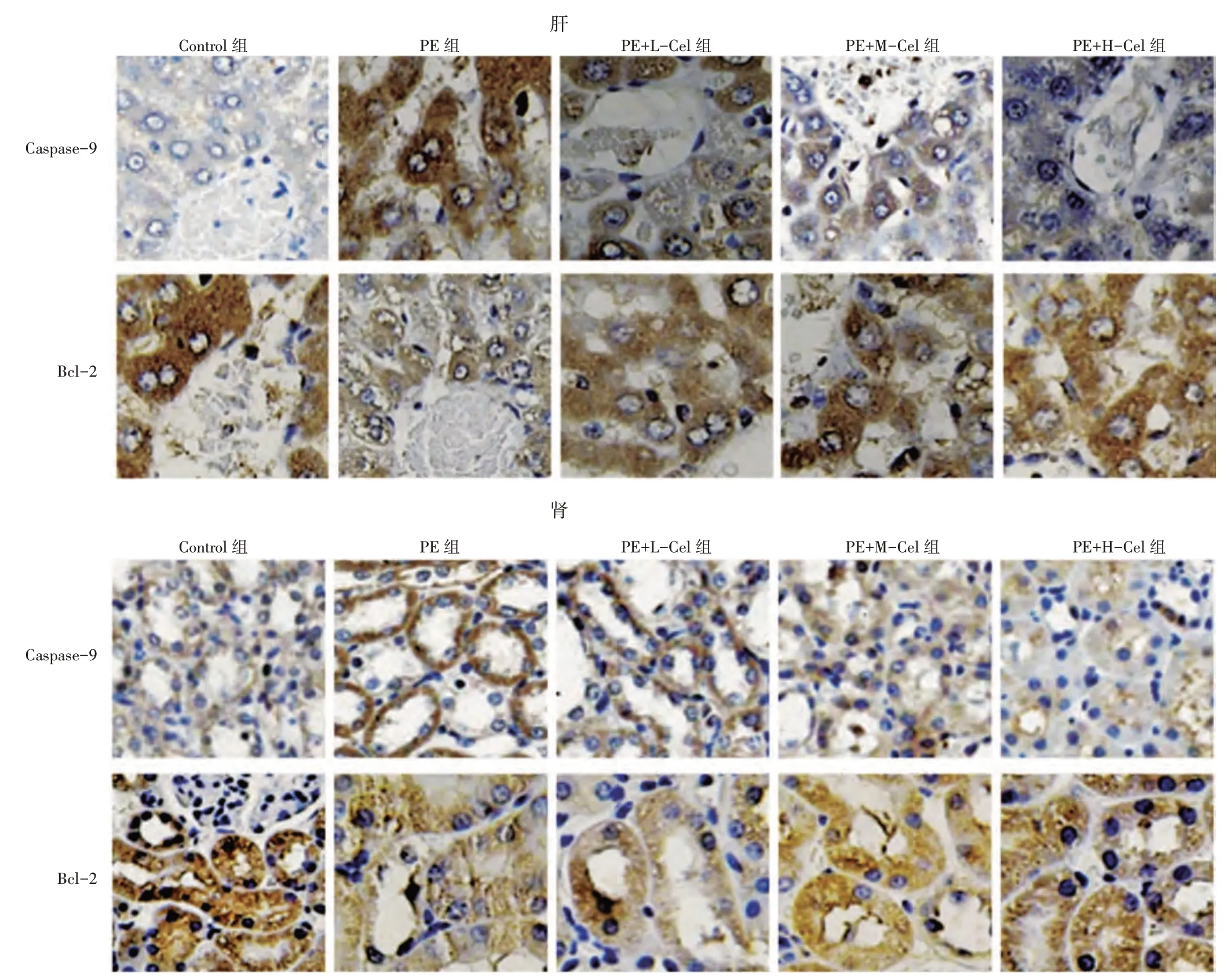
图5 各组大鼠肝、肾组织Caspase-9、Bcl-2 表达比较(×400)
2.5 各组大鼠血清IFN-γ、IL-4、IL-17、IL-10 水平比较见图6。与Control 组比较,PE 组血清IFNγ、IL-17 水平均升高(P<0.05),IL-4、IL-10 水平均降低(P<0.05);与PE 组比较,PE+L-Cel 组、PE+M-Cel 组、PE+H-Cel 组血清IFN-γ、IL-17 水平均降低(P<0.05),IL-4、IL-10 水平均升高(P<0.05);与PE+L-Cel 组比较,PE+M-Cel 组、PE+HCel 组血清IFN-γ、IL-17 水平均降低(P<0.05),IL-4、IL-10 水平均升高(P<0.05);与PE+M-Cel 组比较,PE+H-Cel 组血清IFN-γ、IL-17 水平均降低(P<0.05),IL-4、IL-10 水平均升高(P<0.05)。
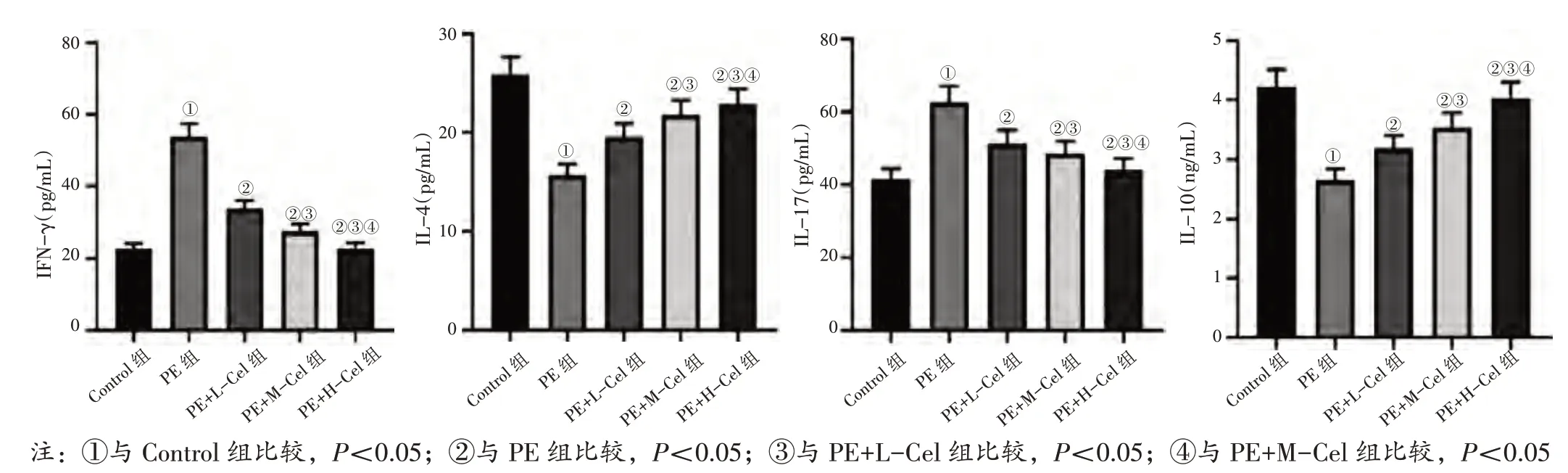
图6 各组大鼠血清IFN-γ、IL-4、IL-17、IL-10 水平比较
2.6 各组大鼠外周血Th1、Th2、Th17、Treg 占CD4+百分比比较见图7。与Control 组比较,PE 组外周血Th1、Th17 占CD4+的百分比均升高(P<0.05),Th2、Treg 占CD4+的百分比均降低(P<0.05)。与PE 组比较,PE+L-Cel 组、PE+M-Cel 组、PE+H-Cel 组外周血Th1、Th17 占CD4+的百分比均降低(P<0.05),Th2、Treg 占CD4+的百分比均升高(P<0.05)。与PE+L-Cel 组比较,PE+M-Cel 组、PE+H-Cel 组外周血Th1、Th17 占CD4+的百分比均降低(P<0.05),Th2、Treg 占CD4+的百分比均升高(P<0.05)。与PE+M-Cel 组比较,PE+H-Cel 组外周血Th1、Th17 占CD4+的百分比降低(P<0.05),Th2、Treg 占CD4+的百分比升高(P<0.05)。
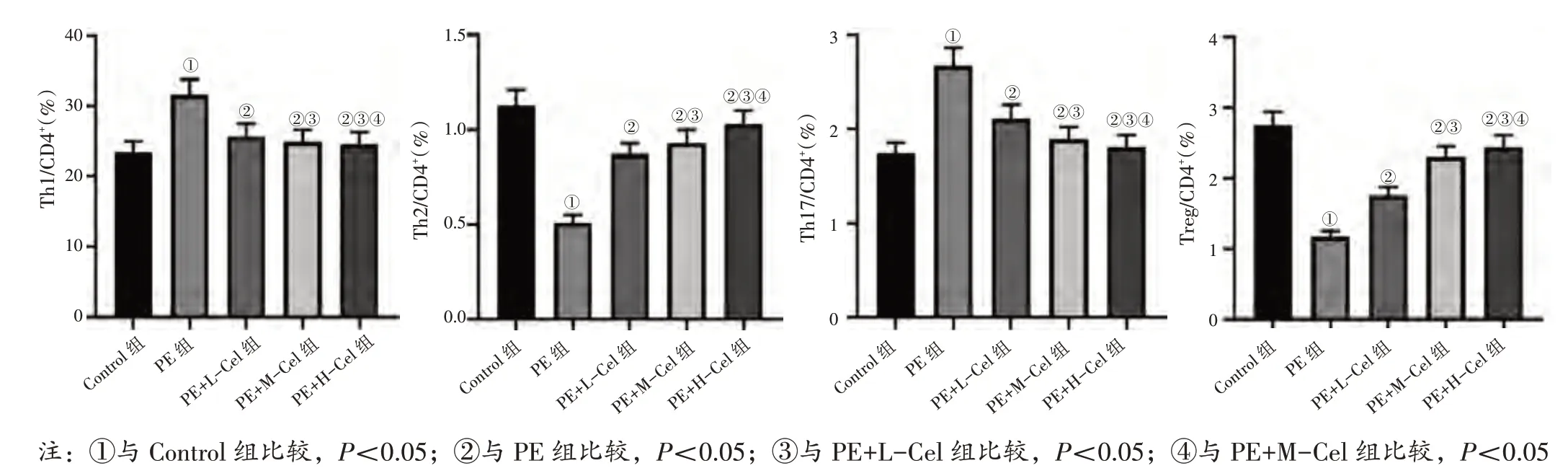
图7 各组大鼠外周血Th1、Th2、Th17、Treg 占CD4+百分比比较
3 讨论
PE 是妊娠期最常见、最危险、最不可预测的并发症之一。由于PE 的确切机制尚不清楚,PE 可增加产妇和婴儿的死亡率,并且增加相关并发症发生率[10],如胎盘早剥、新生儿脑室间出血、缺氧缺血性脑病等[11]。研究报道,Cel 可降低L-NAME 诱导的PE 大鼠总尿蛋白、尿量和血压,从而减轻PE 症状[12]。本研究中,Cel 以剂量依赖性方式降低了PE大鼠SBP 和尿白蛋白,证实了Cel 在治疗PE 中的潜在应用价值。此外,本研究还表明Cel 以剂量依赖性方式上调了PE 大鼠胎盘组织中VEGF、MMP-2和MMP-9 的蛋白表达水平。VEGF 是重要的血管生成因子,PE 患者胎盘组织中VEGF 水平明显降低[13]。MMP-2 和MMP-9 在调节滋养细胞侵袭中起着重要的作用,可促进滋养细胞侵袭[14]。本研究结果提示Cel 促进了PE 大鼠胎盘血管生成和滋养细胞侵袭。
PE 可导致细胞凋亡增加,从而引起肝、肾及其他器官功能障碍[15-16]。PE 引起的多种类型的细胞凋亡与发病期间伴随的全身异常的炎症反应有关,PE发生后白细胞和内皮细胞的激活,免疫系统失调,炎症加剧,从而引起细胞凋亡[17]。因此,抗炎治疗是PE 的一种有效治疗措施。例如,抗炎治疗可使高血压大鼠在妊娠期的血压和尿蛋白排泄恢复正常[18]。过往研究已经报道了Cel 的抗炎作用[4],Cel 可通过诱导血红素加氧酶-1 的表达减轻高血压引起的血管平滑肌细胞炎症和氧化应激,从而降低高血压大鼠的SBP和舒张压,改善胰岛素敏感性[3]。本研究发现Cel 以剂量依赖性方式减轻了PE 大鼠肝、肾组织细胞凋亡,说明Cel 对肝、肾具有保护作用,而这种作用可能与其抗炎特性有关。
适应性免疫系统和先天免疫系统在PE 的发生和发展中起着重要作用[19]。近年来,多项研究报道了PE 中不同T 淋巴细胞亚型的紊乱及T 细胞释放细胞因子的失调[20]。淋巴细胞是蜕膜化子宫内膜中发现的最大的常驻免疫细胞群,包括子宫或蜕膜自然杀伤(NK)细胞和T 细胞亚群,即TH1、Th2、Treg 和Th17 细胞。T 淋巴细胞位于蜕膜间质和腺上皮,在建立良好的妊娠环境中起着关键作用[21]。Th1/Th2 和Th17/Treg 细胞平衡在建立有利妊娠环境中起着至关重要的作用。在围着床期,Th1 反应参与免疫监视,避免滋养细胞的过度侵袭[22]。胎盘植入后,Th2 转化对于正常胚胎的发育、抑制Th17 和Th1 细胞是必不可少的[23]。此外,Treg 细胞是免疫耐受和胚胎植入的主要因素,外周和蜕膜Treg 细胞在正常妊娠期间增加[24]。Th1 细胞主要分泌IFN-γ、TNF-α 等细胞因子[19]。Th2 细胞主要分泌IL-4 细胞因子并介导体液免疫[20]。IL-17 细胞主要分泌Th17 细胞因子,Treg细胞主要分泌IL-10 细胞因子[18]。大量的文献表明Th2 细胞分泌的细胞因子可减轻炎症。IL-17 是中性粒细胞炎症的关键启动子,可募集Th17 细胞并激活Th1 细胞[22]。IL-10 通过抑制核因子κB 的表达来抑制Th1 细胞产生TNF-α 和IFN-γ[23]。IL-10 可降低妊娠期高血压大鼠血压和尿蛋白[18]。因此,抑制IFN-γ和IL-17 的表达并增加IL-4 和IL-10 的表达可抑制炎症。本研究结果显示,Cel 降低了PE 大鼠血清IFN-γ、IL-17 水平,升高了IL-4、IL-10 水平。并且降低了PE 大鼠外周血Th1 和Th17 占CD4+的百分比,升高了Th2 和Treg 占CD4+的百分比。提示Cel可能通过促进PE 大鼠Th1 细胞向Th2 细胞漂移和Th17 细胞向Treg 细胞漂移,从而抑制了Th1/Th2 及Th17/Treg 细胞失衡,进而改善了PE 大鼠体内免疫状态。
综上所述,本研究表明Cel 可减轻PE 大鼠症状并抑制肝肾细胞凋亡,Cel 可能通过纠正PE 大鼠Th1/Th2 及Th17/Treg 细胞失衡来发挥治疗作用。

