茶皂素对大豆水解肽的修饰及复合物的乳化性表征
谢 萱,姚玉雪,闫世长,关 尧,马鸿飞,孙树坤,,陈 昊
(1.东北农业大学食品学院,黑龙江哈尔滨 150030;2.黑龙江省绿色食品科学研究院,黑龙江哈尔滨 150030)
大豆水解肽(Soy hydrolyzed peptide,SHP)是由大豆分离蛋白经过酶解破坏肽键将大豆分离蛋白分解成更小的肽,其具有良好的溶解度、保水性等功能特性[1],同时还具备重要的生物功能,如抗高血压活性、预防骨质疏松、降血糖和抗氧化功能等[2]。除此之外,与大豆分离蛋白相比,SHP 相对分子量更低,具有更好的生物利用度,更适用于特殊人群[3]。由于酶解后的大豆分离蛋白的亲水基团被破坏,导致乳化性较差,影响了SHP 的应用[4]。因此,很多研究者通过改性方法改善其功能特性。例如,Lopes-da-Silva 等[5]通过控制SHP 和半乳甘露聚糖的浓度和分子质量可以很好地改善SHP 的功能性(凝胶性、乳化性)。Zang 等[6]发现,通过木瓜蛋白酶水解的SHP 与谷氨酰胺转氨酶交联可以显著提高乳液的冻融稳定性和乳化性,并防止聚集。
茶皂素(Tea Saponin,TS),又称茶皂苷,是油茶籽中提取出来的一种天然两亲性表面活性剂,是由疏水性配基部分和亲水性碳水化合物两部分组成[7]。TS 具有良好的抗肿瘤、抗氧化和抗菌[8]以及起泡性、乳化性、润滑性等性能。例如,Zhu 等[9]研究表明,TS 主要通过静电作用及空间位阻效应使油滴保持稳定,并可以在低浓度下和油形成纳米级液滴。Zhao 等[10]研究表明,TS-磷酸化紫苏分离蛋白复合物可以作为共稳定剂,通过调节TS 浓度来改善高内相乳液的冻融稳定性和流变性。因此,考虑到TS 在乳液体系中的应用前景,可以利用TS 来提高SHP的乳化特性,然而,关于添加TS 对SHP 的影响鲜有报道,且两者的相互作用机制尚不清晰,仍需探讨。
本文利用傅里叶变换红外光谱、荧光光谱以及紫外-可见吸收光谱研究了不同质量比的TS 与SHP的相互作用机制和理化结构;考察了SHP-TS 复合物的抗氧化性和乳化性,并表征了其作为乳化剂制备乳液的粒径电位和微观结构。本研究为食品工业中的新型乳化剂的开发提供了一定的理论基础,并进一步拓宽了SHP 在食品行业中的应用。
1 材料与方法
1.1 材料与仪器
大豆 市售;脱脂豆粕 实验室自制;碱性蛋白酶200000 U/g,北京索莱宝科技有限公司;茶皂素 纯度含皂苷52.3%、粗蛋白5.6%、总碳水化合物35.8%、水3.4%、灰分2.9%,上海源叶生物科技有限公司;1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH) 东京化成工业株式会社;大豆油市售;尼罗红、尼罗蓝 北京博奥拓达科技有限公司;其他试剂均为分析纯。
K60V/I 榨油机 美国KOMET 公司;FD5-3 型冷冻干燥机 美国SIM 公司;Nicolet is50 傅里叶变换红外光谱仪 赛默飞世尔科技(中国)有限公司;RF-6000 荧光分光光度计 日本Shimadzu 公司;UV-2600 紫外可见分光光度仪 岛津仪器(苏州)有限公司;UV-1100 紫外可见分光光度仪 上海美析仪器有限公司 ;NANO ZS90 粒度及电位分析仪 英国马尔文仪器有限公司;D-500 高剪切数显分散机维根技术(北京)有限公司;TCS SP8 激光共聚焦扫描显微镜 德国徕卡公司。
1.2 实验方法
1.2.1 脱脂豆粕的制备 参考王亚杰等[11]的方法,并略作修改。将无霉变的500 g 大豆原料放入榨油机中调节压榨温度200 ℃,螺旋杆转速为34 r/min进行冷榨,冷轧后所得的豆粕为脱脂豆粕。蛋白质含量使用凯氏定氮仪测定,结果为:51.37%±5.54%。
1.2.2 脱脂豆粕制备大豆分离蛋白 参考Das 等[12]的方法,并略作修改。将脱脂豆粕粉碎,过60 目筛,将脱脂豆粕粉分散于去离子水中搅拌并使之充分溶解,料液比为1:10(w/v),用2 mol/L 的NaOH 溶液调节pH 至9.0,搅拌2 h,4 ℃下9000 r/min 离心30 min,取其上清液,用2 mol/L 的HCl 调节pH 至4.5,静置1 h,4 ℃下6500 r/min 离心30 min,收集沉淀。用去离子水将沉淀水洗3 次后,调pH 至7.0,去除不溶物,将蛋白溶液冷冻干燥得到大豆分离蛋白。蛋白质含量使用凯氏定氮仪测定,结果为:93.38%±6.62%。
1.2.3 SHP 的制备 参考Zhang 等[13]的方法,并略做修改。取一定量的大豆分离蛋白粉溶于一定量的去离子水中,配制浓度为5%(w/v)的底物溶液,室温磁力搅拌15 min 后转移至水浴锅,控制温度值在90 ℃水浴保温15 min。达到反应温度值后调节至酶适宜条件(50 ℃,pH9.0)。向大豆分离蛋白水溶液中准确加入水解所需浓度为2%(w/v)的碱性蛋白酶,将得到的水解液放入50℃的水浴锅中进行恒温酶解反应。水解3 h 后,调节pH 至9.0 以保持pH稳定,取出置于沸水浴中加热20 min 以灭酶。冷却后在9000 r/min 离心20 min,取上清液调节其pH为7.0,冷冻干燥后备用。
1.2.4 SHP-TS 复合物的制备 复合体系中TS 和SHP总质量分数为10 g/L,SHP:TS 的质量比分别为0:1、1:0、1:0.5、1:1、1:2(w/w)(分别编号为1% TS、1%SHP 、SHP-TS 1:0.5、SHP-TS 1:1、SHP-TS 1:2)。将复合乳化剂溶解到100 mL 的0.01 mol/L 的磷酸盐缓冲液中(pH7.0),连续搅拌2 h。以溶液的形式保存在4 ℃冰箱中,用于特性分析。
1.2.5 SHP-TS 复合物的紫外-可见吸收光谱分析参照Yan 等[14]的方法,并略做修改。用0.01 mol/L的磷酸盐缓冲液将样品在室温下稀释20 倍,使用紫外分光光度计扫描,扫描范围和速度分别为200~600 nm,200 nm/min,分辨率为2 nm。
1.2.6 SHP-TS 复合物的傅里叶红外变换光谱分析
将处理后的SHP-TS 复合物进行冻干,冻干后的样品按照m(样品):m(溴化钾)=1:100,将2 mg 样品与200 mg 溴化钾均匀混合后压成固体薄片,使用红外光谱仪测定样品的红外光谱。仪器参数分辨率为4 cm-1,扫描次数64 次,光谱波数范围为400~4000 cm-1。
1.2.7 SHP-TS 复合物的荧光光谱分析 根据Guo等[15]的方法,并略做修改。将样品用0.01 mol/L 的磷酸盐缓冲液中(pH7.0)在室温下稀释100 倍。用荧光分光光度计测定荧光光谱。仪器参数设定为激发波长290 nm,扫描范围300~500 nm,激发狭缝与发射狭缝均为5 nm,扫描速度600 nm/min。
1.2.8 SHP-TS 复合物的乳化性 参照Yan 等[14]的方法,并略做修改。将上述1.2.4 中的SHP 和SHPTS 复合物溶液(12 mL)与大豆油(4 mL)进行均质(11000 r/min,3 min),制备油相体积为25%的乳液。将新制乳液用0.1%十二烷基硫酸钠(Sodium dodecyl sulfate,SDS)溶液稀释100 倍。使用紫外分光光度计测定,并以相同浓度SDS 溶液调零。混匀后立即读取样品在500 nm 波长处吸光度(A1)。放置30 min 后,记录相同波长下吸光度(A2)按照下式计算样品的乳化活性(Emulsifying activity index,EAI)和乳化稳定性(Emulsifying stability index,ESI)。
式中:N 表示稀释倍数,100;ρ表示肽质量浓度,g/L;φ为乳液中油相的体积分数,25%;A1表示0 min时样品的吸光度;A2表示30 min 时样品的吸光度。
1.2.9 SHP-TS 复合物的体外抗氧化测定 根据Huang 等[16]的方法并略做修改。DPPH 与无水乙醇混合,配制成0.1 mmol/L 的DPPH 乙醇溶液,配制浓度1.0 mg/mL 的样品溶液,用4 mL 无水乙醇和4 mL DPPH 做空白组。分别吸取4 mL 样品和4 mL DPPH 乙醇溶液于10 mL 离心管中,振荡均匀,在黑暗条件下静置30 min。用紫外分光光度计测波长为517 nm 时的样品液的吸光度A0(若有不溶物,离心去除),并按公式计算清除率。
式中:A0表示4 mL DPPH 溶液与4 mL 无水乙醇的吸光度;A1为4 mL 样品和4 mL DPPH 溶液混合的吸光度;A2为4 mL 样品和4 mL 无水乙醇的吸光度。
1.2.10 SHP-TS 复合物乳液的制备 将上述1.2.4中的SHP-TS 复合物作为试验组,单一的SHP 作为对照组。试验组与对照组与大豆油混合,总体积为16 mL,其中油相体积为25%,使用均质机于11000 r/min 均质3 min,制得乳液。
1.2.10.1 乳液平均粒径的测定 为了避免多重光散射效应,在测量之前,用磷酸盐缓冲溶液(0.01 mol/L,pH7.0)将样品进行稀释。设定分散相和连续相的折射率分别为1.47 和1.33。
1.2.10.2 乳液ζ-电位的测定 使用ζ-电位分析仪测定样品的ζ-电位。为了避免多重光散射效应,在测量之前用磷酸盐缓冲溶液(0.01 mol/L,pH7.0)将乳液样品稀释100 倍。
1.2.11 激光共聚焦(CLMS) 根据Zhang 等[17]的方法,并略作修改。将制备好的乳液样品稀释10倍,将25 μL 尼罗红(0.1%,w/v)和25 μL 尼罗蓝(0.1%,w/v)溶液加入到1 mL 样品乳液中,混合均匀,取5 mL混合物置于载玻片中心并用盖玻片覆盖,在TCS SP8 激光共聚焦显微镜下分别以488 和633 nm 下进行激发,观察乳液的微观结构。
1.3 数据处理
所有实验重复3 次,结果均以平均值±标准误差表示。使用软件SPSS 24.0 进行ANOVA 差异显著性分析及相关分析确认样品之间的统计学差异(P<0.05),以Origin 2022 软件进行绘图分析。
2 结果与分析
2.1 SHP-TS 复合物的紫外-可见吸收光谱分析
紫外-可见吸收光谱可用于研究蛋白质构象变化以及小分子与蛋白质之间发生相互作用的一种方法。结果如图1 所示,可以看出SHP 的特征吸收峰出现在285 nm 附近,这主要由Trp 和Tyr 等芳香族氨基酸残基的π-π*跃迁引起的[18]。TS 有两个特征峰分别为290 nm 附近和342 nm 附近,290 nm 处的特征峰可能是由于肉桂酸引起的[19],342 nm 处的特征峰可能是隐含的类黄酮引起的[20]。在随着TS 占比的增加,可以在紫外-可见吸收光谱中观察到三个效应:a.与SHP 的紫外-可见吸收光谱相比,SHP-TS 复合物出现新的吸收峰,表明SHP 与TS 成功复合[21];b.随着TS 占比的增加,紫外-可见吸收光谱的吸收强度增加;并出现两个吸收峰,第一个吸收峰在285 nm 附近,第二个吸收峰在345 nm 附近。第一吸收峰和第二吸收峰由于SHP 的影响出现了轻微的红移(从285 nm 处移至289.5 nm 处,从340 nm 处移至349 nm 处)。表明TS 的占比会改变SHP 中芳香族氨基酸残基的微环境和结构,从而影响TS 和SHP 的相互作用[22];c.SHP-TS 复合物吸收强度的增加,表明SHP 与TS 发生强相互作用,内部的疏水基团或者蛋白质的二级结构暴露于表面[15]。
2.2 SHP-TS 复合物的红外光谱分析
傅里叶变换红外光谱是分析蛋白质二级结构的重要手段之一,可用于评估不同质量比中SHP 与TS 之间的相互作用。不同比例的TS 对SHP 结构的影响如图2 所示,分别在3300~3270 和2930~2933 cm-1处检测到了振动峰,可能是由于-OH 和C-H的伸缩振动[23]。SHP 的宽吸收峰在3271.94 cm-1代表着-OH 伸缩振动,当SHP 与TS 复合物形成后,-OH 伸缩振动的吸收峰波长发生红移,从3271.94 cm-1移动至3296.63 cm-1,其可能由于SHP-TS 复合物形成过程存在氢键,并且随着TS 的占比增加,氢键强度逐渐增强[24]。Ma 等[7]研究发现,玉米醇溶蛋白与TS 之间存在氢键相互作用,TS 与玉米醇溶蛋白复合时同样会发生吸收峰红移并伴随-OH 的伸缩振动,本文的结果与其一致。
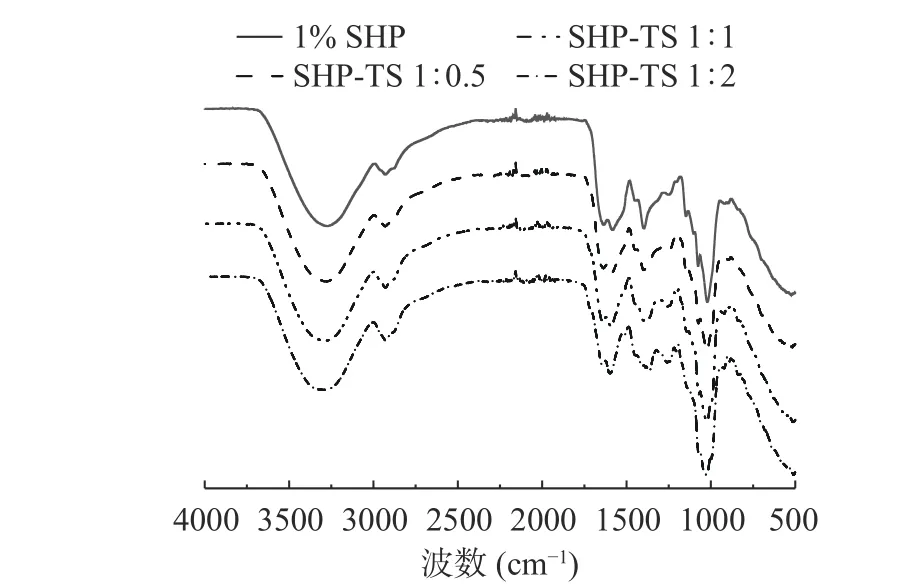
图2 SHP-TS 复合物的FI-TR 谱图Fig.2 FI-TR spectroscopy of soy hydrolytic peptide-tea saponin complex
利用酰胺Ⅰ带去卷积可以表征蛋白的二级结构含量变化,结果如表1 所示:与SHP 相比,随着TS 占比的增加酰胺Ⅰ带发生显著变化(P<0.05),SHP的β-转角、β-折叠和无规则卷曲的相对含量显著降低(P<0.05),α-螺旋相对含量显著增加(P<0.05),蛋白质的二级结构主要是由氢键维持,随着TS 的增加,可能破坏了β-折叠和β-转角之间的氢键,导致含量降低,而α-螺旋的结构在稳定状态下具有更强的动态性和更高的稳定性[25]。
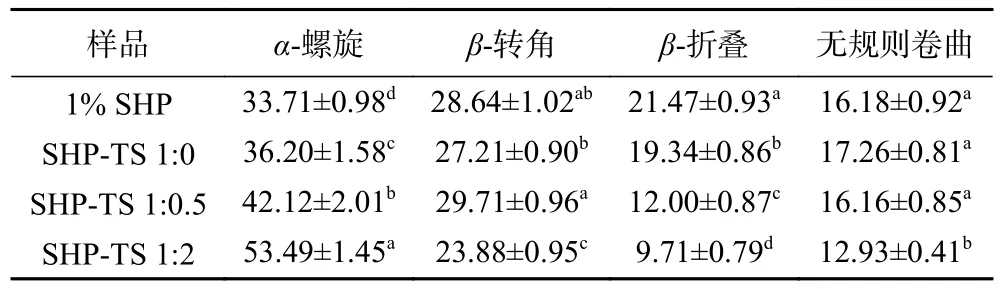
表1 SHP-TS 复合物的二级结构相对含量Table 1 Relative contents of secondary structure of soy hydrolytic peptide-tea saponin complex
2.3 SHP-TS 复合物的荧光光谱分析
荧光光谱是用于表征蛋白质的三级结构和色氨酸残基所处微环境的变化的重要手段[26]。结果如图3 所示,SHP 在354.5 nm 处显示出宽的发射带。与TS 复合后,最大发射波长也发生了轻微蓝移,从354.5 nm 至349 nm,说明SHP 中色氨酸残基中的吲哚基处于更加疏水的环境中[27]。再者,随着占比逐渐增加荧光强度逐渐降低,这表示TS 可能在界面处与SHP 发生相互作用,导致了色氨酸残基的微环境和结构发生了改变[28]。可能由于TS 与SHP 之间形成氢键;同时,TS 的芳香环与SHP 的疏水位点之间存在相互作用。因此,氢键和疏水作用改变了SHP 的微环境[29]。Yu 等[30]研究了TS 与体外胰脂肪酶的相互作用发现TS 的存在会改变胰脂肪酶色氨酸的微环境,并且会增加胰脂肪酶的疏水性和封闭式的三级结构。与紫外-可见吸收光谱结论一致。
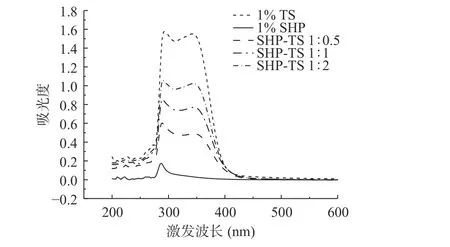
图3 SHP-TS 复合物的荧光光谱Fig.3 Fluorescence spectroscopy of soy hydrolytic peptide-tea saponin complex
2.4 SHP-TS 复合物的乳化性分析
乳化活性(Emulsifying activity index,EAI)是用于评估蛋白质形成和保持乳液稳定状态的能力,乳化稳定性(Emulsifying stability index,ESI)反映了乳液抗油滴聚集和分散体在乳液中保持相分离的强度。如图4 所示,添加TS 后的复合物的EAI 显高于对照组SHP。随着TS 的增加,EAI 逐渐增加,当SHP与TS 比例达到1:2 时,EAI 达到最高(36.48 m2/g),可能是对SHP 进行复合处理后,SHP 的分子柔韧性增加[29],从而提高了乳化活性。然而,随着TS 的加入,ESI 值均高于对照组SHP,并呈现出先上升后下降的趋势,当SHP 与TS 比例达到1:1 时达到最高(822.11 min),此时的TS 浓度增加了溶液的乳化活性并使乳液更加稳定,乳液的稳定性可能与较小的液滴粒径和较低的ζ-电位值有关。SHP 在油滴表面的吸附属于物理吸附,SHP 的结构及表面疏水性的改变会影响SHP 吸附到油-水表面的能力[31]。此外,SHP 和TS 比例达到峰值时继续添加TS 会使SHP和TS 处于吸附竞争关系,从而出现液滴聚集和稳定性降低。
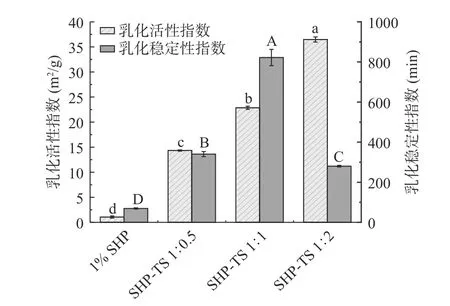
图4 SHP-TS 复合物乳液的乳化活性和乳化稳定性Fig.4 Emulsifying activity and stability of soy hydrolytic peptide-tea saponin complex
2.5 SHP-TS 复合物的DPPH 自由基清除率
DPPH 自由基清除率可以用来确定SHP-TS 复合物的抗氧化能力。如图5 所示,经过TS 复合后的SHP 比未处理的SHP 具有更高的抗氧化活性。随着TS 的占比增加,SHP-TS 复合物的DPPH 自由基清除率呈上升趋势,当SHP 与TS 的比例为1:2时,DPPH 自由基清除率最高(83.49%)。可能是由于TS 含有大量羟基,羟基可以作为供氢体与DPPH自由基结合形成DPPH-H 非自由基形式[7,25],提高了SHP 的抗氧化性。相似地,Huang 等[16]研究发现添加TS 可以提供更多的氢原子,DPPH 自由基清除率随着TS 浓度的增加而增强,从而提高了TS 与α-乳清蛋白复合物的抗氧化能力。

图5 SHP-TS 复合物对DPPH 自由基的清除率Fig.5 DPPH radical scavenging rate of soy hydrolytic peptidetea saponin complex
2.6 SHP-TS 复合物乳液的平均粒径分析
如图6 所示,与未处理的SHP 相比,添加TS 的乳液平均粒径明显减小,这说明添加TS 的乳液要比未添加的更加稳定。可能由于TS 的分子比蛋白质小,可以快速地附着到油-水界面上并快速形成液滴,从而表现出更好的乳化性能,TS 的加入明显改变了乳液的稳定性[32]。当SHP 与TS 比例达到1:1时,从208.13 nm 降低至146.63 nm,乳液稳定性高于其他对照组和空白组,与乳化稳定性结论一致。可能由于加入适度的小分子化合物影响了乳液液滴的粒径[33]。此外,在油量固定的情况下,随着乳化剂浓度的增加乳液液滴粒径很大程度上也会受到影响[34]。

图6 SHP-TS 复合物乳液的平均粒径Fig.6 Average particle size of soy hydrolytic peptide-tea saponin complex
2.7 SHP-TS 复合物乳液的ζ-电位分析
ζ-电位是用于度量颗粒间的相互吸引和相互排斥的强度,ζ-电位的绝对值越大,体系越稳定。如图7所示,添加TS 的SHP 乳液的ζ-电位绝对值均显著大于未处理的SHP 乳液的ζ-电位绝对值(15.13 mV),说明添加TS 的乳液体系具有更强的表面电荷分布,SHP 粒子间静电斥力越强,ζ-电位绝对值的增加表明蛋白质二级结构发生变化,这与傅里叶红外变换光谱的结果一致。随着TS 占比的增加,ζ-电位绝对值变化趋势为先上升后下降。SHP 与TS 添加比例为1:1 时,ζ-的绝对值最高(37.77 mV),说明乳液SHPTS 1:1 离子静电斥力较大,体系较为稳定,这也与乳液粒径结果一致。此外,当TS 占比继续增加时,乳液SHP-TS 1:2 的ζ-电位绝对值降低,可能是由于过量的TS 分子扩散到SHP 分子的界面孔中,产生竞争性的取代[35]。
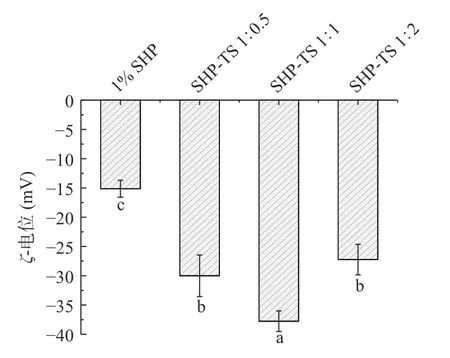
图7 SHP-TS 复合物乳液的ζ-电位Fig.7 ζ-Potential of soy hydrolytic peptide-tea saponin complex
2.8 SHP-TS 复合物乳液的激光共聚焦分析
激光共聚焦显微镜可以用来研究不同比例的SHP 与TS 复合物制备的乳液中乳液的颗粒大小、分散情况及乳液中的不稳定现象。如图8 所示,其中红色代表油相,绿色代表油滴表面吸附的蛋白质。SHP-TS 复合物稳定的乳液状态表现为球形液滴。添加TS 的SHP 乳液比未添加TS 的尺寸更小,稳定性更好,液滴聚集情况明显得到改善。可能是由于添加TS 后,静电斥力增强;疏水作用是SHP 和TS 之间的主要作用力,从而增加了油体之间的相互排斥[36]。这与乳液平均粒径、电位和乳液稳定性结果一致。当SHP 与TS 的比例为1:1 时,显示出更稳定的乳液,没有明显的聚集的颗粒,乳液的粒径也最小,可能是乳液SHP-TS 1:1 可以更好地稳定油-水界面,使得乳液的絮凝得到了良好的改善,阻止了相邻颗粒之间的聚集。当SHP 与TS 的比例为1:2时,可能是TS 和SHP 在界面处处于竞争状态,两种稳定机制不能有效进行,从而增加了凝聚的可能,从而导致乳液的不稳定[37]。
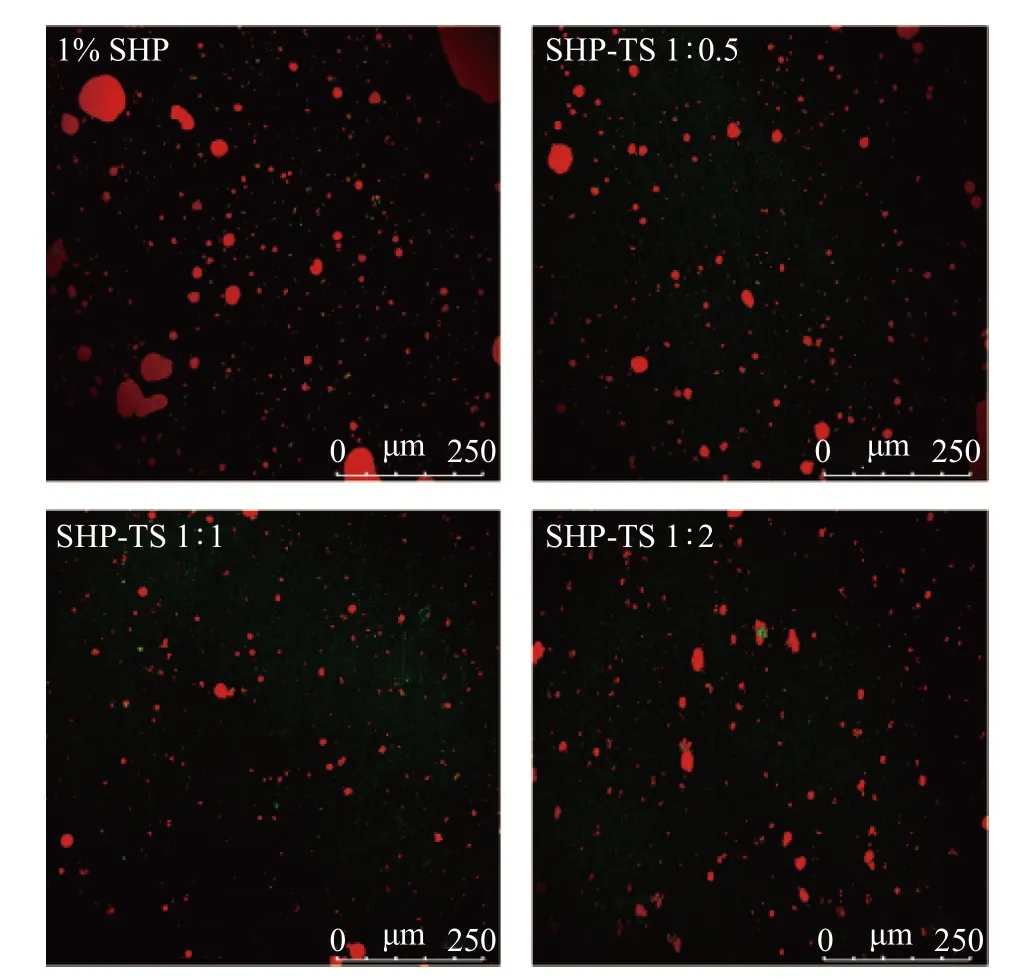
图8 SHP-TS 复合物乳液的激光共聚焦图Fig.8 Confocal laser confocal image of soy hydrolytic peptidetea saponin complex
3 结论
本研究表明,在适当的比例下TS 和SHP 有良好的协同作用,在SHP-TS 复合体系中,TS 和SHP发生强相互作用,其中氢键占主导地位;随着TS 的占比增加,芳香族氨基酸残基所在的微环境和结构发生改变,进一步证明了SHP 与TS 之间存在相互作用。TS 在一定程度上改善了SHP 的抗氧化性和乳化性。当SHP:TS=1:1 时制备出的乳液相较于SHP乳液有更小的平均粒径,ζ-电位绝对值最大,稳定性最好,分散更均匀,可以作为新型乳化剂应用于食品工业中,进一步拓宽SHP 在食品行业中的应用。

