基于TMT 技术对关中奶山羊初乳与成熟乳蛋白质组学研究
陈璐,余梦琦,袁宇欣,屈颖新,任新阳,沙日阿康,李广
(西北农林科技大学动物科技学院奶羊产业技术创新实验室,陕西 杨凌 712100)
0 引 言
羊奶含有多种营养成分,其乳蛋白主要由70%酪蛋白 (CN)[1]、25%乳清蛋白 (WP) 和5%乳脂肪球膜(MFGM)蛋白组成[2]。尽管全球约84%的奶由奶牛生产提供,但其他动物奶,如山羊奶仍对人们的生活和营养做出了极大贡献,尤其是在贫困地区,山羊养殖承担着帮助贫困人口脱贫致富和提供营养食品的重要作用。中国关中地区是关中奶山羊的主要生产区,其奶山羊饲养量达到240 余万只,年产奶量达到144 万t。因此山羊奶被认为是中国人饮食中不可或缺的重要组成部分[3]。詹姆斯等[4]报道羊奶中的5 种主要蛋白质(αS1-酪蛋白,αS2-酪蛋白、β-酪蛋白、β-乳球蛋白和α-乳清蛋白)非常类似于牛奶蛋白,其中αS1-酪蛋白被认为在牛奶过敏中起作用。至此,学者开始对山羊奶进行相关蛋白组学研究,确定山羊乳蛋白多态性的特征[5]。
目前,随着基因组学、蛋白组学等技术飞速发展,采用串联质谱标签(TMT)标记蛋白组学已经成为一种探索动物生长发育、疾病发生等生物学过程的重要技术手段,广泛应用于动物生产性状调控机制研究中[6]。随着蛋白质组学技术的不断发展,通过蛋白质组学技术可以比较不同品种的乳蛋白或者对相关蛋白质定性定量分析,以往蛋白组学研究主要集中在对牛奶蛋白质定性定量或者不同品种的乳蛋白上,然而对关中奶山羊羊奶不同泌乳阶段的蛋白质组学分析尚无研究报道[7-8]。为此,本研究采用基于TMT技术旨在探究关中奶山羊初乳与成熟乳蛋白质组学差异,对不同泌乳阶段的山羊乳蛋白成分和变化进行识别和分析。以探究关中奶山羊羊奶对特定人群的营养意义,为进一步探究特定功能乳产品配方的差异化研究提供科学依据。
1 材料与方法
试验动物均来自于陇县和氏羊场。样本采集严格按照中华人民共和国实验动物保护与利用标准,所有的操作均被西北农林科技大学动物保护协会批准。试验于2021 年10 月至2022 年6 月进行。
1.1 试验材料
从陕西陇县和氏高寒川乳业有限公司挑选相同环境下、体格健壮,日均产奶量(3.2±0.15)kg/d 的关中奶山羊18 只,采集初乳为2 d(A 组)和成熟乳为60 d(B组)的乳液,每组9 只羊,每3 只羊奶样混匀为混合乳,每组设3 个重复。采奶时间分别为早7 点和晚18点各一次,试验羊饲养管理采用常规饲喂管理方法,日均采食量为(3.00±0.5)kg/d。
1.1.1 试验试剂与设备
Q Exactive HF、EASY-nLC 1200 液相,Thermo Fisher;台式冷冻离心机,上海卢湘仪;SDS-PAGE 凝胶电泳仪,北京市六一仪器厂;酶标仪,上海科华实验系统有限公司;恒温混匀仪,上海净信实业发展有限公司;全自动数码凝胶图像分析系统,上海天能科技有限公司;eStain LG 蛋白染色仪,南京金斯瑞生物科技有限公司;高pH 分离液相色谱仪,Agilent。
TMTpro 16 标记试剂盒,ThermoFisher;BCA 试剂盒、质谱级水、乙腈、甲酸、未染色蛋白分子量marker,ThermoScientific;预制胶,金斯瑞;DTT、甘油、溴酚蓝、IAA,生工;胰酶,华利世;TEAB,Sigma;无水乙醇、异丙醇,GENERAL-REAGENT。
1.2 试验方法
1.2.1 样本前处理
将冷冻的样品取出200 μL,转移至1.5 mL 离心管中。加入丙酮沉淀蛋白后-40 ℃放置过夜。4 °C 下离心,收集沉淀。常温下干燥后溶解于样品裂解液中。再离心10 min,取上清,再次离心取上清。上清即为样品的总蛋白溶液,进行蛋白浓度测定并分装后储存于-80 °C 备用。向冻干样品中加入50 μL 100 mmol/L TEAB 缓冲液,涡流混匀,于1.5 mL Ep 管中进行标记反应。将冷藏后的TMT 试剂平衡到室温,加入88 μL无水乙腈,涡流5 min,离心。取41 μL TMT 试剂加到样品中,涡流混匀,室温放置1 h。加入8 μL 5%羟胺终止反应15 min,冻干后于-80 °C 保存。
1.2.2 样本液相色谱-质谱/质谱分析
色谱条件:样品以300 nL/min 的流速上样到预柱Acclaim PepMap 100 μm×2 cm (RP-C18,Thermo Fisher),再经分析柱Acclaim PepMap RSLC, 75 μm×50 cm (RP-C18,Thermo Fisher)分离。
质谱条件:一级MS 质量分辨率设为60 000,自动增益控制值设为3×106,最大注射时间为50 ms;质谱扫描设定为全扫描荷质比m/z 范围350~1 500,并对其中20 个最高峰进行MS/MS 扫描[9];所有MS/MS 图谱采集使用数据依赖型的正离子模式下的高能碰撞裂解完成,碰撞能量设为32;MS/MS 的分辨率设为45 000,自动增益控制设为2×105,离子最大注射时间为80 ms;动态排除时间设为30 s。
1.3 数据分析
数据采用Proteome Discover 2.4(Thermofisher公司)分析,利用数据库检索得到原始数据后,按照Score Sequest HT>0 且unique peptide≥1,并去除空白值的标准筛选可信蛋白。对可信蛋白结果进行统计并可视化;得到可信蛋白后经T-test 检验表现差异蛋白,差异筛选条件:Foldchange>1.2 且P<0.05;得到差异表达蛋白之后,对差异蛋白进行GO 富集分析,对其功能进行描述。利用KEGG 数据库对差异蛋白进行Pathway 分析(结合KEGG 注释结果),用超几何分布检验的方法计算每个Pathway 条目中差异蛋白富集的显著性并用P 值来表示,找出潜在富集通路途径。
2 结果与讨论
2.1 PCA 分析
由图1 可见,第一主成分(PC1) 的贡献率是37.95%,第二主成分(PC2)的贡献率是33.22%,2 组总贡献率是71.17%,从整体上能够反映2 组样本之间的代谢差异。从第一主成分方向看,A 组在第一主成分正轴上,B 组在第一主成分负轴上,从第二主成分方向看,B 组样本基本在中心线附近,A 组中2 个样本位于正半轴,一个样本位于负半轴,在PC2 表现出组间显著差异,在PC1 表现出组内聚集,说明2 组样本的差异主要体现在第二主成分上。样本在95%的置信区间内,且组间分离程度良好,说明该试验模型稳健可靠。
2.2 差异蛋白物筛选与鉴定
根据Foldchange(FC)≥1.2 且P<0.05,共筛选出241 个差异蛋白,其中80 个蛋白显著上调,161 个蛋白显著下调,如图2 所示。根据差异蛋白的FC 值大小,由大到小排列,显著上调蛋白和显著下调蛋白排名前15 的差异蛋白详细见表1 与表2。其中显著性上调蛋白中HPX(血红素结合蛋白)、THBS1(血小板反应蛋白)、CRP(c 反应蛋白)、MGP(基质Gla 蛋白)显著表达。HPX 具有抗氧化、保护神经、维持机体铁稳态、调控细胞内信号传递和基因表达及促血管生成等作用[10]。研究表明,THBS1 在肿瘤转移中起关键作用,异常的DNA 甲基化是调节THBS1 的机制之一,是一种新的急性髓系白血病血清预后因子,是AML 患者治疗的潜在治疗靶点,CRP 是炎症生物标志物,同时是与衰老相关疾病的重要影响因素。最近的研究表明,CRP 在多种疾病(高血压心血管和肾脏并发症,糖尿病性肾病以及急慢性肾脏疾病)中具有致病性[11]。MGP 是维生素K 依赖性蛋白,在骨骼和许多其他间充质细胞中合成,血管平滑肌细胞(VSMC)和软骨细胞也高度表达该蛋白,MGP 是一种良好的钙化抑制剂[12]。MGP 蛋白的表达有可能成为预测血管钙化(VC)进展的基因组生物标志物。显著性下调蛋白中LALBA、STOM 和GNB2 显著表达,LALBA(乳清蛋白)能够通过将半乳糖部分转化为葡萄糖来产生乳糖,具有强烈结合钙、锌离子、杀菌及抗肿瘤活性,LALBA 的折叠变体HAMLET[13],具有诱导肿瘤和未成熟细胞的凋亡的作用。STOM(气孔蛋白)编码的蛋白质定位于红细胞和其他细胞类型的细胞膜,可以调节离子通道和转运蛋白,STOM 定位缺失与遗传性口腔细胞增多症有关[14]。GNB2 表达降低可降低肿瘤细胞的增殖,其不同类型的突变可以激活许多规范的信号通路,并在包括急性髓性白血病和黑色素瘤在内的几种癌症类型中赋予对靶向激酶抑制剂的抗性[15]。

表1 显示上调的差异蛋白含量排名前15

表2 显示下调的差异蛋白含量排名前15
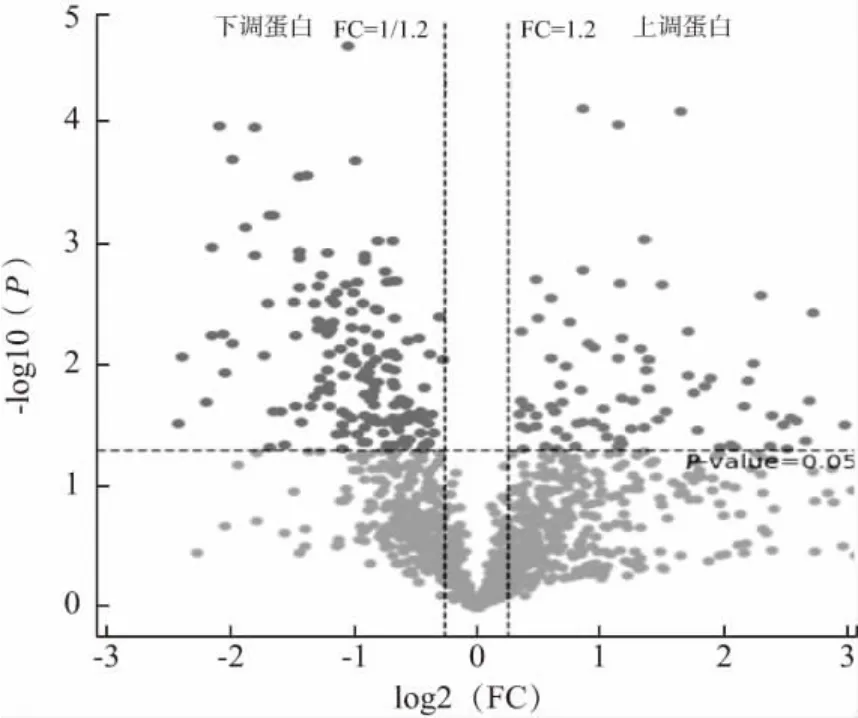
图2 关中奶山羊初乳组(A 组)和成熟乳(B 组)的差异蛋白
2.3 GO 富集分析
为了进一步分析A 组与B 组中差异蛋白的生物学意义,对其进行GO 富集分析,结果显示如图3,GO 条目被分为生物学过程(biologlcal process, BP)、细胞组成(cellular component, CC) 和分子功能[16](molecular function, MF)3 个部分,其中差异表达蛋白主要富集在Acute-phase response(急性期反应)、Lactose biosynthetic process(乳糖生物合成过程)、Ro protein signal transduction(Ro 蛋白信号转导)、Extracellular region(细胞外分区)、Extracellular space(细胞外隙)、Golgi apparatus (高尔基体)、GTPase activity(GTP 酶活性)、GTP binding(GTP 结合)等8 个类别方面。

图3 关中奶山羊初乳组(A 组)和成熟乳(B 组)的差异蛋白GO 功能富集
2.4 KEGG 通路富集分析
利用KEGG 数据库对差异蛋白进行Pathway 分析(结合KEGG 注释结果),按照每个条目对应的P值由大到小排序,前20 条潜在通路显示如图4。A 组和B 组的差异蛋白富集数目由大到小排列前5 条潜在通路依次是Ras 信号通路、趋化因子信号通路、补体通路、Rap1 信号通路和PPAR 信号通路。其中Ras信号通路中富集差异蛋白最为显著,研究表明,Ras 信号通路与GTP 的合成与分解密切相关[17]。Ras 蛋白也是GTPase 开关蛋白,活性状态对细胞的生长、分化、蛋白质运输和分泌等都具有影响。研究表明,癌细胞增殖时常利用活跃的Ras 通路[18],将Ras 进行突变,使得GAP 无法水解Ras 中的GTP[19],在没有GAP 帮助的情况下,GTP 水解时间会拉长,这意味着Ras 和GTP 相连的时间也会拉长,而Ras 将持续处于活跃状态中,不断地刺激下游通路,进而导致癌细胞的增殖[20]。在Ras 信号通路中,Ras、Rab5、Rho 差异蛋白显著下调,为探究其中关键因子抑制原癌基因表达提供新的思路和见解[21]。趋化因子是一个趋化蛋白大家族,在发育、体内平衡和炎症过程中控制白细胞迁移中起重要作用[22]。趋化因子信号通路传导始于配体-受体结合和通过GDP/GTP 交换激活受体相关的异源三聚体Gi 型G 蛋白[23],导致Gα-1 和Gβ-γ 亚单位的解离。Gβ-γ 亚单位激活1BPI 3-激酶和PLC-β(PLC)。1B PI 3-激酶类,由p101 调节亚单位和p110 催化亚单位组成,随后磷酸化并激活多种底物,包括Itk 和Akt,调节下游信号通路,促进细胞骨架重排、细胞存活、细胞生长和增殖。同时,PLC 水解PIP2 产生三磷酸肌醇(IP3)和二酰基甘油(DAG),分别触发钙动员和蛋白激酶C (PKC)激活。PKC 的激活导致IKK 的磷酸化,然后磷酸化IκB,促进其泛素依赖性蛋白酶体降解,并允许NF-κB 转运到细胞核并诱导基因表达。PKC 还磷酸化黏着斑激酶(FAK)和富含脯氨酸的酪氨酸激酶2(PYK2),2 种非受体蛋白酪氨酸激酶[24]。这2 种激酶磷酸化底物,如p130Cas 和桩蛋白,以促进黏着斑形成和分解、细胞骨架重组和细胞迁移。在Gβ-γ 亚单位激活这些细胞内信号通路的同时,解离的G 蛋白的Gα1-GTP 结合亚单位抑制腺苷酸环化酶,降低细胞内cAMP,并刺激Src 的激酶活性。Src 随后磷酸化多个下游底物,包括IA 类PI3-激酶、Itk、FAK、PYK2、ELMO-1 和Shc,Itk、FAK 和PYK2 参与调节细胞骨架重组和黏着斑形成[25],Src 磷酸化ELMO-1 激活信号通路,促进细胞运动所需的细胞骨架重组。此外,Src依赖的Shc 磷酸化导致GRB2-SOS 复合物的募集和Ras-MAPK 信号通路的激活,后者介导细胞存活、增殖和迁移。趋化因子信号通路不仅可以通过调节肿瘤微环境的免疫细胞组成,还可以通过调节肿瘤细胞增殖和转移参与调节抗肿瘤免疫。因此,趋化因子通路中的蛋白质可以作为治疗癌症和炎性疾病的治疗靶点,待进一步研究。
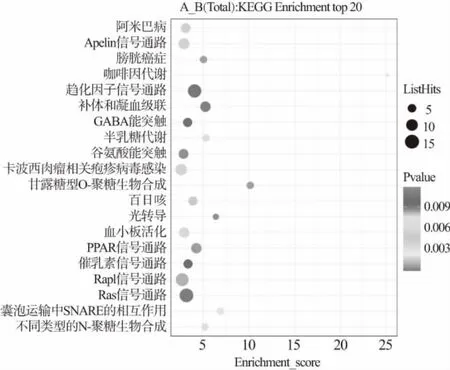
图4 关中奶山羊初乳组(A 组)和成熟乳(B 组)差异蛋白KEGG 通路功能富集
3 结 论
通过对山羊初乳和成熟乳进行蛋白组学分析,共筛选出241 个差异蛋白,其中80 个蛋白显著上调,161个蛋白显著下调。通过GO 富集分析,差异表达蛋白主要富集在Acute-phase response(急性期反应)、Lactose biosynthetic process(乳糖生物合成过程)、Ro protein signal transduction(Ro 蛋白信号转导)、Extracellular region(细胞外分区)、Extracellular space(细胞外隙)、GTPase activity(GTP 酶活性)、GTP binding(GTP结合)等8 个类别方面。KEGG 通路富集分析显示差异最显著的蛋白富集在Ras 信号通路、趋化因子信号通路、补体通路、Rap1 信号通路、PPAR 信号通路。研究结果揭示了山羊在不同泌乳期营养价值,确定了关中奶山羊羊奶对特定人群的营养意义以及在中国和其他地区山羊奶生产的经济影响,为预防癌症等特定功能化乳品的进一步研究提供科学依据。

