血清中MANF、Nesfatin-1水平在T2DM合并NAFLD患者中的变化及其相关性研究
汪惠敏,金国玺,方 言,朱闫慧,裴晓艳
(1.蚌埠医学院,安徽 蚌埠 233030;2.蚌埠医学院第一附属医院,安徽 蚌埠 233099)
T2DM患病人数占所有糖尿病总数的90%,近年由于青年人患病率显著上升使得其成为全球公共卫生及财政的一大难题,其发病率的增长主要是因为饮食及生活习惯的改变。NAFLD是一种发病率高达65%的慢性肝病,多项研究数据表明T2DM可以加速NAFLD的病情进展,使其从单纯的脂肪堆积逐渐发展成为更为严重的肝炎(non-alcoholic steatohepatitis,NASH)、肝硬化,如不及时干预及治疗,最终可发展为肝细胞癌[1]。NAFLD也会反作用于T2DM,加重胰岛素抵抗,从 而使糖脂代谢更加紊乱,导致发生糖尿病并发症的风险增加[2]或使已经存在的并发症更加严重。多年来,为了阐明NAFLD背后的免疫致病机制及其与T2DM的联系,人们做出了大量努力,胰岛素抵抗(insulin resistance,IR)似乎是两种疾病中出现的关键事件之一。MANF是一种新发现的因子,保留在细胞中并由内质网应激诱导分泌;Nesfatin-1是一种分泌性肽,主要在食物摄取等方面发挥调控作用;已有文献显示,二者皆参与了T2DM和NAFLD发病,但关于其在T2DM合并NAFLD中的具体作用较少报道。本研究主要探讨在T2DM合并NAFLD患者血清中Nesfatin-1、MANF的表达水平及其与疾病进展的关系。
1 研究对象及分组
1.1 研究对象选取30例在本院体检的符合标准的志愿者作为健康对照组(A组);同时选取本院内分泌与代谢疾病科2021年12月至2022年7月收治住院的符合T2DM诊断标准的149例患者为研究对象,根据NAFLD诊断标准分为单纯T2DM(即肝脏无脂肪变性)54例(B组)以及T2DM合并NAFLD 95例(C组);根据NAFLD的严重程度又将T2DM合并NAFLD组分为轻度脂肪肝、中度脂肪肝、重度脂肪肝三个亚组。
1.2 诊断标准及排除标准
1.2.1 T2DM诊断 根据世界卫生组织(World Health Organization,WHO)诊断标准[3]:符合糖尿病的典型症状并同时符合以下三种情况的任意一种:(1)随机血糖(任意时段)≥11.1 mmol/L;(2)空腹(禁食至少8 h)血糖≥7.0 mmol/L;(3)口服75 g葡萄糖耐量试验(oral glucose tolerance test,OGTT)2 h血糖≥11.1 mmol/L,无糖尿病典型症状者择期复查确认。
1.2.2 NAFLD诊断 符合2010年《非酒精性脂肪性肝病诊疗指南》诊断标准[4]同时根据Fibroscan-502 Touch仪器所得数值,将控制衰减参数(controlled attenuation parameter,CAP)≥238 db/m定义为NAFLD。
1.2.3 NAFLD的分度 采用无创肝纤维化诊断仪(FibroScan-502 Touch)进行检测,以CAP值为NAFLD的分度标准:(1)肝脏无脂肪变(脂肪变性<11%):CAP值<238 db/m;(2)轻度脂肪肝(脂肪变面积≥11%):238 db/m≤CAP值<260 db/m;(3)中度脂肪肝(脂肪变面积≥34%):260 db/m≤CAP值<293 db/m;(4)重度脂肪肝(脂肪变面积≥67%):CAP值≥293 db/m。
1.2.4 排除标准 过量饮酒史(男性摄入量>140 g/周,女性摄入量>70 g/周);病毒型肝病和自身免疫型肝病;1型糖尿病、妊娠期糖尿病、特殊类型糖尿病;合并重症感染(如重症肺炎、呼吸窘迫综合征)、糖尿病急性并发症及血液系统疾病(如血小板减少、白血病)等机体代谢状况严重紊乱。
1.3 研究方法
1.3.1 血生化指标检测 采集空腹静脉血(禁食至少8 h)送至检验科使用生化分析仪检测:丙氨酸氨基转移酶(alanine aminotransferase,ALT)、总胆固醇(total cholesterol,TC)、甘油三酯(triglyceride,TG)、总胆红素(total bilirubin,TBIL)、门冬氨酸氨基转移酶(aspartate aminotransferase,AST)、低密度脂蛋白(low density lipoprotein,LDL-C)、高密度脂蛋白(high-density lipoprotein,HDL-C)、脂蛋白a、游离脂肪酸(free fatty acid,FFA);高效液压色谱法检测糖化血红蛋白(glycosylated hemoglobin,HbAlc),放免法检测空腹血糖(fasting plasma glucose,FPG)、空腹胰岛素(fasting serum insulin,FINS)。
1.3.2 计算胰岛功能评估指标 胰岛功能抵抗指数(homa insulin-resistance,HOMA-IR)=FINS×FPG/22.5;胰岛功能分泌指数(Insulin secretion function index,HOMA-β)=20×FINS/(FPG-3.5)。
1.3.3 采用酶联法检测Nesfatin-1、MANF、IL-6水平 试剂盒采用双抗体一步夹心法酶联免疫吸附试验(ELISA)。往预先包被Nesfatin-1、MANF、IL-6抗体的包被微孔中,依次加入标本、标准品、HRP标记的检测抗体,经过温育并彻底洗涤。用底物TMB显色,TMB在过氧化物酶的催化下转化成蓝色,并在酸的作用下转化成最终的黄色。颜色的深浅和样品中的Nesfatin-1、MANF、IL-6呈正相关。用酶标仪在450 nm波长下测定吸光度,计算样品浓度。
1.3.4 体格指标测定 测量患者的身高(cm)、体重(kg),跟据公式计算体质指数(body mass index,BMl)=体重(kg)/身高(m)2。
1.3.5 标准化代谢疾病管理中心(Center for Standardized Metabolic Disease Management,MMC)检测 采用内脏脂肪测量装置(HDS-2000)检测皮下脂肪面积以及内脏脂肪面积。
1.4 统计学方法分析采用SPSS 25.0统计软件对数据进行分析处理,符合正态分布的计量资料以“均数±标准差”的形式表示,数据间的比较采用单因素方差分析;非正态分布的数据以中位数(四分位间距)表示,用非参数检验法分析;最终采用多元Logistic回归分析T2DM合并NAFLD的影响因素,统计结果以P<0.05为差异有统计学意义。
2 结果
2.1 一般资料及相关生化指标的比较三组人群在性别、年龄、病程、身高、AST、ALT、TBIL上差异无统计学意义(P>0.05),在内脏脂肪、皮下脂肪、体重、BMI水平上差异有统计学意义(P<0.05)。进行事后多重检验显示:与A组相比,B组在内脏脂肪、皮下脂肪、BMI水平上显著升高,差异有统计学意义(P值分别是0.000、0.000、0.044,t值分别是8.153、11.941、2.024);与A组相比,C组内脏脂肪、皮下脂肪、体重、BMI水平升高,差异有统计学意义(P值分别是0.000、0.000、0.000、0.000,t值分别是15.820、19.468、3.821、4.633);与B组相比,C组在内脏脂肪、皮下脂肪、体重、BMI水平升高,差异有统计学意义(P值分别是0.000、0.000、0.014、0.000,t值分别是4.711、3.716、2.487、4.242)(如表1)。
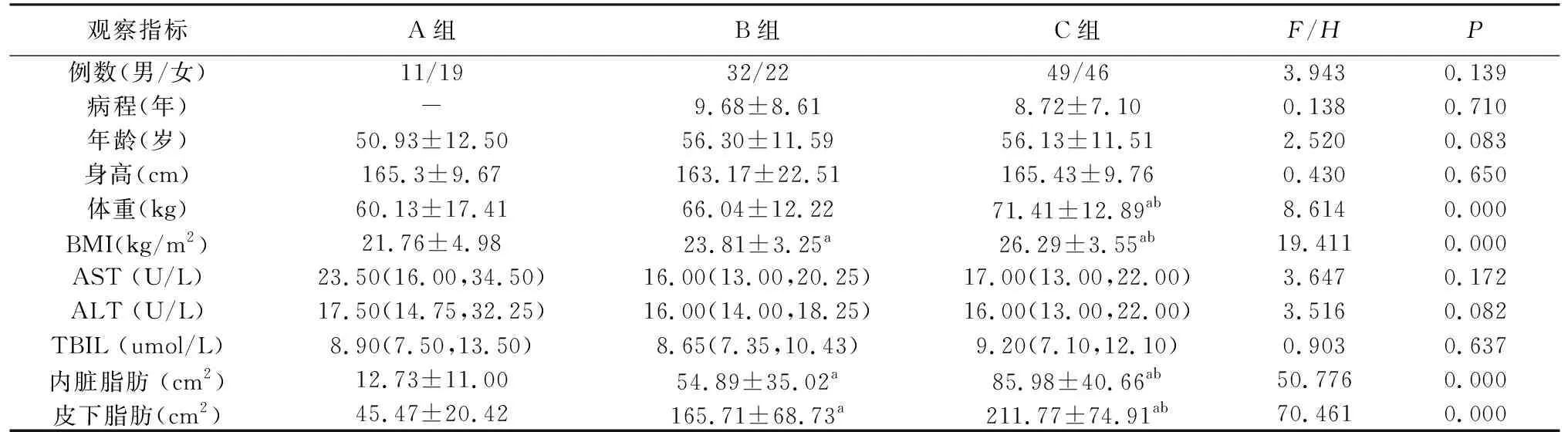
表1 一般资料及生化指标的比较
2.2 糖脂代谢指标的比较三组人群在HDL、LDL、脂蛋白a水平上差异无统计学意义(P>0.05),在HbA1c、FPG、TC、FFA、IL-6、FIns、HOMA-IR、HOMA-β、MANF、Nesfatin-1水平差异有统计学意义(P<0.05)。经事后多重比较分析显示:与A组相比,B组在HbA1c、FPG、TC、FFA、IL-6水平显著升高,差异有统计学意义(P值分别为0.000、0.000、0.025、0.033、0.000,t/z值分别是13.252、5.003、2.278、2.545、5.673),在FIns、HOMA-IR、HOMA-β、MANF、Nesfatin-1水平降低,差异有统计学意义(P值分别是0.000、0.015、0.000、0.000、0.003,t/z值分别是-4.427、-2.816、-6.410、-3.631、-3.071);与A组相比,C组在HbA1c、FPG、TC、TG、IL-6、FINs水平升高,差异有统计学意义(P值分别为0.000、0.000、0.023、0.000、0.000,t/z值分别为17.907、6.611、2.305、4.468、7.894),在FIns、HOMA-β、MANF、Nesfatin-1水平降低,差异有统计学意义(P值分别为0.000、0.000、0.000、0.024,t/z值分别为-5.814、4.078、5.540、-2.652);与B组相比,C组在FIns、TG、HOMA-IR水平升高,差异有统计学意义(P值分别为0.024、0.001、0.007,t/z值分别为2.656、3.570、3.052),在Nesfatin-1水平降低,差异有统计学意义(P=0.022,t=-2.308)(如表2)。
2.3 T2DM合并NAFLD组各亚组间指标比较三组在FIns、BMI、皮下脂肪、HOMA-IR、MANF、Nesfatin-1、IL-6水平差异有统计学意义(P<0.05)。经事后多重检验显示:与轻度组相比,中度组MANF水平减低,差异有统计学意义(P=0.012,t=2.602);与轻度组相比,重度组在FIns、BMI、皮下脂肪、HOMA-IR、IL-6水平升高(P值分别为0.021、0.007、0.034、0.012、0.000,t/z值分别为-2.690、2.793、-2.529、-2.882、5.110),MANF、Nesfatin-1水平减低(P值分别为0.001、0.001,t值分别为-3.599、-3.457),差异有统计学意义;与中度组相比,重度组IL-6水平升高,差异有统计学意义(P=0.001,t=3.603)(如表3)。

表3 T2DM合并NAFLD组各亚组间指标的比较
2.4 多元Logistic回归分析T2DM合并NAFLD严重程度的影响因素将有统计学意义的指标纳入多元有序Logistic回归,将因变量T2DM合并NAFLD的严重程度(轻度、中度、重度)进行赋值,经多元有序Logistic回归分显示:MANF、IL-6与T2DM合并NAFLD严重程度的密切相关(P<0.05),MANF是T2DM合并NAFLD的保护性因素,IL-6是T2DM合并NAFLD的危险性因素。(如表4)
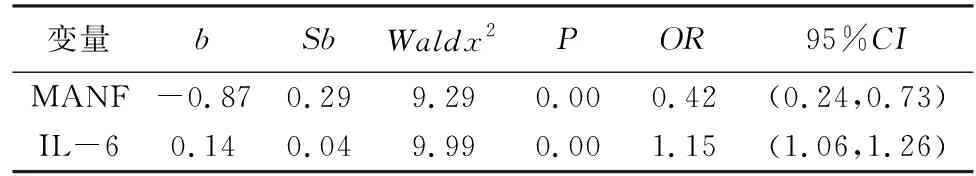
表4 多元回归分析T2DM合并NAFLD严重程度的影响因素
3 讨论
NAFLD是全球慢性肝病的常见原因,主要以肝脂肪变性为特征[5]。相关临床研究表明,NAFLD是T2DM的主要危险因素,且通常作为T2DM患者的并发症发现[6],事实上,有研究表明90%的T2DM患者会合并NAFLD,且T2DM患者NASH的患病率是无T2DM患者的3倍。NAFLD与2型糖尿病之间存在双向关系[7],T2DM增加NAFLD发展成NASH和肝纤维化的风险[8],NAFLD也会增加发生T2DM神经系统、心血管系统等并发症的风险[9]。
MANF是新发现的一种神经营养因子,也是一种定位于内质网的可溶性分泌蛋白[10]。MANF最初被发现是一种在各种肿瘤中高度突变的蛋白,其后被发现在帕金森、脑出血、代谢性疾病中也发挥作用。近年的研究表明,MANF不仅在食物摄取和维持稳态[11]中发挥作用,同时还参与调节肝脏代谢。有研究学者证明,MANF表达在NAFLD早期增加,随后在高FFAs刺激下逐渐降低。MANF缺乏增加了脂肪生成并加重了HepG2细胞脂肪变性,而MANF过表达抑制了脂肪生成并从FFAs诱导的脂肪变性中拯救了HepG2细胞。因此MANF是肝脂肪变性过程中的潜在治疗靶点[12]。T2DM的特征在于外周组织中的胰岛素抵抗和胰岛素分泌缺陷,代谢功能障碍和胰腺β细胞死亡引起的高血糖状态[13],当胰岛β细胞不能补偿胰岛素抵抗的程度,就会导致导致代谢应激,包括线粒体氧化和内质网应激激活未折叠蛋白(unfolded protein response,UPR),Lindahl等人的研究[14]发现MANF可保护β细胞免受内质网应激诱导的细胞死亡,同时他们还发现,过表达MANF可以增强β细胞增殖减少细胞死亡。这表明MANF在糖尿病β细胞保护和再生中起着重要作用。
Nesfatin-1是一种与食物摄入相关的新肽,主要起调控作用,且在中枢和外周组织中广泛表达[15]。有研究学者发现Neaftin-1可以通过抑制氧化应激及细胞凋亡,从而减轻高糖诱导状态下PC12细胞损伤,从而减轻糖尿病神经并发症;Nakata M等研究发现[16],Nesfatin-1可以通过增强胰岛β细胞中L型Ca2+通道的敏感性促进Ca2+内流,释放更多胰岛素,从而在调节葡萄糖稳态中发挥调节作用[17],同时脂类代谢、调节胃肠功能[18]、心血管及生殖功能也与它相关。最新报道还显示,Nesfatin-1具有强大的抗炎,抗凋亡和抗氧化能力,可以改善几种疾病的症状[19],如脑缺血再灌注、帕金森、溃疡性结肠炎等。目前关于Nesfatin-1在T2DM合并NAFLD患者中的具体作用机制国内外多项研究结论均不相同,国外有研究表明T2DM患者存在低Nesfatin-1状态[20];国内有研究则显示T2DM患者Nesfatin-1的水平较正常人相比是升高的[21]。同时Nesfatin-1可以通过血脂代谢、调节血糖和葡萄糖转化等过程,加剧脂肪肝的发生,增加NAFLD的发病风险,国内有学者通过高脂喂养构建NAFLD大鼠模型,发现Nesfatin-1参与NAFLD大鼠代谢紊乱与肥胖的过程。
IL-6是一种炎性因子,炎症介质通过激活NF-κB途径并增强IL-6的敏感性,导致细胞炎症,最终导致细胞凋亡,有研究显示MANF,Nesfatin-1可能通过抗炎、抗凋亡等机制,从而抑制T2DM合并NAFLD的发展。
本研究结果显示,三组患者间血清MANF、nesfatin-1水平存在显著差异,且在不同程度的T2DM合并NAFLD患者间也存在差异,相关性研究提示血清MANF、Nesfatin-1与IL-6呈负相关,MANF与Nesfatin-1呈正相关,Logistic回归提示MANF、IL-6是疾脂肪肝的重要影响因素。
综上所述,由于脂肪肝进展为NASH的可能性很高,尤其是合并多种并发症时,因此早期评估和治疗T2DM合并NAFLD势在必行。血清MANF、Nesfatin-1参与T2DM合并NAFLD的发生发展且与疾病严重程度密切相关,同时也为治疗T2DM合并NAFLD提供了新思路。

