Hsa_circ_0000741对乳腺癌癌细胞增殖、迁移和侵袭的影响及分子机制
马思源,张博超,朱 萍,赵晓晓,浦 春
(1.皖南医学院第一附属医院检验科;2.皖南医学院检验学院,安徽 芜湖 241000)
乳腺癌(Breast Cancer,BC)是女性中最常见的恶性疾病,严重威胁着全世界女性的健康[1]。乳腺癌是由于女性(或男性)乳房中导管或小叶细胞的恶性转化引起的,其遗传、表型和形态异质性对肿瘤的增殖、迁移和侵袭有影响[2]。环状RNA(circRNA)是一类新的内源性调节RNA,其特征是共价闭合的环状结构,缺乏多腺苷酸化的尾巴,能够在转录或转录后水平上调节基因表达[3]。最近的研究发现,circRNA可能参与多种癌症的调控机制,包括结直肠癌、肝细胞癌、乳腺癌和胰腺导管腺癌[4]。CircRNA可参与乳腺癌的多种病理过程,使用circRNA作为乳腺癌生物标志物正在得到认可[5-6]。Has_circ_0000741作为一个新的circRNA,目前在乳腺癌中的作用机制不明,本研究旨在探寻has_circ_0000741是否影响乳腺癌细胞的增殖、迁移和侵袭。
1 材料与方法
1.1 材料乳腺癌癌细胞株MCF-7、MDA-MB-231购自中国科学院上海细胞库;胎牛血清、DMEM培养基(南美Gibico);胰蛋白酶(biosharp公司);逆转录和荧光定量PCR试剂盒 (宝生物工程(大连)有限公司和宝日医生物技术(北京)有限公司); PCR引物 (生工生物工程(上海)股份有限公司);Trizol 试剂(生工生物工程(上海)股份有限公司);siRNA(广州锐博生物技术有限公司);锐博转染试剂(广州锐博生物技术有限公司);Transwell小室、基质胶(美国BD公司);CCK-8试剂盒(上海碧云天生物技术有限公司);结晶紫染液(sigma-aldrich西格玛奥德里奇贸易有限公司)。
1.2 方法
1.2.1 生物信息学 利用GEO数据库中GSE182471和GSE165884数据集中的circRNA表达量数据,并利用R语言中的limma包对circRNA数据集分析,得出hsa_circ_0000741一系列的差异显著基因,明确hsa_circ_0000741在乳腺癌与癌旁组织中表达的显著差异。
1.2.2 细胞处理与分组 使用含有青霉素/链霉素双抗的10% FBS(Fetal bovine serum)的高糖DMEM在37 ℃,5% CO2的条件下培养乳腺癌细胞系MCF-7、MDA-MB-231,分别将si-nc、si-circ_0000741通过lipo2000试剂转染至MCF-7、MDA-MB-231细胞中,37 ℃,5% CO2的条件下孵育1 d,记为 si-nc组、si-circ_0000741组,并测定各组hsa_circ_0000741表达量,观察si-circ_0000741组表达量是否下降。
1.2.3 qRT-PCR 使用TRIzol试剂提取si-nc、si-circ_0000741组MCF-7、MDA-MB-231细胞的总RNA,反转录成cDNA,按试剂盒说明进行PCR;采用2-△△Ct法计算相对表达量,hsa_circ_0000741引物的正向序列为5′-tggtccctcgcatgattgtcac-3′,反向序列为5′-gagttggctgccggttgaag-3′。
1.2.4 CCK-8实验 取生长良好的MCF-7、MDA-MB-231细胞接种于96孔板,每组设置5个复孔,每个复孔接种6 000个细胞,每组转染后,分别于培养0 h、24 h、48 h、72 h、96 h时,每孔加入10 μL CCK-8溶液, 37 ℃培养1 h,使用酶标仪于450 nm处测定光密度(optical density,A)值。
1.2.5 集落形成实验 对于集落的形成进行测定,将1×103数量MCF7和MDA-MB-231细胞接种到6孔板中。孵育2周后,用多聚甲醛固定菌落30 min,并在室温下用0.1%结晶紫(Sigma)染色。对细胞菌落进行计数和成像。
1.2.6 划痕实验 取生长良好的MCF7和MDA-MB-231细胞接种至6孔板,24 h后各组分别进行转染,待细胞长到100%汇合度时,用200 μL无菌枪头划破细胞的中轴,移液管吸取用PBS冲洗滑落下来的细胞,保证边缘整齐,倒置显微镜下观察拍照,用无菌吸头加入无血清培养基继续培养。并在0 h、24 h和48 h 3个时间点,使用倒置显微镜拍摄伤口愈合情况。
1.2.7 Transwell实验 将100 μL稀释的Matrigel胶加入transwell小室上方,置于培养箱中孵育2 h。将1.5×105数量的各组MCF7和MDA-MB-231细胞悬浮在200 μL无血清培养基中,并接种到Transwell的上室中。使用500 μL含有20%FBS的DMEM细胞培养基培养基填充下室。将细胞在37 °C的5% CO2培养箱中孵育24 h,孵育后,用棉签除去顶部室中的细胞,并用多聚甲醛固定侵入下表面的细胞,用0.1%结晶紫染色,并在显微镜下以100×放大倍率拍照。
1.3 统计分析用SPSS 17.00、GraphPad Prism 8.0统计学软件进行统计学分析。计量资料以“均数±标准差”表示,两组独立样本之间的比较采用t检验的方法,以P<0.05表示差异有统计学意义。
2 结果
2.1 hsa_circ_0000741在GEO数据集中差异表达数据集GSE182471中的5个乳腺癌组织和5个相邻正常乳腺组织中具有显着差异表达的cirrna(|Fold change|>2,adj.Pvalue<0.05)共978个(图1A),在数据集GSE165884中的4个乳腺癌组织和4个相邻正常乳腺组织中具有显着差异表达的cirrna(|Fold change|>2,adj.P.value<0.05)共575个(图1B),将两个数据集筛选出的差异基因取交集得到111个circRNA(图1C)。
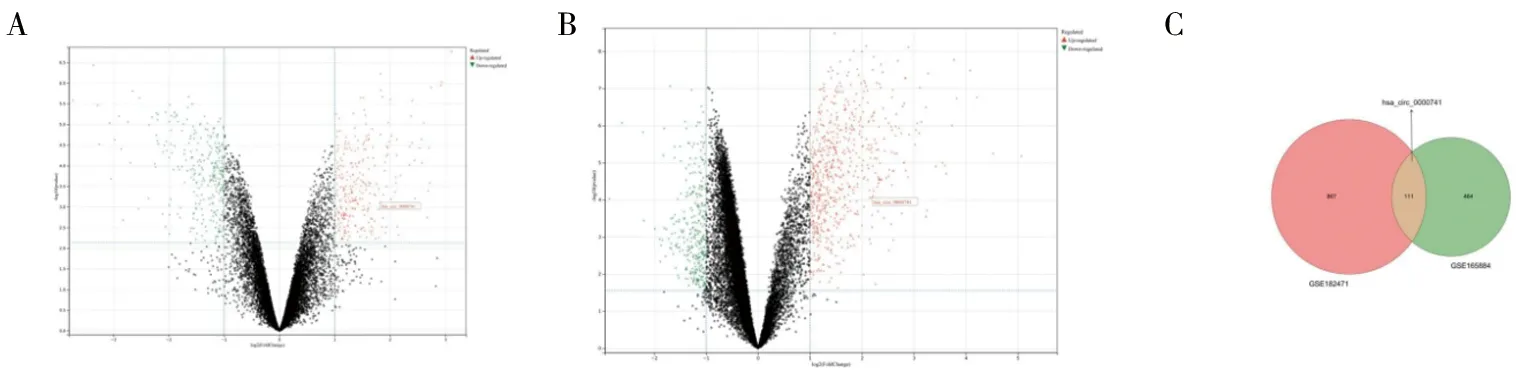
图1 数据集筛选差异基因
2.2 hsa_circ_0000741表达在乳腺癌细胞系高于正常乳腺细胞提取生长状态良好的MCF-7、MDA-MB-231乳腺癌细胞系与正常乳腺细胞MCF-10A细胞的总RNA进行qRT-PCR,以MCF-10A的结果为对照可以发现hsa_circ_0000741在乳腺癌细胞系中的表达量比在正常细胞系中的表达量有显著提高,MCF-7中的表达量为MCF-10A中的2.17倍,MDA-MB-231中的表达量是MCF-10A中的3.9倍(图2)。
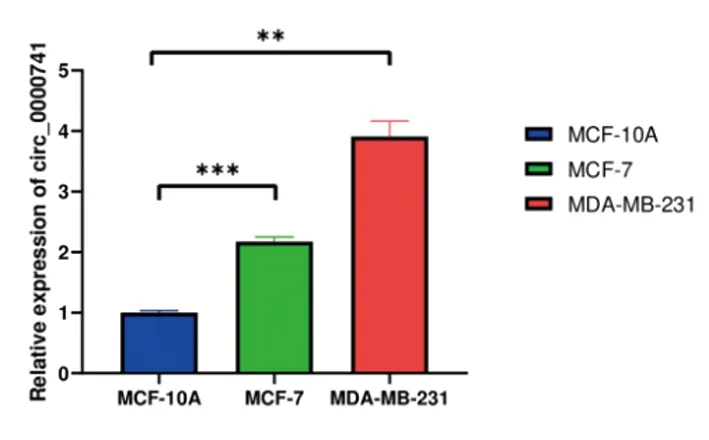
图2 Hsa_circ_0000741在MCF-10A、MCF-7、MDA-MB-231三种细胞中的表达量
2.3 hsa_circ_0000741敲低乳腺癌细胞株的构建提取转染24 h的si-nc、si-circ_0000741组MCF-7、MDA-MB-231细胞的总RNA进行qRT-PCR检测siRNA的转染效率,qRT-PCR结果显示,以si-nc为对照,转染了si-circ_0000741后,MCF-7细胞中hsa_circ_0000741表达水平显著降低3.7倍,MDA-MB-231细胞中hsa_circ_0000741表达显著下调3.4倍,表明si-circ_0000741转染成功(图3)。
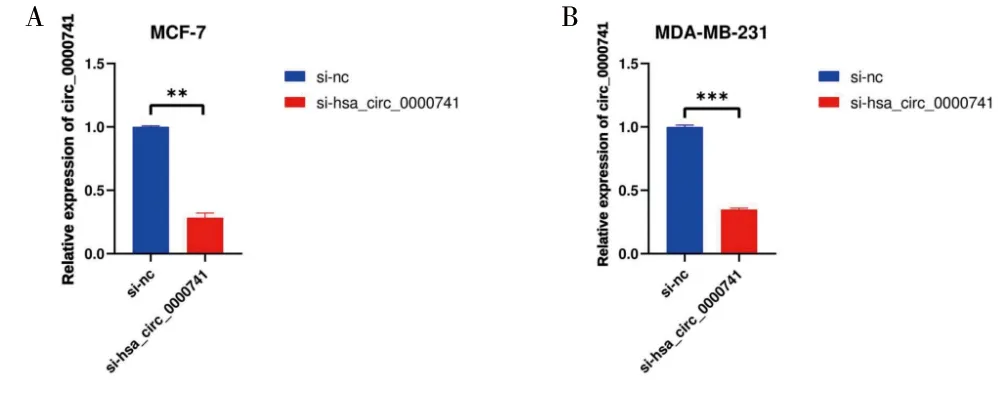
图3 Si-hsa_0000741在MCF-7和MDA-MB-231中的转染效率
2.4 hsa_circ_0000741的表达促进了乳腺癌细胞的增殖集落形成实验中,si-hsa_circ_0000741组所形成的乳腺癌细胞集落明显少于control和si-nc组,其中以control组形成集落数最多(图4A、4C),而在CCK-8实验中,与control和si-nc对照组相比,转染了si-hsa_circ_0000741的细胞OD值的增长速率明显落后,表面其增殖速度明显落后于control和si-nc组,其中以control组增殖速率最为显著(图4B、4D)。
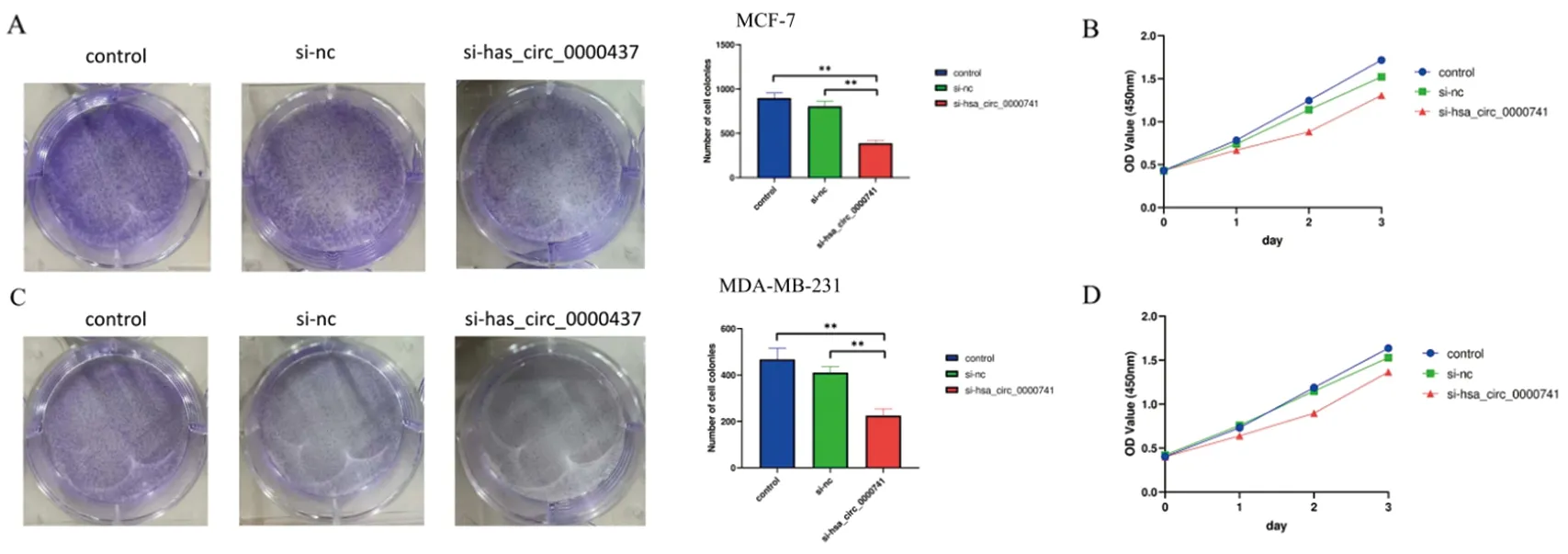
图4 转染si-hsa_circ_0000741后的集落形成和增殖能力
2.5 hsa_circ_0000741的表达促进乳腺癌细胞的迁移、侵袭划痕实验显示si-circ_0000741组乳腺癌细胞的愈合速率要显著低于control和si-nc组,癌细胞的迁移速率显著下降,其中control组愈合速率最快(图5A、5C),通过侵袭实验可以发现si-circ_0000741组迁移到下室的乳腺癌细胞要少显著少于control和si-nc组,而control组迁移到下室的细胞数目最多,癌细胞侵袭能力显著削弱(图5B、5D)。

图5 转染si-hsa_circ_0000741后的增殖和侵袭能力
3 讨论
乳腺癌是全世界女性中最常见的恶性肿瘤,约70~80% 的早期非转移性疾病患者可治愈[7],近年来我国的乳腺癌发病率逐年攀升,根据最新统计数据,我国每年新增乳腺癌患者约42万人,已成为中国女性高发恶性肿瘤之一,而伴有远处转移的晚期乳腺癌往往被认为无法治愈。根据分子和组织学证据,乳腺癌可分为三组;激素受体阳性(HR+)、HER2+和三阴性乳腺癌(TNBC)(ER+++-,PR-,HER2-)[8-9],与其他乳腺癌组相比,其中TNBC的治疗最具挑战性。对于乳腺癌来说,最重要的预后指标是腋窝淋巴结转移的存在和数量。然而,腋窝淋巴结受累的程度并不能决定疾病的结局[10],另外两个重要的预后指标是;肿瘤大小和肿瘤分级已被广泛使用,由于我们正在经历个性化治疗的时代,这些判断预后的独立指标(肿瘤大小、肿瘤分级和淋巴结转移)已经不足以对乳腺癌患者进行早期诊断[11-12]。近年来,许多研究致力于寻找和验证分子生物标志物,以作为预后和预测生物标志物。
环状RNA(circRNAs)是由称为外显子反剪接的过程产生的共价闭合RNA分子,与信使RNA相比,缺乏聚腺苷酸化的尾巴[13]。circRNA在真核生物中含量很高,其中许多是进化保守的[14]。CircRNA通常被归类为非编码RNA(ncRNA),尽管一些circRNA具有蛋白质编码潜力[15-16],是由于circRNA具有独特的共价闭合结构,其中的开放阅读框在剪接位点上循环,甚至超过其长度,所以可以产生长>100个氨基酸的蛋白质[17-18]。CircRNA由于其独特的结构和其他特性而参与各种生物过程[19]。CircRNA最突出的功能是充当miRNA海绵的能力,另外还参与转录调控或剪接、蛋白质的翻译,并且还能与RNA结合蛋白相互作用。CircRNA已经被证明它们调节疾病的发展和发生[20-22],最近的证据表明,circRNA的异常表达几乎发生在所有癌症类型中,并且在癌症发病机制中起着不可或缺的作用,无论是作为促癌基因还是肿瘤抑制因子[23]。例如,zhou等[24]发现Circ-MBOAT2可以通过调控胰腺癌中miR-433-3p/GOT1轴促进肿瘤进展和谷氨酰胺分解代谢,liu等[25]探究出circ-BNC2(hsa_circ_0008732)通过调控microRNA-223-3p/ FBXW7轴抑制卵巢癌的进展,这两项研究都是针对circRNA与miRNA结合从而通过ceRNA机制影响肿瘤的发生发展。另外Feng等[26]探究出circ-HuR与CCHC型锌指核酸结合蛋白(CNBP)相互作用,随后抑制其与HuR启动子的结合,导致HuR下调和肿瘤进展的抑制,wang等[27]的研究表明hsa_circ_0068631的上调可以通过与RNA结合蛋白EIF4A3结合来维持c-Myc mRNA的稳定性,从而促进BC的进展。
越来越多的研究表明,癌症患者及其相应健康对照组之间circRNA的表达水平及其模式存在显着差异,这表明人类中的各种circRNA分子可能代表监测癌症诊断和进展的新型生物标志物[28]。随着RNA测序技术和现代生物信息学的快速发展,人们对于癌症中表达量与正常组织有显著差异的circrna研究更加深入,越来越多参与癌症进程的circRNA被鉴定出来,现在人们对于乳腺癌中circrna的探究也引入了大量的生物信息学手段。Li等[29]通过从基因表达综合数据库中下载了微阵列数据集GSE101123,然后分析了BC组织中与邻近组织中差异表达的circrna,我们证明了circ_0000514在BC组织中上调,circ_0000514敲低可以抑制BC细胞的增殖、迁移和侵袭;kang等[30]通过分析数据集GSE101123发现hsa_circ_0000518在BC组织和细胞中异常上调,并通过实验证明了circ_0000518在BC中具有致癌性,并通过miR-1225-3p/SOX4轴起作用;zhang等[31]通过分析微阵列数据集GSE111504发现与癌旁对照组相比,hsa_circ_0000129在乳腺癌组织中的表达水平显着提高,通过实验hsa_circ_0000129过表达显着增加了细胞增殖,迁移和集落形成,hsa_circ_0000129的致癌分子机制可能与乳腺癌中EZH2表达上调有关。
本研究通过对于数据集GSE182471和GSE165884进行研究发现hsa_circ_0000741在两个数据集中均呈现出在癌组织的表达量比相应癌旁组织高的趋势,目前并没有相关文献对其研究,接下来在提取正常细胞株与癌细胞株对比后发现其在细胞中也符合该趋势,通过敲减hsa_circ_0000741后通过集落、CCK-8、划痕和侵袭实验发现敲减hsa_circ_0000741可以抑制乳腺癌细胞的增殖、迁移和侵袭,hsa_circ_0000741在乳腺癌中可能起到促癌机制,对于hsa_circ_0000741的促癌机制,通过对hsa_circ_0000741下游基因预测发现hsa-miR-379-5p与hsa_circ_0000741有结合位点,并且hsa-miR-379-5p在乳腺癌中呈现显著下降趋势,对其进行生存分析后发现hsa-miR-379-5p高表达有利于患者预后,由此推断hsa-miR-379-5p可能与hsa_circ_0000741存在海绵作用,为hsa_circ_0000741的下一步研究提供思路。

