紫色辣椒HN191与二荆条的比较代谢组分析
谭华强,铁曼曼,李丽平,鲁荣海,潘绍坤,唐有万,*
(1.成都市农林科学院,四川 成都 611130;2.芦山县农业农村局,四川 雅安 625600)
辣椒是茄科辣椒属的一年生或多年生草本植物,原产于中南美洲,大约在16世纪后期传到中国,是一种重要的蔬菜作物[1]。近年来我国辣椒种植面积稳定在210万 公顷以上,成为中国种植面积最大的蔬菜,总产量达6 400多万吨,产值2 500亿 元,在脱贫攻坚和乡村振兴方面发挥重要的作用[2]。
颜色是辣椒果实的重要外观和品质特征。辣椒果实具有丰富的颜色,并且颜色会在果实的不同发育阶段发生变化。在未成熟时期,辣椒果实的颜色主要有白色、绿色、紫色和黑色,随着果实的发育逐渐变为黄色、橙色、红色和棕色[3-4]。研究表明,辣椒果实的颜色主要取决于叶绿素、类胡萝卜素、类黄酮及花青素的类型和含量[5]。
代谢组学综合定性和定量的方法检测生物系统内所有代谢物,包括某一生化途径的底物或代谢产物,因此是分析细胞调节功能的有力工具[6-7]。核磁共振、气相色谱-质谱和液相色谱-质谱(liquid chromatography-mass spectrometry,LC-MS)是用于代谢组分析的常规技术[8]。LC-MS目前在代谢组学研究中备受青睐,因为它集成了液相色谱的色谱能力和质谱仪器提供的高灵敏度、准确性和丰富的结构信息[9]。近年来,代谢组学已广泛应用于辣椒果实代谢物的研究中[10-15]。然而,目前对于紫色辣椒果实颜色相关的代谢组分析报道仍然很少。
随着生活水平不断提高,富含花青素的紫色蔬菜越来越受到关注。自然界中大部分辣椒的未熟果均为绿色或浅绿色,少数辣椒材料的未熟果中有花青素积累,呈现紫色。HN191是本课题组选育的朝天椒材料,未熟果呈紫色、老熟果呈红色,于2020年通过四川省非主要农作物品种认定委员会认定。二荆条辣椒是四川著名地方品种,其未熟果为绿色,老熟果为红色。本研究采用基于LC-MS的非靶向代谢组学方法,研究HN191和二荆条在果实未熟期和老熟期代谢物种类和含量的变化,为优良辣椒品种的选育及开发利用提供参考。
1 材料与方法
1.1 材料与试剂
以课题组选育的紫色辣椒新材料HN191,以及二荆条品种为研究对象。挑选饱满的辣椒种子,浸种8 h,然后放置在湿纱布上进行催芽。待种子露白后播种于育苗穴盘中,置于人工气候箱中培养,温度26 ℃,16 h光照、8 h黑暗。苗期结束将幼苗移栽至成都市农林科学院羊马基地大棚,进行常规田间管理。在开花结果期从植株中上部取花后30 d(未熟果)和60 d(老熟果)的果实,用小剪刀将样品剪切为100 mg的若干份,液氮速冻后,保存于-80 ℃超低温冰箱中备用。
甲醇、乙腈(均为色谱纯)默克化工技术(上海)有限公司;L-2-氯苯丙氨酸(纯度≥98%)上海阿拉丁生化科技股份有限公司;甲酸(色谱纯)日本东京化成工业株式会社。
1.2 仪器与设备
Acquity I-Class PLUS液相色谱仪、Xevo G2-XS QTOF高分辨质谱仪、Acquity UPLC HSS T3色谱柱(2.1 mm×100 mm,1.8 μm)美国沃特世公司。
1.3 方法
1.3.1 代谢物提取
取紫色辣椒材料HN191花后30、60 d的果实(简称为HN30、HN60),以及二荆条花后30、60 d的果实(简称为EJT30、EJT60),共4 组样本,每组6 个果实(即6 个生物学重复),合计24 个果实样品进行代谢组测定。取100 mg辣椒果实样品,加入1 mL含内标L-2-氯苯丙氨酸的提取液(甲醇、乙腈、水体积比2∶2∶1,内标质量浓度20 mg/L),涡旋混匀30 s。加入钢珠,45 Hz研磨仪处理10 min,超声10 min(冰水浴)。-20 ℃静置1 h,在4 ℃、12 000 r/min离心15 min。取出500 μL上清液于另一干净的EP管中,真空浓缩,加入160 μL提取液(乙腈、水体积比1∶1)复溶,涡旋30 s,冰水浴超声10 min。4 ℃、12 000 r/min离心15 min,取120 μL上清液于2 mL进样瓶,从每个样品中各取10 μL混合成质量控制(quality control,QC)样本上机检测。
1.3.2 色谱条件
使用Acquity UPLC HSS T3色谱柱(2.1 mm×100 mm,1.8 μm),柱温为40 ℃,流速为0.4 mL/min,流动相A为水溶液(含体积分数0.1%甲酸),B为乙腈(含体积分数0.1%甲酸),进样体积为2 μL。梯度洗脱条件同张文友等[16]的方法。
1.3.3 质谱条件
使用正离子模式结合负离子模式,优化后的参数:毛细管电压2 500 V(正离子模式)或-2 000 V(负离子模式),锥孔电压30 V,离子源温度100 ℃,脱溶剂气温度500 ℃,反吹气流速50 L/h,脱溶剂气流速800 L/h,m/z采集范围50~1 200。
1.4 数据分析
使用MassLynx V4.2采集原始数据,通过Progenesis QI软件进行峰提取、峰对齐、归一化、谱图解析等步骤,代谢物的鉴定来源于在线METLIN数据库及百迈客自建库。采用主成分分析(principal component analysis,PCA)、正交偏最小二乘判别分析(orthogonal partial least squares-discriminant analysis,OPLS-DA)等多元统计分析区分各组间代谢的总体差异。以OPLS-DA模型的变量重要性投影(variable importance in projection,VIP)>1,差异显著性P值(P<0.05)以及含量差异倍数(fold change,FC)(|FC|>2)为标准筛选差异代谢物,进行层次聚类分析和京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)通路富集分析[17-18]。整个流程在百迈客云平台(https://www.biocloud.net/)完成。
2 结果与分析
2.1 QC分析
QC分析是评价基于质谱技术的代谢组学数据质量与可靠性的重要环节[19]。本研究的QC样本由每个样品各取10 μL混合组成,通过检测得到正、负离子模式下的质谱总离子流(total ion current,TIC)重叠图(图1)。可见QC样本总离子流重叠性好,峰分离度高,表明仪器稳定性较好,得出的数据结果可靠。

图1 QC样本的总离子流重叠图Fig.1 Overlapping TIC chromatograms of QC samples
2.2 PCA结果
对24 个样本进行代谢组定性和定量分析,在正、负离子模式下共检测到了20 733 个峰,其中注释到3 439 个代谢物。PCA是一种无监督模式识别的多维数据统计分析方法,通过将原有复杂数据进行重新线性组合,形成一组新的综合变量,使其尽可能多地反映原有变量的信息,从而达到降维目的[20]。对EJT30、EJT60以及HN30、HN60四个分组共24 个样品检测出的所有代谢物进行PCA,结果如图2所示。PC1的贡献率为36.97%,PC2的贡献率为14.71%,2 种PC贡献率之和为51.68%,表明2 个PC基本能够反映辣椒果实样品的主要特征信息。QC样本紧密聚集在中心位置,进一步表明检测仪器的稳定性较好,所获数据质量较高。4 组辣椒果实样品被明显分为4 个区域,没有重叠,表明2 个品种未熟果和老熟果之间的代谢物差异显著。同时每组组内样品均聚集在95%置信区间内,表明组内样品的重复性较好。

图2 HN191和二荆条30、60 d果实代谢组的PC得分图Fig.2 PCA score plot of metabolomes from Erjingtiao and HN191 at 30 and 60 days after anthesis
2.3 OPLS-DA结果
PCA法虽能够有效提取主要信息,但是对于相关性较小的变量不敏感。为了突出组间差异,便于后续寻找差异成分,采用OPLS-DA法对数据进行分析[17]。HN30 vs EJT30、HN60 vs EJT60、HN60 vs HN30三个分组全部样品都位于置信区间内,并且两两之间区分明显,表明彼此之间具有显著差异(图3)。参数和都大于0.98,置换检验结果显示拟合回归线斜率为正,且从左到右大部分红色点均低于蓝色点,说明评估模型没有发生过拟合。以上结果表明OPLS-DA模型稳定可靠,可根据VIP值分析筛选差异代谢物。

图3 3 个辣椒果实比对组的OPLS-DA得分图(A)和置换检验图(B)Fig.3 OPLS-DA score (A) and permutation test plots (B) of comparison groups of three peppers
2.4 差异代谢物鉴定
基于OPLS-DA模型,以VIP>1、|FC|>2以及P<0.05为阈值筛选差异代谢物。结果在HN30 vs EJT30组(EJT30为对照)中鉴定出1 065 个差异代谢物,其中551 个上调,514 个下调。在HN60 vs EJT60组(EJT60为对照)鉴定出1 010 个差异代谢物,其中641 个上调,369 个下调。在HN60 vs HN30组(HN30为对照)鉴定出1 487 个差异代谢物,其中650 个上调,837 个下调。这些差异代谢物主要包括其他次级代谢物合成、氨基酸代谢、辅因子和维生素代谢、萜类和聚酮类化合物代谢、脂类代谢、碳水化合物代谢、核苷酸代谢七大类(图4A)。

图4 3 个辣椒果实比对组的差异代谢产物数量统计和分类(A)以及Venn图(B)Fig.4 Statistics and classification plot (A),and Venn diagram (B) of differential metabolites in comparison groups of three peppers
2.5 差异代谢物聚类分析
为了更直观地展示代谢物在不同样品之间的变化情况,对HN30 vs EJT30、HN60 vs EJT60、HN60 vs HN30三个比对组的差异代谢物含量进行层次聚类分析(图5)。颜色表示含量,绿色表示含量下调,红色表示含量上调。横向是代谢物的聚类,聚类枝越短代表相似性越高,聚在一簇的代谢物具有相似功能或共同参与同一代谢途径。纵向是样品的聚类,每个品种在30 d或60 d大小的果实样品均聚为一类,且差异代谢物含量非常接近,表明组内样品重复性较好。而差异代谢物在3 个比对组两两之间的含量差别较大,说明彼此之间存在较大差异。该结果与PCA结果(图2)基本一致。
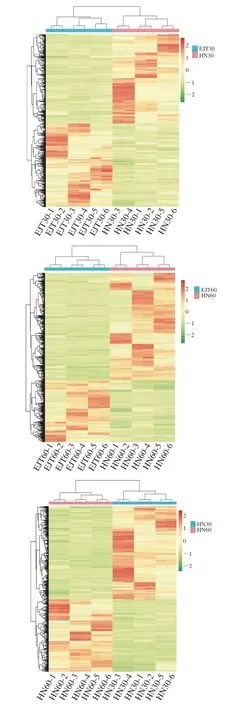
图5 3 个辣椒果实比对组的差异代谢物聚类分析Fig.5 Cluster analysis of differential metabolites in comparison groups of three peppers
2.6 差异代谢物富集分析
KEGG富集作为一种功能分析方法,能从海量数据中挖掘显著富集的代谢通路,从而诠释其生物学意义[20]。利用clusterProfiler选用超几何检验的方法对差异代谢物KEGG的注释结果进行富集分析,并绘制柱形图[21]。图6展示了3 个比对组中P值最小的前20 个富集通路。在HN30 vs EJT30组,KEGG数据库注释456 个差异代谢物,包含差异代谢物最多的前5 条KEGG通路分别是吲哚生物碱生物合成(ko00901)、ABC转运器(ko02010)、黄酮与黄酮醇生物合成(ko00944)、各种植物次生代谢产物的生物合成(ko00999)、苯丙烷生物合成(ko00940)。在HN60 vs EJT60组,KEGG数据库注释450 个差异代谢物,包含差异代谢物最多的前5 条KEGG通路分别是类黄酮生物合成(ko00941)、黄酮和黄酮醇生物合成(ko00944)、ABC转运器(ko02010)、异黄酮生物合成(ko00943)、氨基糖和核苷酸糖代谢(ko00520)。在HN60 vs HN30组,KEGG数据库注释630 个差异代谢物,包含差异代谢物最多的前5 条KEGG通路分别是异喹啉生物碱生物合成(ko00950)、卟啉代谢(ko00860)、各种植物次生代谢物的生物合成(ko00999)、黄酮和黄酮醇生物合成(ko00944)、花青素生物合成(ko00942)。

图6 3 个辣椒果实比对组差异代谢物的KEGG通路富集图Fig.6 KEGG pathway enrichment map of differential metabolites in comparison groups of three peppers
2.7 类黄酮相关差异代谢物
从KEGG富集结果可以看出,3 个辣椒果实比对组的差异代谢物均富集到类黄酮相关的通路。类黄酮是一种重要的次生代谢物,广泛参与植物的生理过程以及花、果实和种子颜色的形成[22]。因此,挑选出3 个比对组类黄酮相关通路的差异代谢物绘制其含量热图(图7)。

图7 3 个辣椒果实比对组在类黄酮相关代谢通路的差异代谢物含量热图Fig.7 Heatmap of differential metabolites related to flavonoid biosynthesis pathway from comparison groups of three peppers
在类黄酮生物合成通路中,总共有28 个差异代谢物,其中二氢杨梅素、绿原酸、根皮苷、芹菜酚、柚皮素等21 种代谢物在HN191的30、60 d果实中的含量均高于二荆条。
在异黄酮生物合成通路中,总共有21 个差异代谢物。与二荆条30 d果实相比,HN30中的5-羟基拟人参皂苷元、丙二酰染料木素、甘果素等16 种代谢物含量明显较高,其余5 种代谢物含量较低。与二荆条60 d果实相比,HN60中的大豆黄酮苷、芒柄花素苷、大豆黄素苷等16 种代谢物含量明显较高,其余5 种代谢物含量较低。
在花青素生物合成通路中,总共有25 个差异代谢物。与二荆条30 d果实相比,HN30果实中的飞燕草素、矢车菊素3-O-β-D-桑布糖苷、天竺葵素3-葡萄糖苷5-咖啡酰葡萄糖苷等11 种代谢物含量明显较高,其余14 种代谢物含量较低。与二荆条60 d果实相比,HN60中的天竺葵素3-O-葡萄糖苷、矢车菊素3-O-芸香糖苷5-O-β-D-葡萄糖苷、飞燕草素5-O-β-D-葡萄糖苷3-O-β-D-桑布糖苷等13 种代谢物含量明显较高,其余12 种代谢物含量较低。
在黄酮与黄酮醇生物合成通路中,总共有35 个差异代谢物。与二荆条30 d果实相比,HN30中的山柰酚-3-O-芸香糖苷、芹菜素7-O-β-D-葡萄糖苷、芸香苷等16 种代谢物含量明显较高,其余19 种代谢物含量较低。与二荆条60 d果实相比,HN60中的槲皮素3-O-葡萄糖苷、木犀草素7-O-葡糖苷酸、紫云英苷等19 种代谢物含量明显较高,其余16 种代谢物含量较低。
与HN30相比,在HN60中上述4 个通路中分别有10、19、11 个和9 个代谢物含量出现上调,其余代谢物则出现下调。
3 讨论
3.1 2 个品种果实在不同发育期的差异
HN191和二荆条在果形、果色(主要是未熟果颜色)、单果质量等方面存在明显差异。HN191是朝天椒,单果质量约4 g。二荆条是线椒,单果质量约10 g。本研究分析HN191和二荆条在花后30、60 d果实的代谢组。PCA结果显示,2 个品种得到明显区分,没有重叠。差异代谢物含量的热图也显示2 个品种果实之间的代谢物含量差异明显。不同辣椒品种,特别是不同果型品种之间,果实代谢物差异较大,比如牛角形和圆珠形辣椒[13]。不同果色的品种之间,代谢物差异也较大,比如黄灯笼辣椒和红灯笼辣椒、红色鸡泽辣椒和橙红色韩国辣椒[14-15]。这些报道与本研究结果一致。
在同一辣椒品种果实不同发育阶段,也存在较大的代谢组差异。辣椒果实在发育和成熟过程中会在颜色、香气、营养成分和软化方面发生重大变化。这些变化的发生是由于各种生化和生理过程的改变,包括基因表达、酶活性改变和代谢物合成[23-24]。HN30和HN60的PCA结果显示,不同发育期的果实被明显区分。代谢物含量热图也显示HN30和HN60代谢物的含量差异明显。在一些报道中也得到相似的结果[10-11,13],表明辣椒果实在成熟过程中代谢物发生剧烈变化。
3.2 类黄酮差异代谢物
根据VIP>1、|FC|>2以及P<0.05为阈值,在HN30 vs EJT30、HN60 vs EJT60、HN60 vs HN30三个比对组分别鉴定出1 065、1 010、1 487 个差异代谢物。KEGG富集分析表明,这些差异代谢物均富集到类黄酮相关的通路。类黄酮是一种酚类次生代谢物,广泛存在于谷物、水果、蔬菜、茶叶中。由于其具有抗氧化、抗炎、抗诱变和抗癌的特性,以及调节关键细胞酶功能的能力,对人体健康有益,成为各种营养保健品、药品和化妆品中不可或缺的成分[25]。现已从各种植物中分离出5 000多种不同植物来源的类黄酮[26]。类黄酮分为几个亚组,包括黄酮、黄酮醇、黄烷酮、黄烷醇、异黄酮、花青素[27]。
辣椒果实具有丰富的颜色,颜色差异主要是由于类黄酮和类胡萝卜素的积累不同所致[28]。在之前的研究中,已经报道了一些从辣椒果实中鉴定的黄酮类化合物。Jang等[11]对辣椒“CM334”果实发育过程中的次级代谢物进行分析,鉴定出8 种黄酮类化合物,其在果实发育早期阶段(花后16 d和25 d)含量较高,然后逐渐下降。Mi Si等[15]分析鸡泽辣椒和韩国辣椒成熟果实的代谢组,发现韩国辣椒上调最高的10 种代谢物中,有7 种黄酮类化合物。本研究在2 个辣椒品种中也鉴定出槲皮素、芹菜素、山柰酚、木犀草素、柚皮素及其衍生物等黄酮类物质。
Liu Yuhua等[12]为探究辣椒果实颜色形成的机理,对4 种不同颜色的辣椒品种代谢组和转录组谱进行分析,其中CJ12-17-1(圆锥椒、30 d为紫色、50 d为红色)和0622-1-3-2-1-3-1(线椒、30 d为绿色、50 d为红色)两个品种,与本研究的材料最为接近;2 个品种在30 d和50 d鉴定出的大多数差异类黄酮代谢物均在CJ12-17-1中含量更高。本研究结果与之类似,在类黄酮生物合成和异黄酮生物合成通路中,2 个品种之间的多数差异类黄酮代谢物也在紫色辣椒HN191中的含量更高,这些结果表明紫色辣椒类黄酮物质含量更加丰富。
3.3 花青素差异代谢物
花青素作为一种重要的色素,在未成熟辣椒果实颜色形成中起着至关重要的作用。花青素的积累导致未成熟辣椒果实呈现紫黑色[5]。在紫色辣椒果实中被鉴定出的花青素主要是飞燕草素及其衍生物[29-31]。在本研究中,从HN30 vs EJT30、HN60 vs EJT60、HN60 vs HN30三个比对组中总共鉴定出花青素合成通路的25 个差异代谢物,包括6 种飞燕草素衍生物、6 种矢车菊素衍生物、8 种天竺葵素衍生物。与二荆条30 d果实相比,3 种飞燕草素衍生物,飞燕草素、飞燕草素-3-(P-酰基)-芸香糖苷-5-葡萄糖苷、飞燕草素3-葡萄糖苷5-咖啡酰葡萄糖苷;2 种矢车菊素衍生物,矢车菊素3-O-芸香糖苷5-O-β-D-葡萄糖苷和矢车菊素3-O-β-D-桑布糖苷;2 种天竺葵素衍生物,天竺葵素3-葡萄糖苷5-咖啡酰葡萄糖苷和天竺葵素3-O-β-D-桑布糖苷在HN30中含量较高。飞燕草素、矢车菊素、天竺葵素衍生物在HN191未熟果中的大量积累使其呈现紫色,这与Liu Yuhua等[12]的报道基本一致。此外,紫色辣椒的花青素含量在花后20~30 d的果实中达到最大值,而在果实成熟后降解[30,32]。在HN191果实成熟过程中(即HN60 vs HN30),上述7 种代谢物的含量明显下降,与果实花青素的积累与降解模式一致。
4 结论
本研究使用基于LC-MS的非靶向代谢组学分析方法,研究紫色辣椒材料HN191和二荆条在未熟期和成熟期果实中的差异代谢物,并对差异代谢物进行代谢通路富集分析,发现在类黄酮生物合成和异黄酮生物合成通路中的多数差异类黄酮代谢物在紫色辣椒HN191中的含量更高。另外在花青素生物合成通路中发现的7 种飞燕草素、矢车菊素、天竺葵素衍生物在HN191未熟果中大量积累,可能是紫色辣椒HN191花青素合成的关键代谢物。这些结果表明,紫色辣椒除了花青素含量高以外,黄酮类物质含量也更加丰富,适合进一步的开发和利用。在后期研究中,还需要在非靶向代谢组学的基础上,利用靶向代谢组学对紫色辣椒中的类黄酮代谢物作进一步的定性和定量研究。

