玉米皮纤维发酵培养黑曲霉和肉原毛平革菌的产酶分析
刘玉春,郭 超,王 超
(国家粮食和物资储备局科学研究院,北京 100037)
玉米皮是玉米深加工的主要副产物之一,通常用作饲料原料[1],而玉米皮中纤维含量约为70%。与软木、硬木等其他来源纤维相比,玉米皮纤维(corn bran fiber,CBF)具有独特的单糖组成和结构特征,即半纤维素质量分数达到68%[2],且支链化程度高,木质素含量低[3]。目前,已有将玉米皮作为固态发酵原料用于固态发酵产木聚糖酶等的研究报道[4]。
黑曲霉(Aspergillus niger)是国际公认的GRAS(generally regarded as safe)菌株[5-6],被广泛用于传统发酵食品和酿造。A.niger具有强大的蛋白质折叠、修饰及胞外蛋白分泌能力[7],已成为发酵工业的重要出发宿主和细胞工厂。A.niger在酶制剂生产方面应用广泛,如超过30 种以上的食品酶是由A.niger发酵生产,包括纤维素酶、木聚糖酶、淀粉酶、糖化酶、果胶酶等[8-10]。A.niger能够以粮油加工副产物等生物质为原料发酵产酶[11],而这些生物质原料的成分和结构也会影响A.niger的胞外酶分泌表达。许尧兴等[12]报道培养基组成对A.niger产α-半乳糖苷酶的影响。Afangide等[13]报道玉米皮成分对A.niger发酵产木聚糖酶的影响。目前,随着基因工程、分子生物学等技术应用于A.niger改造,使A.niger成为微生物研究领域的主要课题之一[14-17]。
肉原毛平革菌(Phanerochaete carnosa)是一种白腐真菌,属于Phanerochaete sensu stricto,最早从香脂冷杉(Abies balsamea)中分离获得[18]。P.carnosa具有典型的白腐真菌底物偏好性[19],其糖苷水解酶表达活性与黄孢原毛平革菌(P.chrysosporium)相似。但与大多数白腐菌不同,P.carnosa几乎完全从软木中分离获得[20]。P.carnosa除具有完整的木质纤维素降解酶系编码基因外,其还具有独特软木降解酶基因,如锰过氧化物酶、半纤维素酶和糖蛋白降解酶基因[20]。Jurak等[21]研究P.carnosa利用云杉及白杨木培养基生长的转录组差异,发现锰过氧化物酶基因(MnP)为该菌株转录丰度最高的基因。Mahajan等[22]对P.carnosa在纤维素和云杉底物上生长的胞外蛋白质组进行研究。
发酵底物的成分和结构能够影响微生物的生长、胞外酶的分泌表达[23]。国内外针对P.carnosa的研究报道很少,且主要集中在P.carnosa对软木的降解。目前,鲜见以CBF为碳源发酵培养A.niger和P.carnosa,以及对两种真菌的蛋白质组进行分析的相关报道。本研究以CBF为碳源,应用前期筛选获得的A.niger和P.carnosa进行发酵培养,分析发酵液中还原糖含量、蛋白质量浓度、木聚糖酶和α-L-阿拉伯呋喃糖苷酶活性变化规律,并应用无标记蛋白质组技术分析与CBF降解相关胞外酶系的分泌表达情况,旨在为以CBF作原料制备具有半纤维素降解优势的复合酶制剂、酶法水解CBF制备功能性低聚阿拉伯木聚糖提供基础,促进玉米皮的增值利用。
1 材料与方法
1.1 材料与试剂
玉米皮由河北广玉淀粉糖业有限公司提供;A.niger和P.carnosa为本实验室筛选保存的菌株。
木糖、桦木木聚糖 爱尔兰Megazyme公司;乙酸乙酯 上海阿拉丁生化科技股份有限公司;3,5-二硝基水杨酸、酒石酸钾钠 国药集团化学试剂有限公司;蛋白质浓度测定试剂盒 北京索莱宝科技有限公司;对硝基苯基-α-L-阿拉伯呋喃糖苷(4-nitrophenylα-L-arabinofuranoside,pNPAf)、对硝基苯酚(p-nitrophenol,pNP)美国Sigma-Aldrich公司。
1.2 仪器与设备
MQD-SIR单层小容量振荡培养箱 上海旻泉仪器有限公司;SynergvHT酶标仪 美国BioTek公司;电泳仪、凝胶成像仪 美国Bio-Rad公司;1200高效液相色谱仪(配紫外检测器)美国Agilent公司。
1.3 方法
1.3.1 CBF提取和培养基制备
CBF提取参照Lee等[2]方法,玉米皮干燥粉碎后过60 目筛,粉碎后玉米皮与正己烷混合搅拌30 min,搅拌结束后倒掉上层正己烷,重新添加正己烷搅拌,共重复3 次。取100 g脱脂玉米皮,按1∶15(g/mL)加入蒸馏水,再加入耐高温α-淀粉酶,95 ℃水浴处理1 h;随后水浴温度降至55 ℃,加入糖化酶处理2 h,充分脱除淀粉。再加入中性蛋白酶,55 ℃反应1 h,随后加热至100 ℃灭酶5 min;纱布过滤,滤渣用蒸馏水洗涤2 次后干燥。
CBF培养基[24]:蛋白胨1.0 g/L、尿素0.2 g/L、CaCl20.3 g/L、MgSO4·H2O 0.3 g/L、(NH4)2SO44.2 g/L、KH2PO42.0 g/L、0.2%(V/V)微量元素(CoCl20.2 g/L、MnSO4·4H2O 1.6 g/L、ZnSO4·7H2O 1.4 g/L、FeSO4·7H2O 5.0 g/L)、10 g/L玉米皮纤维;121 ℃灭菌20 min后备用。
1.3.2A.niger和P.carnosa培养及发酵上清液蛋白分析
A.niger和P.carnosa经PDA平板活化后,接种于200 mL CBF培养基,30 ℃、200 r/min诱导培养。每隔12 h取发酵液样品,12 000 r/min离心10 min,取上清液,进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfatepolyacrylamide gel electrophoresis,SDS-PAGE)分析。
1.3.3 理化指标的测定
1.3.3.1 还原糖含量和蛋白质浓度测定
将不同培养时间的发酵上清液适当稀释,取200 μL样品,加入300 μL DNS试剂,沸水浴10 min后冷却,在540 nm波长处测定吸光度。按照试剂盒说明书采用BCA法测定发酵液蛋白质量浓度。
1.3.3.2 木聚糖酶活性测定
将20 μL 适当稀释发酵上清液加入180 μL 0.5 g/100 mL预热的桦木木聚糖底物,水浴5 min;再加入300 μL DNS试剂,沸水煮10 min,冷却至室温;在540 nm波长处测定吸光度。每分钟分解底物生成1 μmol还原糖所需的酶量定义为1 个酶活单位(U)[25]。
1.3.3.3α-L-阿拉伯呋喃糖苷酶活性测定
将20 μL发酵液加入180 μL 2 mmol/L pNPAf底物中,40 ℃反应10 min;加入300 μL 1 mol/L Na2CO3溶液终止反应,在405 nm波长处测定吸光度。以不同浓度pNP溶液与1 mol/L Na2CO3溶液混合,绘制标准曲线,根据标准曲线方程计算酶水解底物后pNP的生成量,每分钟分解底物生成1 μmol的pNP产物所需的酶量定义为1 个酶活力单位(U)[24]。
1.3.4 CBF单糖和酚酸组成测定
1.3.4.1 单糖组成测定
参照1-苯基-3-甲基-5-吡唑酮(1-phenyl-3-methyl-5-pyrazolone,PMP)(甲醇溶解)柱前衍生-高效液相色谱法[26]。称取20 mg CBF样品,加入30 mL水,缓慢加入亚铁氰化钾溶液和乙酸锌溶液各5.0 mL,再加水至80 mL,室温振荡1 h后离心,滤纸过滤,定容至100 mL。取200 μL样品加入0.5 mL 4 mol/L三氟乙酸溶液,在120 ℃水解2 h,氮气吹干;再分别加入0.3 mol/L NaOH溶液和0.5 mol/L PMP各0.5 mL,70 ℃水浴60 min,冷却至室温;再加入0.5 mL 0.3 mol/L HCl溶液,随后加入0.5 mL氯仿,振荡摇匀后静置20 min,弃去下层氯仿层,萃取3 次除去多余的PMP衍生剂,上层水相过膜,进行高效液相色谱分析。混合标准品由葡萄糖、木糖、阿拉伯糖、甘露糖、鼠李糖、葡萄糖醛酸、半乳糖醛酸、半乳糖、岩藻糖和核糖10 种单糖和乳糖内标(均为20 mmol/L)组成。
高效液相色谱参数:色谱柱:SHISEIDO C18柱(4.6 mm×250 mm,5 μm);流动相:0.1 mol/L磷酸盐缓冲溶液(pH 6.9)-乙腈,体积比为82∶18;检测波长245 nm;柱温25 ℃,流速1.0 mL/s。进样量10 μL。
1.3.4.2 酚酸含量测定
参考Sani 等[27]方法并进行适当调整。称取200 mg CBF,加入10 mL体积分数80%乙醇溶液涡旋混匀,超声处理30 min,8 000 r/min离心10 min;取上清液,35 ℃旋转蒸发除乙醇,残渣用20 mL纯水溶解,转移至50 mL容器中,用氢氧化钾溶液调节pH值至7.0,再加入20 mL乙酸乙酯振荡10 min后取上层酯层,水相再用20 mL乙酸乙酯重新萃取2 次,合并乙酸乙酯相为中性酚;调节水相pH值至2.0,再用20 mL乙酸乙酯萃取3 次,合并乙酸乙酯层为酸性酚,将中性酚和酸性酚合并后35 ℃浓缩至干,残渣用体积分数60%甲醇溶液定容至10 mL,过0.22 μm滤膜后待测。
高效液相色谱参数:色谱柱:Agilent C18柱(4.6 mm×150 mm,5 μm);流动相A:体积分数1%乙酸溶液;流动相B:乙腈;柱温35 ℃,流速为1.0 mL/s;检测波长270 nm;进样量10 μL。梯度洗脱条件:0~5 min,94%~86% A、6%~14% B;5~8 min,86%~82% A、14%~18% B;8~15 min,82%~80% A、18%~20% B;15~20 min,80%~76% A、20%~24% B;20~30 min,保持96% A、4% B。
1.3.5 无标记蛋白质组学分析
取培养60 h的发酵液,12 000 r/min离心10 min,分离上清液,发酵液蛋白样品进行酶解处理[28]。蛋白质谱鉴定实验委托北京诺禾致源科技股份有限公司进行。蛋白质生物信息学使用InterProScan软件进行基因本体论(Gene Ontology,GO)和结构域IPR功能注释(包括Pfam、PRINTS、ProDom、ProSite数据库)。使用ExPASy中的Compute pI/Mw工具评估蛋白质的分子质量(mw)和理论等电点(pI)。
1.4 数据处理与分析
采用GraphPad Prism 5进行处理数据;采用Adobe Illustrator软件处理图片。
2 结果与分析
2.1 CBF的单糖和酚酸组成
由表1可知,CBF样品中含有10 种单糖,木糖、阿拉伯糖、半乳糖、葡萄糖、半乳糖醛酸、葡萄糖醛酸、岩藻糖、甘露糖、鼠李糖、核糖的物质的量比为720.4∶402.5∶130.4∶76.5∶24.6∶20.2∶15.7∶10.8∶10.2∶1。其中木糖(50.97%)和阿拉伯糖(28.47%)的含量最高,阿拉伯糖/木糖为0.56(表1),该结果与已报道研究结果一致,即CBF单糖主要包括阿拉伯糖(29%~36%),半乳糖(4%~6%),葡萄糖(0%~2%),木糖(55%~59%)和葡萄糖醛酸(3%~5%)[29-30]。CBF阿魏酸含量为0.09%,与已报道相比含量较低[31],香豆酸和咖啡酸含量低于检测限。研究显示,木质纤维素生物质的主要成分为纤维素(40%~45%)、半纤维素(25%~30%)和木质素(15%~20%)[31],CBF成分结构与一般木质素纤维明显不同,可作为底物用于发酵制备具有半纤维素降解优势的复合酶制剂。
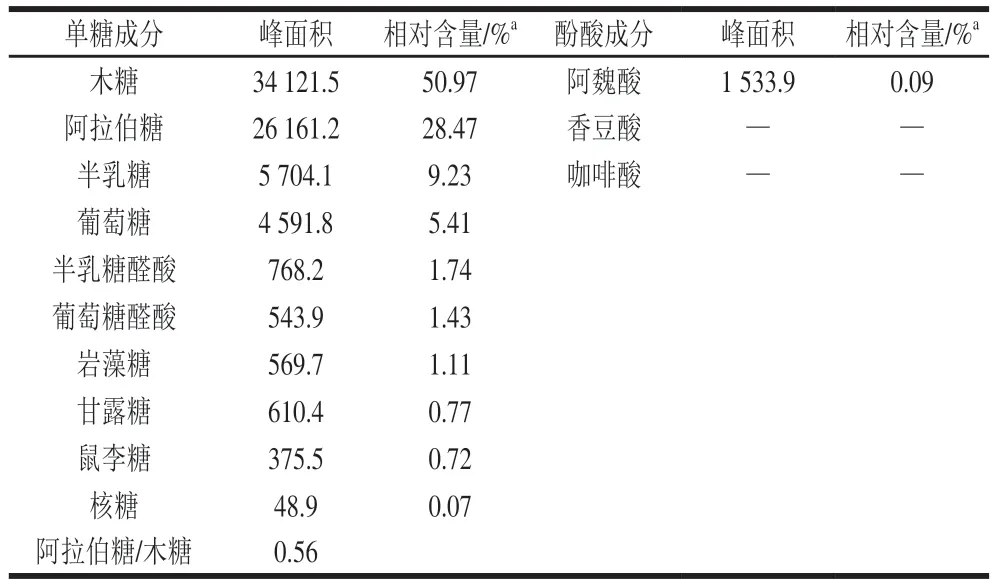
表1 CBF的单糖和酚酸组分构成Table 1 Compositions of monosaccharides and phenolic acids in CBF
2.2 A.niger和P.carnosa在CBF培养基中的生长及发酵上清液蛋白分析结果
A.niger和P.carnosa在CBF培养基中均能够良好生长,发酵培养192 h后,能够观察到球状菌体,发酵液状态变为澄清(图1)。

图1 发酵培养192 h后的CBF培养基Fig.1 CBF-containing medium after 192 h fermentation
图2为A.niger和P.carnosa发酵过程中不同时间发酵液SDS-PAGE检测结果。发酵液中蛋白条带随发酵培养时间延长呈现明显变化,其中A.niger在第48~60小时变化最为明显,而P.carnosa在第36~48小时变化最为明显。
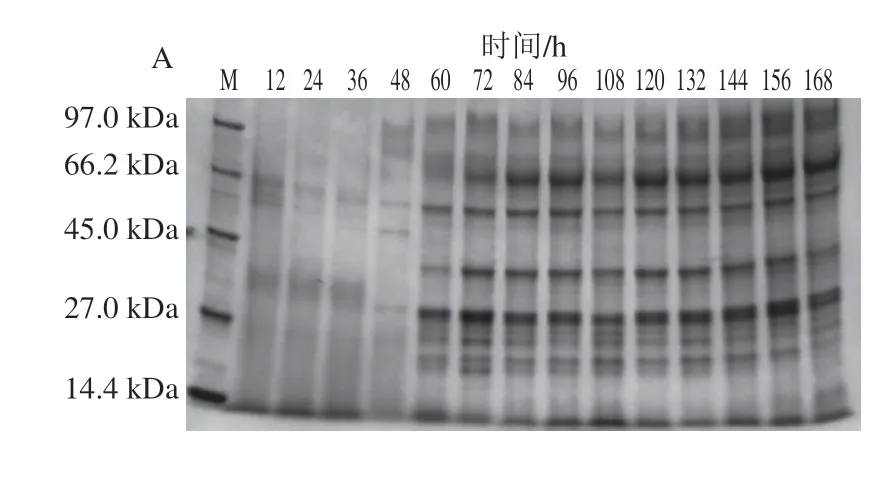
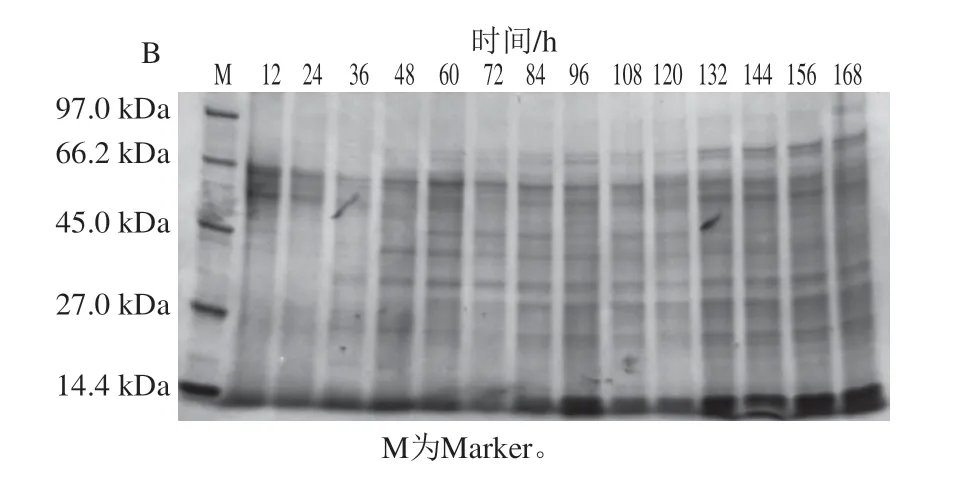
图2 不同培养时间A.niger(A)和P.carnosa(B)发酵上清液SDS-PAGE图谱Fig.2 SDS-PAGE patterns of total extracellular proteins in the fermentation supernatants of A.niger (A) and P.carnosa (B)
2.3 A.niger和P.carnosa发酵液还原糖和蛋白含量
由图3A可知,A.niger和P.carnosa发酵液中蛋白质量浓度最高分别为1.21 mg/mL(192 h)和1.23 mg/mL(192 h)。发酵培养过程中,A.niger和P.carnosa发酵液中蛋白含量逐步上升,A.niger发酵液蛋白质量浓度由12 h的0.70 mg/mL升高至192 h的1.21 mg/mL;其中在48~60 h出现第1个较快升高的阶段,该结果与SDSPAGE检测结果(图2A)一致。P.carnosa发酵液蛋白质量浓度由12 h的0.72 mg/mL升高至192 h的1.23 mg/mL,而在36~48 h出现一个迅速升高的阶段,即由0.82 mg/mL升高至1.05 mg/mL,该结果与SDS-PAGE检测结果(图2B)一致,推测该阶段P.carnosa可能快速分泌表达胞外酶以降解CBF。
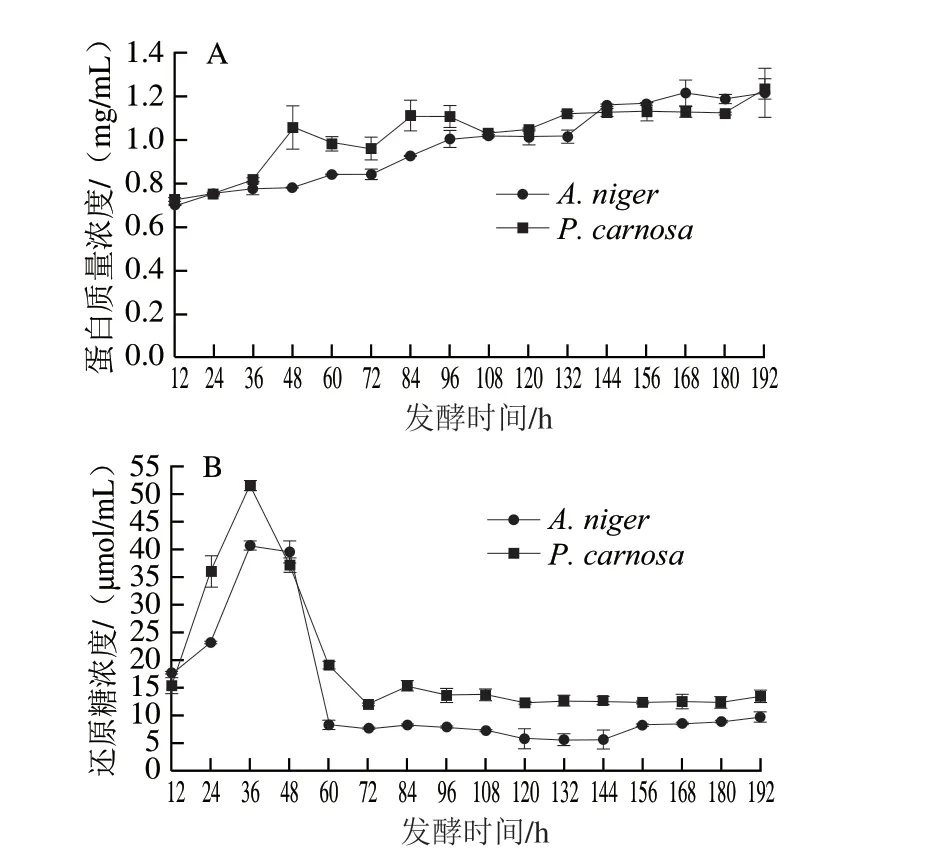
图3 A.niger和P.carnosa发酵液中蛋白质量浓度(A)和还原糖浓度(B)变化Fig.3 Changes in extracellular protein (A) and reducing sugar concentration (B) in the fermentation broths of A.niger and P.carnosa
由图3B可知,A.niger和P.carnosa发酵液中还原糖浓度最高为40.52 μmol/L和51.37 μmol/mL,均出现在36 h。A.niger和P.carnosa发酵过程中还原糖浓度变化趋势相似。A.niger在12~36 h迅速升高,在36 h达到最高为40.52 μmol/mL,在36~60 h又迅速降低至8.18 μmol/mL,60~192 h在5.55~9.61 μmol/mL之间呈较低水平波动。P.carnosa在36 h达到最高(51.37 μmol/mL),之后在36~72 h迅速降低至11.91 μmol/mL,72~192 h在11.91~15.23 μmol/mL之间波动。
2.4 A.niger和P.carnosa发酵液中木聚糖酶和α-L-阿拉伯呋喃糖苷酶活性
由图4A可知,A.niger和P.carnosa发酵液中木聚糖酶活力最高分别为246.58 U/mL(72 h)和367.21 U/mL(60 h)。A.niger发酵过程中木聚糖酶活力在36~72 h迅速升高,72 h达到最高,72~120 h缓慢下降至163.09 U/mL,而120~156 h又缓慢上升至208.22 U/mL。P.carnosa发酵过程中木聚糖酶活力在24~60 h迅速升高,60~84 h缓慢下降至317.86 U/mL,而84~192 h在312.15~350.16 U/mL间波动。P.carnosa与A.niger发酵液中木聚糖酶活性波动相似,但P.carnosa在各阶段木聚糖酶活性均高于A.niger,是其酶活力的1.38~4.76 倍。A.niger发酵液木聚糖酶活性在48~60 h升高最快,而P.carnosa发酵液木聚糖酶活性在36~48 h升高最快,均与发酵液蛋白质量浓度变化呈正相关(图3),推测两株菌在此阶段开始大量分泌表达木聚糖酶。
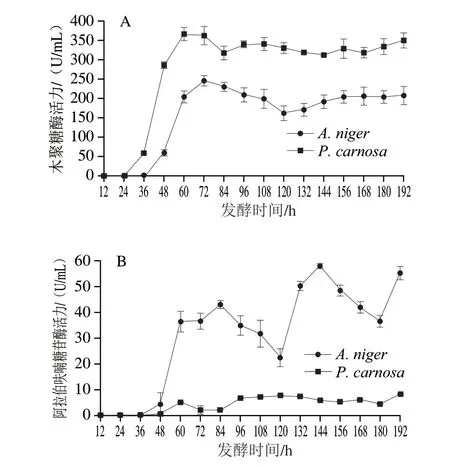
图4 A.niger和P.carnosa发酵液中木聚糖酶(A)和α-L-阿拉伯呋喃糖苷酶(B)活力变化Fig.4 Changes in xylanase (A) and arabifurosidase (B) activities in the fermentation broths of A.niger and P.carnos
由图4B可知,A.niger和P.carnosa发酵过程中α-L-阿拉伯呋喃糖苷酶活性变化趋势差异很大。A.niger和P.carnosa发酵液中α-L-阿拉伯呋喃糖苷酶活力最高分别为57.90 U/mL(144 h)和8.26 U/mL(192 h)。A.niger发酵液α-L-阿拉伯呋喃糖苷酶活性变化很大,在36~84 h迅速升高至42.99 U/mL,84~120 h迅速下降(42.99~22.39 U/mL),形成第1个峰;随后由120~144 h迅速升高(22.39~57.90 U/mL),144~180 h迅速下降(57.90~36.49 U/mL),形成第2个峰;最后在180~192 h又迅速升高至55.13 U/mL。P.carnosa发酵液α-L-阿拉伯呋喃糖苷酶活性同样呈波动变化,但其酶活力相对于A.niger发酵液较低,最高仅为8.26 U/mL。发酵过程中发酵液中α-L-阿拉伯呋喃糖苷酶活性波动性变化趋势可能有两个原因:首先,阿拉伯糖残基作为CBF支链,其与主链存在多种连接方式,而不同α-L-阿拉伯呋喃糖苷酶具有不同催化模式[32-33],因此,推测A.niger可能在不同发酵阶段表达具有不同催化模式的α-L-阿拉伯呋喃糖苷酶;其次,CBF的降解过程是α-L-阿拉伯呋喃糖苷酶与木聚糖酶协同作用的过程,因此,两种真菌可能在生长过程中调控相关α-L-阿拉伯呋喃糖苷酶与木聚糖酶基因的协同表达,结果则表现为发酵液中酶活力的波动现象。
综合发酵液中还原糖含量和蛋白质量浓度变化,以及木聚糖酶和α-L-阿拉伯呋喃糖苷酶活性变化规律,两种菌在发酵过程中均存在“分泌胞外酶-酶解CBF-产生低聚糖底物-吸收利用-生长-再分泌胞外酶”的波动现象,而这种通常出现在非连续补料发酵培养过程。
2.5 蛋白质的鉴定及统计分析
无标记蛋白质组分析P.carnosa发酵液共鉴定出109 种蛋白质,包括糖苷水解酶(53/48.62%)、蛋白酶/肽酶(9/8.26%)、脂肪酶/酯酶(14/12.84%)、氧化酶/还原酶(6/5.50%)和假设蛋白(27/24.77%)(图5、表2)。CBF发酵培养P.carnosa分泌表达的糖苷水解酶比列高于结晶纤维素(46%)和云杉木(29%)培养,而氧化酶/还原酶分泌表达比例(5%)低于结晶纤维素(15%)和云杉木(15%)[22]诱导表达比例(表2),该结果表明CBF与结晶纤维素、云杉木的组成成分和分子结构的差异导致同种菌株会分泌表达具有不同组成的复合酶系。

图5 CBF发酵培养A.niger(A)和P.carnosa(B)分泌表达蛋白质的功能分类Fig.5 Functional classification of proteins identified in the secretomes of A.niger (A) and P.carnosa (B) grown in CBF-containing medium
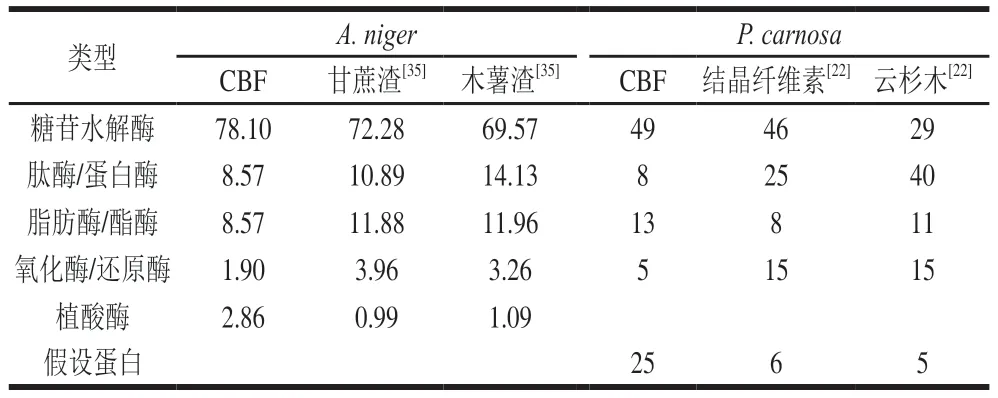
表2 不同底物发酵培养A.niger和P.carnosa分泌表达蛋白质的功能分类比较Table 2 Functional classification of proteins identified in the secretomes of A.niger and P.carnosa grown in different media %
A.niger发酵液蛋白质组分析共鉴定出105 种蛋白质,包括糖苷水解酶(82/78.10%)、蛋白酶/肽酶(9/8.57%)、脂肪酶/酯酶(9/8.57%)、氧化酶/还原酶(2/1.9%)和植酸酶(3/2.86%)(图5、表2)。CBF发酵培养A.niger分泌表达的糖苷水解酶比列高于甘蔗渣(72.28%)和木薯渣(69.57%),氧化酶/还原酶(1.90%)低于甘蔗渣(3.96%)和木薯渣(3.26%)[35]诱导表达比例(表2)。该结果与P.carnosa蛋白质组分析结果一致,表明A.niger分泌表达胞外酶系与发酵底物组成成分和结构相关。
蛋白组分析结果显示,P.carnosa分泌表达了完整的纤维素降解酶系(表3):10 个内切葡萄糖苷酶(GH5、GH12、GH16、GH45和GH74家族)、4 个纤维二糖酶(GH6和GH7家族)、1 个β-1,3-葡聚糖酶(GH17家族)和5 个β-葡萄糖苷酶(GH3、GH31和GH55家族)。研究显示,白腐菌降解纤维素需要内切葡聚糖酶、纤维二糖酶和β-葡萄糖苷酶3 种酶协同作用[34],而CBF发酵培养P.carnosa的蛋白质组中能够检测到3 类纤维素降解酶。

表3 CBF发酵培养P.carnosa分泌表达的纤维素降解酶类Table 3 Cellulose-degrading proteins identified in the secretome of P.carnosa cultured on CBF
P.carnosa能够分泌表达完整的半纤维素降解酶系(表4,图6),包括4 个木聚糖酶(GH10和GH11家族)、1 个β-木糖苷酶(GH3家族)、4 个α-L-阿拉伯呋喃糖苷酶(GH43和GH127家族)、3 个乙酰木聚糖酯酶(CE1家族)和1 个葡萄糖醛酸酶(GH115家族)、6 个半乳糖苷酶(GH27、GH35和GH43家族)、2 个甘露聚糖酶(GH5家族)和3 个甘露糖苷酶(GH5、GH47和GH92家族)。

图6 A.niger和P.carnosa分泌表达糖苷水解酶家族蛋白分布Fig.6 Distribution of glycosyl hydrolase family identified in the secretome of A.niger and P.carnosa grown in CBF-containing medium

表4 CBF发酵培养P.carnosa分泌表达的半纤维素降解酶类Table 4 Hemicellulose-degrading enzymes identified in the secretome of P.carnosa cultured on CBF
P.carnosa蛋白质组鉴定到6 个氧化/还原酶,包括过氧化物酶、铜基氧化酶、乙二醛氧化酶、纤维二糖脱氢酶(表4),但未检测到锰过氧化物酶和细胞色素P450单加氧酶。有报道显示,P.carnosa基因组含有266 个预测为细胞色素P450单加氧酶的编码基因[20]。在已测序和注释的木腐担子菌中,P.carnosa的P450单加氧酶基因数量最多,几乎是P.chrysosporium的2 倍[20],但本研究显示,P.carnosa未分泌表达细胞色素P450单加氧酶。该结果与P.carnosa利用云杉及白杨木培养基生长的转录组和蛋白质组分析结果[21-22]不同,可能由于CBF与云杉及白杨木的木质素含量和结构存在巨大差异,CBF的木质素含量约为7.8%[36]。纤维素和云杉发酵培养P.carnosa的胞外蛋白质组中能够检测到锰过氧化物酶,但不能检测到纤维二糖脱氢酶的表达[22]。此外,云杉发酵培养P.carnosa还能够检测到过氧化物酶和铜基氧化酶[22]。
P.carnosa分泌表达了14 个脂肪酶/酯酶(CE1、CE8、CE15和CE16家族),包括果胶酯酶、糖脂酶、乙酰木聚糖脂酶、羧酸酯酶、葡萄糖醛酸酯酶和脂肪酶(表4),但没有检测到阿魏酸酯酶的表达。脂肪酶和酯酶底物特异性广泛,能够参与水解半纤维素、纤维素的糖酯类支链结构酯键,如葡萄糖醛酸酯酶可以水解木质素和木聚糖葡萄糖醛酸支链之间的酯键[37]。P.carnosa分泌表达了9 个蛋白酶/肽酶,这些蛋白酶可能参与纤维素结合的蛋白水解。
P.carnosa发酵液蛋白质组中检测到27 个功能未知的假设蛋白(图5),该结果与前期报道相似[22]。P.carnosa表达较多假设蛋白可能是由于国内外对于该菌种研究报道很少,对该菌株分泌表达蛋白质功能研究不足,但这些蛋白可能在木质纤维素降解中发挥重要作用[38]。因此,蛋白质组分析也是寻找真菌在特定培养条件下表达相关的未知功能蛋白质的重要途径。
蛋白组分析显示,A.niger分泌表达完整的纤维素降解酶系(表5),包括12 个内切葡聚糖酶(GH5、GH12、GH16、GH61和GH71家族)、4 个纤维二糖酶(GH6和GH7家族)和8 个β-葡萄糖苷酶(GH1、GH3、GH17和GH31家族)。
A.niger也分泌表达了完整的半纤维素降解酶系(表6),包括2 个木聚糖酶(GH10家族)、2 个木糖苷酶(GH3和GH31家族)、9 个α-阿拉伯呋喃糖苷酶(GH43、GH51、GH54和GH62家族)、1 个乙酰木聚糖酯酶(CE1家族)、1 个阿魏酸酯酶和2 个α-葡萄糖醛酸苷酶(GH67家族)、4 个半乳糖苷酶(GH3和GH27家族)、1 个甘露聚糖酶(GH5家族)、3 个甘露糖苷酶(GH2、GH5和GH47家族)。
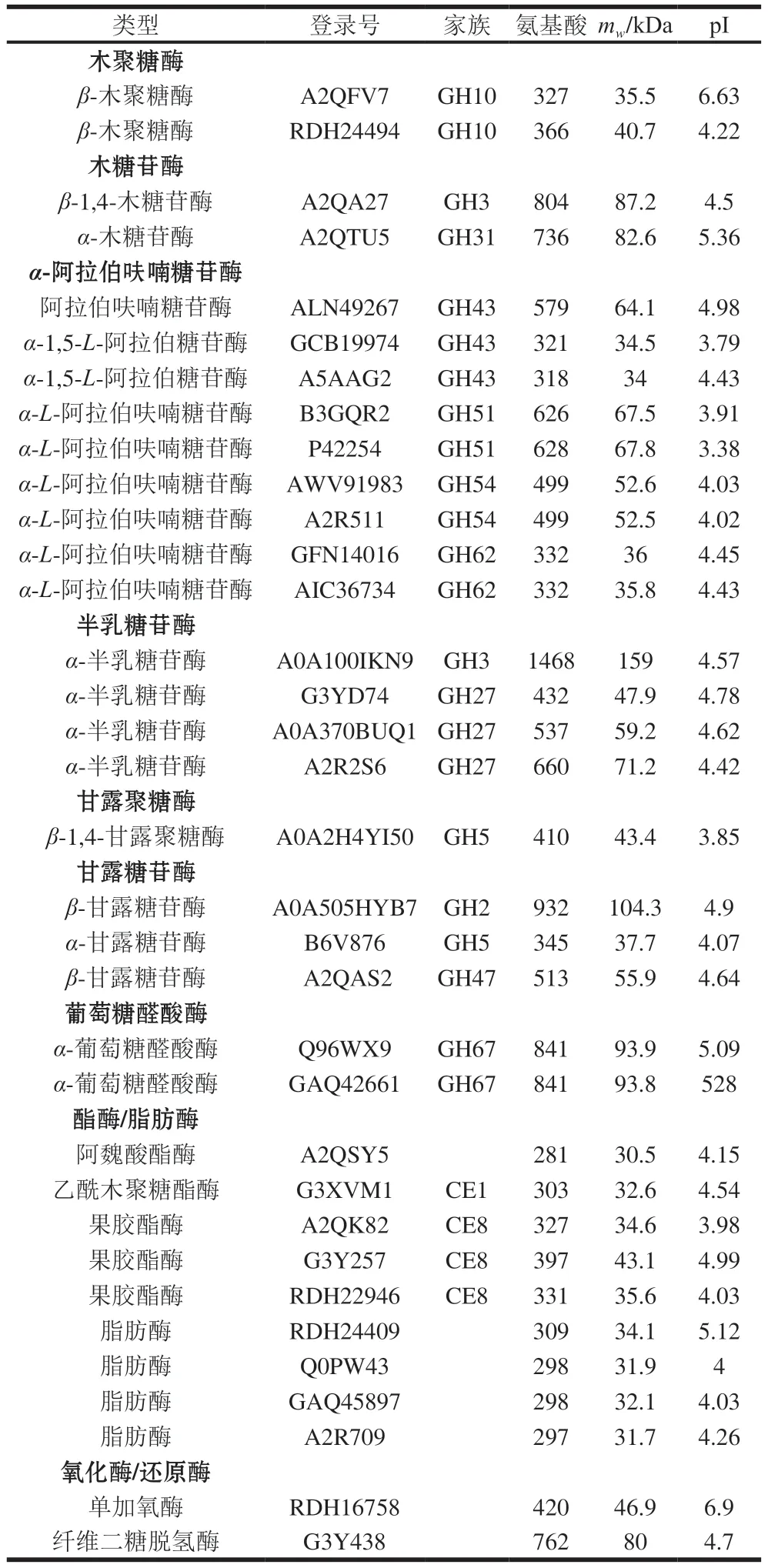
表6 CBF发酵培养A.niger分泌表达的半纤维素降解酶类Table 6 Hemicellulose-degrading enzymes identified in the secretome of A.niger cultured on CBF
A.niger蛋白质组鉴定到2 个氧化酶/还原酶,分别为单加氧酶和纤维二糖脱氢酶。A.niger分泌表达了9 个脂肪酶/酯酶(CE1和CE8家族),包括乙酰木聚糖脂酶、阿魏酸酯酶和果胶酯酶,均为半纤维素主要支链降解酶。A.niger分泌表达了9 个蛋白酶/肽酶和3 个植酸酶。与P.carnosa蛋白质组分析结果不同,A.niger发酵液蛋白质组中未检测到假设蛋白。
如图6所示,A.niger分泌表达糖苷水解酶的数量远高于P.carnosa,且糖苷水解酶家族分布也存在很大差异。该结果与已有研究一致,即A.niger具有强大的淀粉糖和非淀粉多糖降解酶系,在分泌表达糖苷水解方面具有优势[9]。P.carnosa分泌表达氧化酶/还原酶数量高于A.niger(图5),其在水解利用木质素方面有优势。尽管两种真菌具有不同的胞外酶系表达特点,但两种真菌都能够利用CBF作为碳源生长。综上所述,两种真菌在降解CBF时采取不同协同策略,即分泌表达具有不同组成的胞外酶系,但又具有相似催化功能和效率。
Label-free技术分析揭示了两种真菌发酵降解CBF所分泌表达的降解酶系,其中也包括功能未知的假设蛋白,这为新的糖苷水解酶的鉴定和发掘提供了方向。此外,蛋白质组分析也揭示了发酵底物组成、结构与微生物分泌表达胞外酶的相关性,该结果可以为设计制备最适合降解CBF的复合酶制剂提供基础。
3 结论
CBF中木糖(50.97%)和阿拉伯糖(28.47%)的含量最高,阿拉伯糖/木糖为0.56。以CBF为碳源发酵培养A.niger和P.carnosa,并测定发酵液中还原糖浓度、蛋白质量浓度、木聚糖酶和α-L-阿拉伯呋喃糖苷酶活性变化规律。结果显示,A.niger和P.carnosa发酵过程中均存在“分泌胞外酶-酶解CBF-产生低聚糖底物-吸收利用-生长-再分泌胞外酶”的波动现象。Label-free技术分析显示,A.niger分泌表达糖苷水解酶的数量远高于P.carnosa,且糖苷水解酶的家族分布也存在很大差异;P.carnosa分泌表达氧化酶/还原酶数量高于A.niger。两种真菌都能够利用CBF作为碳源生长,但分泌表达的不同复合酶又具有相似催化功能和效率,显示两种真菌在降解CBF时采取不同的多酶协同策略。Label-free蛋白质组分析揭示了两种真菌发酵降解CBF所分泌表达的降解酶系,以及发酵底物组成、结构与微生物发酵分泌酶蛋白系的相关性,该结果可为设计制备最适合降解CBF的复合酶制剂提供一定基础。

