功能菌株复配对发酵香肠抗氧化特性及风味的作用
王雍雍,陈 磊,魏从娇,葛庆丰,吴满刚,赵 宁,席 军,单艳琴,何旭东,于 海,*,刘 瑞
(1.扬州大学食品科学与工程学院,江苏省淮扬菜工业化工程中心,文化和旅游部中餐非遗技艺传承重点实验室,江苏 扬州 225127;2.江苏长寿集团有限公司,江苏 南通 226500;3.江苏兴野食品有限公司,江苏 兴化 225700;4.扬州市食品药品检验检测中心,江苏 扬州 225001)
发酵香肠是指将瘦肉绞碎、肥肉切丁,加入发酵剂、糖、盐和香辛料等混合均匀后灌入肠衣,在人工或自然条件下发酵形成具有特征性发酵香味的发酵肉制品[1]。肉中的脂肪和蛋白质在肌肉内源酶及外源微生物的共同作用下被分解为脂肪酸、多肽和氨基酸等物质,进一步分解形成发酵香肠的风味物质。由于香肠在制备过程中受到加工环境和贮藏条件的影响,蛋白质会发生不同程度的氧化,适度氧化有利于香肠风味的形成,但过度氧化会对香肠的颜色、质地、滋味、保水性和消化性等品质造成不良的影响[2],所以具有抗氧化作用的微生物成为了研究的热点。Luan Xiaoxu等[3]从发酵香肠中分离出的植物乳植杆菌CD 101具有较高的抗氧化性,能有效抑制发酵香肠的氧化,从而延长香肠的货架期。本实验选用的植物乳植杆菌(Lactiplantibacillus plantarumNJAU-01,LpN)是1 株分离自金华火腿的具有高抗氧化性且具备优良发酵性能的乳酸菌[4]。
此外,发酵剂的添加还可以改善产品的风味与品质。赵银峰等[5]筛选出的1 株植物乳植杆菌M-25能有效提升香肠品质和风味特性。本实验选用的植物乳植杆菌(L.plantarumCGMCC 18217,Lp10)已被证明具有优良的支链氨基酸转氨酶活力,可以应用到发酵香肠中提高特征性风味化合物如3-甲基丁醛、2-甲基丙醇和2-甲基丁醛的含量[6]。葡萄球菌通过产生的蛋白酶水解原料肉中的蛋白质,释放的肽和游离氨基酸能改善发酵香肠的滋味、提高风味物质的含量。有研究表明接种腐生葡萄球菌(Staphylococcus saprophyticCGMCC 3475,Ss)不仅促进了发酵香肠中的蛋白质降解,而且提高了直链醛和酮的含量,赋予了发酵香肠优良的风味[7]。而在发酵香肠中接种复配发酵剂,通过不同发酵剂之间的协同作用可以弥补单一菌种的单调性,充分利用各菌株的优点,提高和改善产品品质[8],本研究旨在利用不同功能菌株进行复配以提高发酵香肠的风味和降低其蛋白质的氧化程度。
1 材料与方法
1.1 材料与试剂
Lp10、LpN和Ss由扬州大学食品科学与工程学院畜产加工实验室从火腿中分离并保藏;猪肉和香辛料购于扬州大润发超市;猪肠衣由江苏省如皋坝新肠衣公司提供。
MRS培养基 青岛海博生物有限公司;磷酸二氢钠合二水、磷酸氢二钠合十二水、十二烷基硫酸钠(sodium dodecyl sulfate,SDS)、β-巯基乙醇、甘油、溴酚蓝 生工生物工程(上海)股份有限公司。
1.2 仪器与设备
205便携式pH计 德国Testo公司;LabSwift-aw便携式水分活度仪 瑞士NOVASINA公司;TA.XT.plus质构仪 英国Stable Micro System公司;手持式CR-400色差仪 日本Konica Minolta公司;easySpiral全自动稀释接种仪 法国Interscience公司;Mini-PROTEAN Tetra cell电泳仪 美国Bio-Rad公司;L-8900型全自动氨基酸分析仪 日本日立公司;Trace DSQ II气相色谱-质谱联用仪 美国安捷伦科技有限公司。
1.3 方法
1.3.1 菌株活化与制备
将Lp10、LpN和Ss3 株菌分别以1%的接种量加到MRS液体培养基中,37 ℃培养12 h,重复活化2 次后,4 ℃、6 000×g离心10 min,菌体沉淀用无菌生理盐水洗涤后重悬。
1.3.2 菌株之间的拮抗作用
用接种环挑取活化后的菌株,在MRS固体培养基上划一条直线,37 ℃培养24 h,再用接种环挑取另一菌株沿菌落边缘从垂直方向接种,继续培养24 h,观察划线交界处是否存在抑菌区[9]。
1.3.3 发酵香肠制备及处理组设计
将瘦肉绞碎,肥肉切丁,肥瘦比为3∶7,每千克肉中加入糖7%、盐3%、味精0.2%、五香粉0.1%、生姜粉0.15%、大曲20 mL,混合均匀后进行灌肠和结扎,发酵时间为28 d,接菌处理组的菌株接种总量为1×107CFU/g。
发酵条件:温度(30±0.5)℃,相对湿度95%,发酵时间1 d;温度16 ℃,相对湿度80%,发酵时间1 d;温度16 ℃,相对湿度70%,发酵时间1 d;温度16 ℃,相对湿度60%,发酵时间25 d。
发酵香肠处理组:CK:不接种发酵剂的空白组;Lp10:只接种Lp10的处理组;Lp10+Ss:以1∶1比例接种Lp10和Ss的处理组;Lp10+LpN+Ss:以1∶1∶1比例接种Lp10、LpN和Ss的处理组。
4 个处理组的发酵香肠取样时间分别是0、7、14、21、28 d。
1.3.4 发酵香肠理化指标的测定
1.3.4.1 发酵香肠乳酸菌总数的测定
参考GB 4789.2—2016《食品微生物学检验 菌落总数测定》,将MRS固体培养基置于恒温培养箱,37 ℃培养48 h后计数。
1.3.4.2 发酵香肠pH值的测定
使用三点校准后的手持便携式pH计,插入去除肠衣的发酵香肠内部测定[5]。
1.3.4.3 发酵香肠水分活度(aw)的测定
根据GB 5009.238—2016《食品水分活度的测定》第二法,称取5.0 g去除肠衣并切碎的香肠样品置于校准后的水分活度仪测定平皿中,记录仪器显示的测量值。
1.3.4.4 发酵香肠质构的测定
参考李俊霞等[10]方法,将香肠样品去除肠衣后切成边长为1 cm的正方体,质构仪设置感应源1 000 N,初始力0.3 N,压缩比60%,测定前、中、后速率分别为2、2、1 mm/min,循环2 次。测定指标为硬度(N)和弹性(mm)。
1.3.4.5 发酵香肠色泽的测定
将发酵香肠切成3.0 mm的薄片,用校正后的色差仪测量样品随机点的L*、a*和b*值。
1.3.5 发酵香肠蛋白降解和氧化指标的测定
1.3.5.1 肌原纤维蛋白的提取
取5.0 g去除肠衣并切碎的香肠样品加入50 mL磷酸盐缓冲液(0.02 mol/L,pH 7.4),匀浆60 s,然后12 000×g、4 ℃离心20 min,取沉淀重悬于50 mL含0.1%(V/V)Triton X-100的磷酸盐缓冲液(0.03 mol/L,pH 7.4),匀浆60 s,再次12 000×g、4 ℃离心20 min,取沉淀,离心重复3 次。所得沉淀用50 mL磷酸盐缓冲液(0.1 mol/L,pH 6.5,含0.7 mol/L KI)匀浆5 min,静置待蛋白充分溶解后12 000×g、4 ℃离心20 min,最终所得上清液即肌原纤维蛋白。提取的蛋白用双缩脲法测定浓度,再用磷酸盐缓冲液(0.1 mol/L,pH 6.5)调整为2 mg/mL。
1.3.5.2 肌原纤维蛋白的十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)
将500 μL肌原纤维蛋白样品与500 μL 2×Loading Buffer上样缓冲液(1 g/100 mL溴酚蓝、200 mmol/L Tris-HCl pH 6.8、8 g/100 mL SDS、40 g/100 mL甘油和1%(V/V)β-巯基乙醇)混匀,在95 ℃加热10 min。待样品冷却至室温后,取20 μL加入到由12.5%分离胶和4%浓缩胶组成的SDS-PAGE凝胶孔道上。然后在Mini-PROTEAN电泳系统上以90 V恒压模式下进行30 min后,再在120 V恒压模式下进行60 min。电泳结束后,将凝胶在含有0.1 g/100 mL考马斯亮蓝G-250、45%(V/V)甲醇和10%(V/V)乙酸的溶液中进行染色,染色时间为40~60 min,然后在加入10%乙酸、10%甲醇的溶液中进行脱色,直至观察到清晰蛋白条带,再使用Bio-Rad成像系统对凝胶进行扫描分析。
1.3.5.3 游离氨基酸的测定
参照柴利等[11]的方法,精确称取切碎的发酵香肠2.5 g,加入10 mL 3.5%(V/V)高氯酸溶液,4 700 r/min均质60 s,均质后10 000×g、4 ℃离心10 min,离心后取上清液。用适量高氯酸溶液洗涤沉淀物再次离心,合并2 次上清液并用5%氢氧化钠溶液调节pH值至2.0,用纯水定容至25 mL。取1.5 mL过0.22 μm滤膜后用全自动氨基酸分析仪检测。
1.3.5.4 总巯基含量的测定
取0.2 mL 2 mg/mL所提的肌原纤维蛋白液,加入1.8 mL脲缓冲液和80 μL 2-硝基苯甲酸,在40 ℃反应25 min,然后冷却至室温,于412 nm波长处测定吸光度。总巯基单位用每毫克蛋白巯基物质的量表示,摩尔吸光系数为13 600 L/(mol·cm)。
1.3.5.5 表面疏水性的测定
取2 mL 2 mg/mL所提的肌原纤维蛋白液,加入40 μL 1 mg/mL溴酚蓝溶液,充分混匀后10 000×g、4 ℃离心15 min,于595 nm波长处测定吸光度(A),磷酸盐缓冲液作为空白对照组。表面疏水性按下式计算:
1.3.6 发酵香肠挥发性风味物质的测定
将发酵结束后的香肠去除肠衣并切碎,取10 g于250 mL萃取瓶中,加入20 μL用甲醇稀释的辛酸甲酯内标溶液。萃取瓶在60 ℃水浴锅中平衡5 min后,插入固相微萃取萃取头吸附40 min,然后将萃取头插入气相色谱-质谱联用仪进样口解吸5 min。
检测条件:气相色谱:非极性柱D B-5 M S(30 m×0.25 mm,0.25 μm),载气为高纯氮气(99.999%),恒流,流量为1.0 mL/min,不分流进样。辅助载气为高纯氢气(99.999%),检测器温度280 ℃,进样口温度250 ℃。初始温度40 ℃,保持1 min,5 ℃/min升温至100 ℃,保持8 min,8 ℃/min升温至240 ℃,保持5 min。质谱:离子化方式为电子电离源,电子能量70 eV,扫描时间0.2 s,检测器电压500 V,扫描范围m/z30~500。
定性定量分析:以Wiley、Nistdemo质谱库进行定性分析,匹配度大于等于800为鉴定依据,结合解析谱图,确定风味物质。采用内标法进行定量,内标物质为辛酸甲酯。
1.3.7 发酵香肠的感官评价
参照曹辰辰等[12]的方法,选择10 名(男女各5 人)经过专业感官培训的食品专业研究生成立感官评定小组,以色泽、香味、形态及滋味为评价指标对发酵香肠样品进行评分,评分标准如表1所示。

表1 发酵香肠感官评分标准Table 1 Criteria for sensory evaluation of fermented sausage
1.4 数据处理与统计分析
2 结果与分析
2.1 菌株间的拮抗作用
如图1所示,3 株菌株没有产生拮抗作用,它们在划线交叉处共同生长,没有出现抑菌现象。因此这3 株菌株可以联合复配,应用到发酵香肠中。
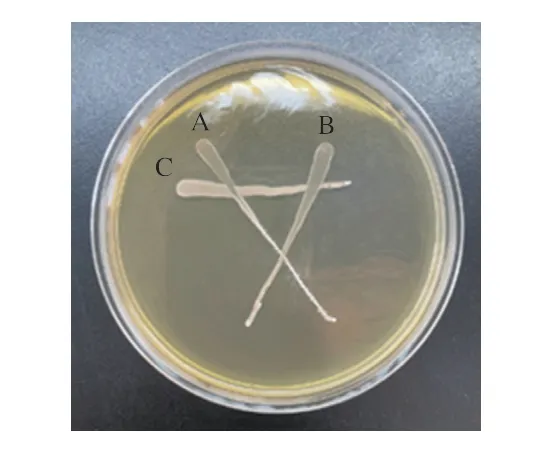
图1 菌株间的拮抗作用Fig.1 Antagonism among strains
2.2 香肠发酵过程中理化指标的变化
2.2.1 香肠发酵过程中乳酸菌总数的变化
如图2所示,乳酸菌总数整体呈先迅速增加后缓慢减少的趋势。发酵0 d,CK组在MRS固体培养基上的计数约为4.64(lg(CFU/g))。接菌的3 个处理组在发酵7~14 d乳酸菌总数不断增加到达最高水平(108~109CFU/g),说明乳酸菌能够利用发酵香肠中的营养物质进行生长繁殖。随后,在发酵结束时(28 d)下降到107~108CFU/g,这可能是由于乳酸菌产物有机酸的不断积累抑制了它自身的生长繁殖[13],也与发酵的温湿度等变化有关。
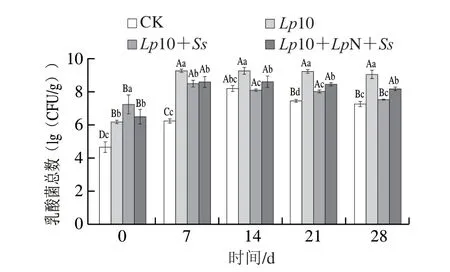
图2 发酵过程中香肠乳酸菌总数的变化Fig.2 Change in total number of lactic acid bacteria in fermented sausage during fermentation
2.2.2 香肠发酵过程中pH的变化
如图3所示,香肠发酵成熟过程中pH值呈先下降后上升的趋势。在发酵0 d,各组的pH值均在5.6~5.7。发酵7 d后,各处理组的pH值均显著下降(P<0.05),直至发酵14 d后pH值降到最低,CK、Lp10、Lp10+Ss、Lp10+LpN+Ss组分别降至5.24、5.04、4.83、4.95。在发酵初期,迅速降低的pH值有助于抑制香肠中有害微生物的生长[14],降低蛋白质的水结合能力,加快干燥进程。处理组Lp10+Ss的pH值在14 d显著低于其余各组(P<0.05),这是由于Ss具有较强的酸化活性[6]。发酵14 d后各组pH值回升,其中接菌的3 个处理组在发酵过程中pH值始终比CK组低,而接种复配菌株的处理组在发酵过程中pH值始终显著低于接种单菌株的处理组(P<0.05)。这与Lorenzo等[15]的研究结果一致,其认为微生物产生的蛋白酶诱导蛋白降解,产生肽和胺等碱性物质缓冲了发酵过程中产生的有机酸,导致发酵后期pH值回升。

图3 发酵过程中香肠pH值的变化Fig.3 Changes in pH of fermented sausage during fermentation
2.2.3 香肠发酵过程中aw的变化
如图4所示,所有处理组的香肠aw在成熟过程中均发生显著下降(P<0.05),最终各组的aw值范围为0.64~0.67,此时大多数微生物将停止生长[16]。发酵21 d后,接菌处理组aw值比CK组低(P<0.05),而较低的aw值有利于香肠的保存。这与Sun Qinxiu等[17]的研究结果一致,微生物的快速生长可以加速香肠的脱水[18-19],因此接菌会降低香肠的水分含量和aw。
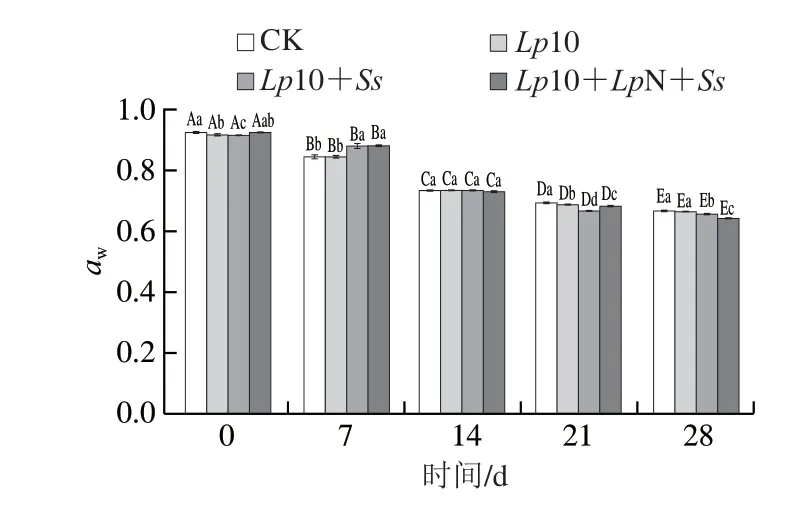
图4 发酵过程中香肠aw的变化Fig.4 Changes in aw of fermented sausage during fermentation
2.2.4 香肠发酵过程中质构的变化
品质优良的香肠应该具有软硬适中、结实、富有弹性等特点。表2是发酵过程中香肠质构的变化,各个处理组硬度均随着发酵时间的延长显著增加(P<0.05),发酵结束后接菌处理组硬度高于CK组,这是因为接种的乳酸菌和葡萄球菌生长繁殖导致pH值下降,而发酵香肠pH值与硬度具有较强负相关性[20]。发酵结束后香肠的弹性较发酵0 d显著提高(P<0.05),可能是由于pH值和aw降低,游离氨基酸含量升高,蛋白质的变性和凝固程度升高,香肠的持水性变低,使得香肠的结构更加紧密,更加结实具有弹性[21-23],提升了香肠的口感。
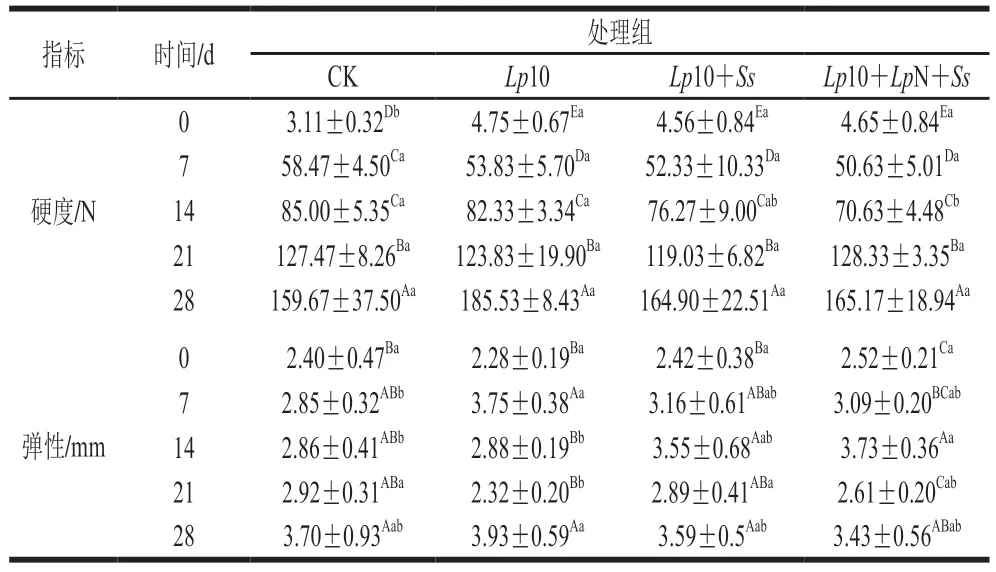
表2 发酵过程中香肠质构的变化Table 2 Changes in texture of fermented sausage during fermentation
2.2.5 香肠发酵过程中色泽的变化
色泽是消费者评判香肠品质的第一标准,香肠发酵过程中的颜色变化如表3所示。各处理组的亮度值(L*)在发酵过程中发生了显著变化(P<0.05),除处理组Lp10+Ss的L*不断下降,其他处理组的L*均在发酵结束时略有上升。L*下降是由于水分流失而形成深色,处理组Lp10+Ss的L*不断下降可能是由于葡萄球菌的添加,这与夏让等[24]的研究一致。为了减少评判的误差,在评价香肠的色泽时可以通过红度值(a*)/黄度值(b*)的大小判断,a*/b*越大,产品的红色越鲜艳[25-27]。从表3可以看出,处理组Lp10+LpN+Ss的a*/b*显著高于处理组CK和Lp10(P<0.05),说明该组香肠的红色最鲜艳。不同发酵剂对香肠色泽有不同程度的影响,且复配发酵剂的发色效果优于单一发酵剂。这可能是由于复配发酵剂中的腐生葡萄球菌能够产生硝酸盐或亚硝酸盐还原酶,通过这些酶的作用还原硝酸盐,再将亚硝酸盐分解成NO,NO和肌红蛋白结合形成了亮红色的亚硝基肌红蛋白,从而提高了发酵香肠的色泽[28]。
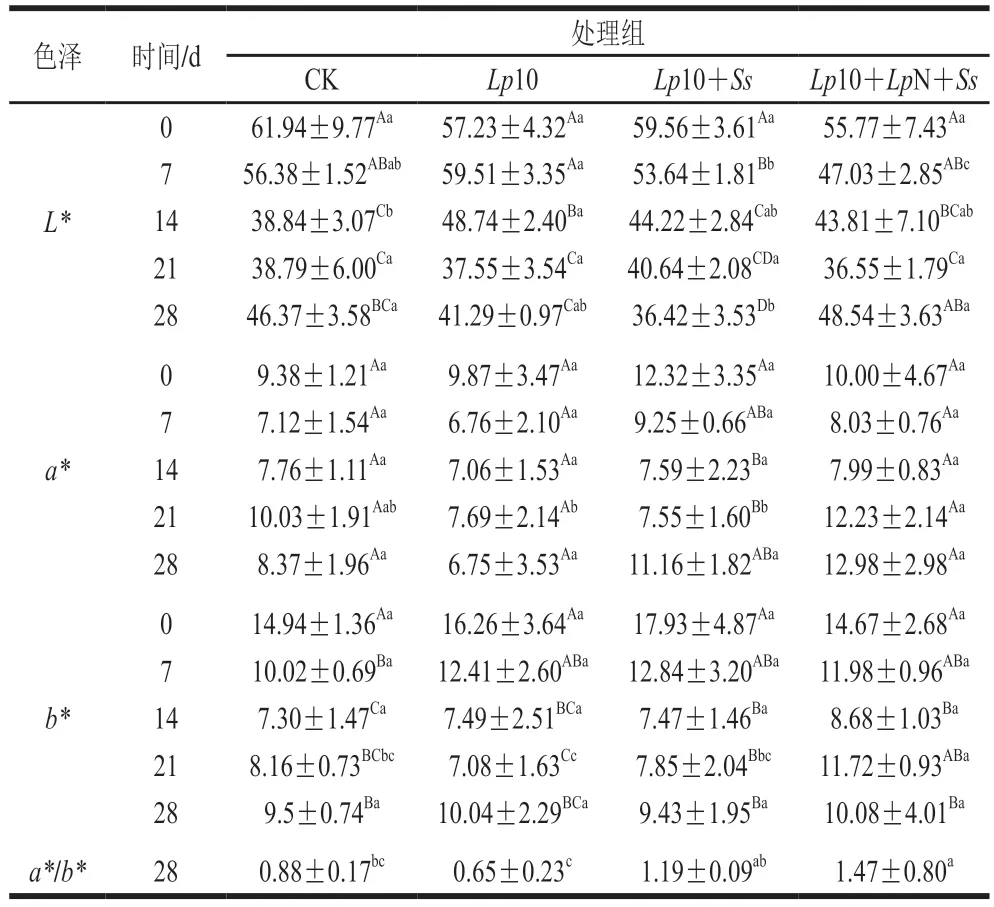
表3 发酵过程中香肠色泽的变化Table 3 Changes in color of fermented sausage during fermentation
2.3 香肠发酵过程中蛋白降解程度的变化
2.3.1 香肠发酵过程中肌原纤维蛋白的变化
香肠发酵过程中,在肌肉内源酶和微生物外源酶的共同作用下,蛋白质会发生不同程度的降解。由图5可以看出蛋白条带在发酵过程中变化明显。发酵0 d,各处理组蛋白条带相对强度最大,CK组与各接菌组的蛋白条带基本一致,说明蛋白起始条件接近。随着发酵时间的延长,条带相对强度减弱,且条带数量也逐步减少。发酵至28 d,如图5e所示,接菌处理组蛋白条带强度进一步减弱,并且多处条带已经消失。接菌处理使蛋白降解发生得更快,且接种复配菌株促进了肌原纤维蛋白的降解。可以看出,Lp10+LpN+Ss处理组降解肌原纤维蛋白效最好。
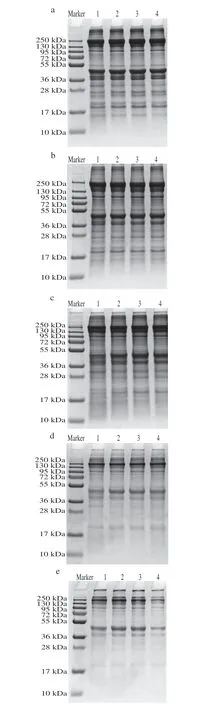
图5 发酵过程中香肠肌原纤维蛋白的SDS-PAGEFig.5 SDS-PAGE patterns of myofibrillar protein in fermented sausage during fermentation
2.3.2 发酵香肠游离氨基酸含量分析
在香肠的发酵过程中,肌肉蛋白经菌株产生的蛋白酶及肉本身的内源酶降解产生多肽,多肽进一步被降解成更小的多肽和游离氨基酸,而游离氨基酸是诱导味觉化合物和其他风味化合物的前体物质[29],在发酵香肠的风味形成中起重要作用。
香肠发酵结束后各处理组游离氨基酸和总游离氨基酸含量如表4所示。发酵结束后,香肠的游离氨基酸中Ala和Glu含量较高,在所有处理组中均占较大比例,Ala有助于产生甜味,Glu水平的增加可能是由于谷氨酰胺脱氨基[30],除有助于鲜味,还可以在支链氨基酸发生转氨作用时提供氨基受体α-酮戊二酸,促进特征性风味的产生[31]。各接菌处理组的Ala和Glu含量显著高于CK组(P<0.05),与王琴等[32]的研究结果一致。处理组Lp10+LpN+Ss的游离氨基酸含量最高,该结果可以与肌原纤维蛋白降解程度相互验证。

表4 发酵结束后香肠中游离氨基酸含量Table 4 Contents of free amino acids in fermented sausage
2.4 香肠发酵过程中蛋白氧化程度的变化
2.4.1 香肠发酵过程中总巯基含量的变化
蛋白质表面的Cys残基氧化导致巯基被氧化成二硫键、磺酸、次磺酸等,因此巯基值可以表示蛋白氧化的程度,巯基值越低则氧化程度越高。如图6所示,随着发酵时间的延长,各处理组发酵香肠的巯基值均呈现下降趋势,说明蛋白不断被氧化。但是接菌处理可以抑制巯基的减少,尤其是复配处理组Lp10+LpN+Ss,其总巯基含量在整个发酵过程中均显著高于其他处理组(P<0.05)。表明接菌可能对降低发酵香肠的蛋白氧化程度有贡献,接种LpN的复配处理组抗氧化能力更强(P<0.05)。

图6 发酵过程中香肠总巯基含量的变化Fig.6 Changes in total sulfhydryl content in fermented sausage during fermentation
2.4.2 香肠发酵过程中表面疏水性的变化
表面疏水性是指在蛋白质分子表面所发现的疏水基团的数量[33],它能反映出蛋白质构象的变化并表征蛋白质中疏水位点的表面暴露[34],一般用蛋白质中疏水性氨基酸与溴酚蓝结合量表示表面疏水性的大小,表面疏水性越大说明蛋白质的变性程度越大。如图7所示,发酵香肠的蛋白表面疏水性随发酵时间的延长而逐渐升高。接菌处理组的表面疏水性整个发酵过程中均显著低于CK组(P<0.05),表面疏水性最低的是接种了LpN的复配处理组。上述结果表明接菌处理特别是接种LpN能显著降低发酵香肠蛋白的表面疏水性(P<0.05),在一定程度上降低了发酵香肠的蛋白质氧化程度,对提高发酵香肠的品质有利。
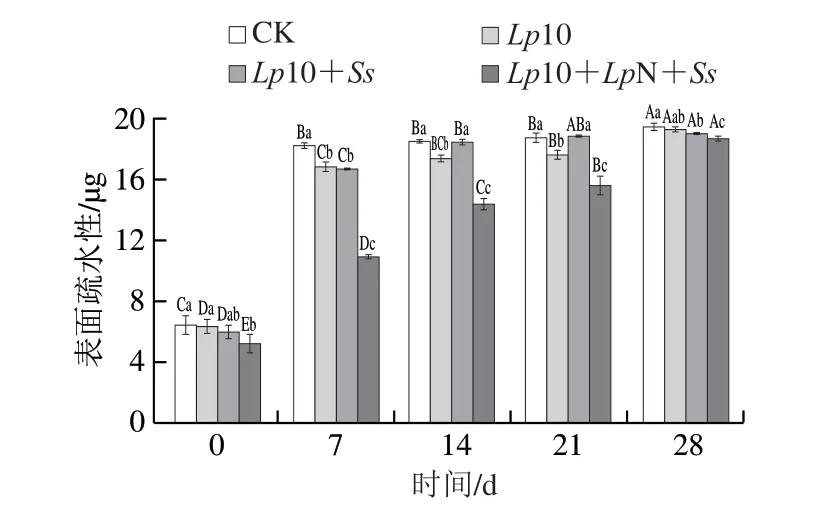
图7 发酵过程中香肠表面疏水性的变化Fig.7 Changes in surface hydrophobicity of proteins in fermented sausage during fermentation
2.5 发酵香肠的挥发性风味物质分析
通过顶空固相微萃取-气相色谱-质谱联用对发酵28 d后的香肠进行挥发性化合物的鉴定和定量。各个处理组分别检出32、40、41 种和43 种挥发性化合物,主要为酯类、醛类、醇类、酸类、烷烃类、烯烃类、酮类和其他化合物。相较于CK组,接菌处理增加了挥发性风味物质的种类和含量,各组挥发性化合物的组成和含量如表5所示。
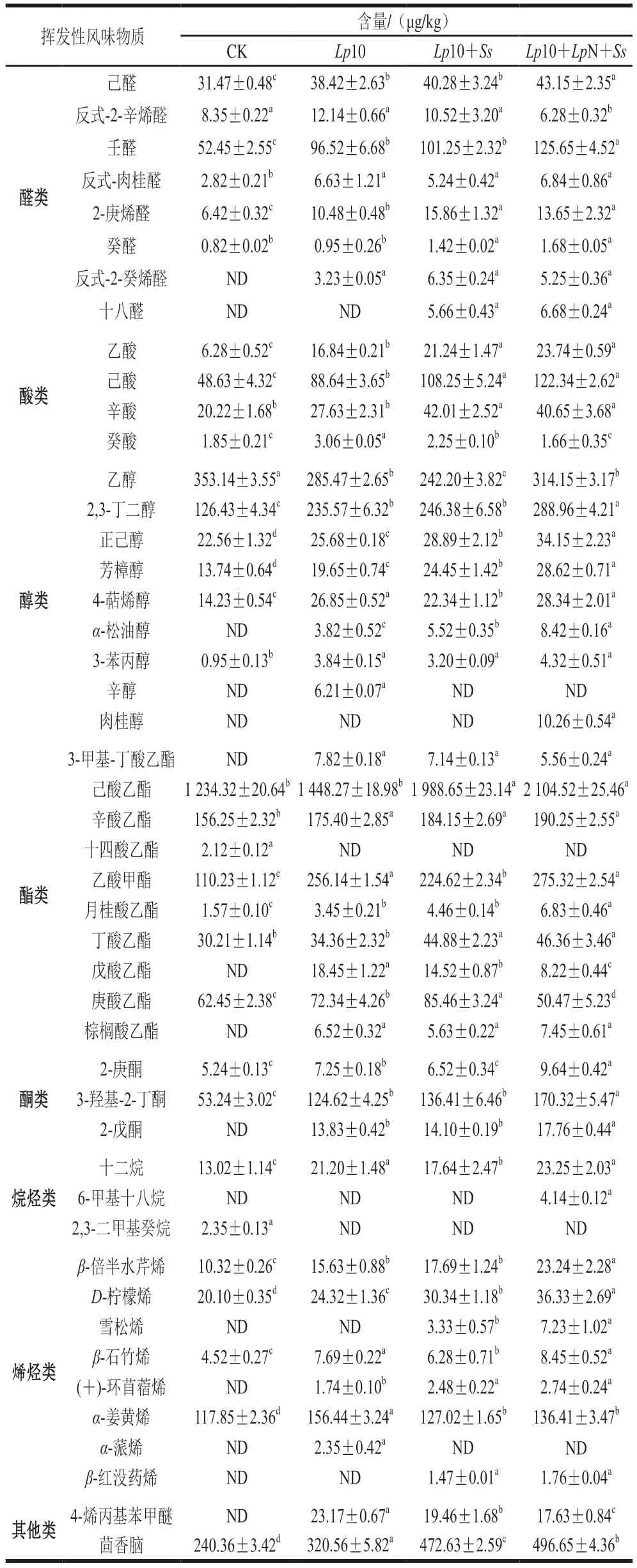
表5 发酵结束后香肠的挥发性风味物质含量Table 5 Volatile flavor substance contents in fermented sausage
接菌处理组的酯类含量都高于CK组,而发酵香肠的典型风味主要来源于酯类,这表明接种发酵剂能够促进发酵香肠风味的形成[35]。酯类物质由醇类和酸类物质经过酯化作用生成,多具有芳香风味,含有短链酸的酯类大多带有水果香气,含有长链酸的酯类大多呈现较淡的油脂味[36],脂肪水解产生的游离脂肪酸会与醇反应生成酯类物质,这也对香肠的独特风味具有重要贡献[37]。添加LpN处理组中的酯类物质总含量明显高于其他处理组,表明接种LpN提高了香肠的品质,这与葛庆丰[38]的研究结果一致。
醛类是发酵香肠中重要的风味化合物,风味阈值较低,主要来源于油酸和亚油酸等不饱和脂肪酸的氧化以及氨基酸的降解[39]。其中含量最高的是壬醛,它会散发出康乃馨、柑橘和月桂树的气味[40],2-庚烯醛具有烧烤及黄油味[41],己醛具有清香青草气味。醛类能够反应脂肪的氧化程度,对发酵肉制品特殊的风味的形成具有重要贡献。酮类化合物能够促进奶香味生成,3-羟基-2-丁酮是测得含量最高的酮类化合物,它挥发性较强,具有黄油香味和干酪香味,对发酵香肠的风味形成具有重要意义。处理组Lp10+Ss和Lp10+LpN+Ss较其他2 个处理组有更高的醛和酮含量,证明Ss对肉制品的风味起到了较好促进作用,这与李想等[7]研究结果一致。
醇类物质具有较高的阈值[42],乙醇在醇类中的含量最高,作为碳水化合物代谢产物中的主要化合物,它可以防止香肠在加工过程中发生变质。2,3-丁二醇、芳樟醇、4-萜烯醇、α-松油醇等发酵香肠中常见的醇类物质含量在复配处理组中均显著提高(P<0.05)。添加植物乳杆菌CGMCC 18217可以增加醇类物质的产生,进而改善香肠的风味[43]。
酸类是发酵香肠中重要且具有代表性的风味物质之一,在酯的形成中起重要作用。酸类物质主要来源于脂肪的降解、氨基酸脱氨反应或者由微生物的生长代谢产生。一般认为一些低分子质量的有机酸如乙酸、丙酸、丁酸等是来自于微生物的作用。乙酸和己酸来自于碳水化合物的发酵,接菌处理组的乙酸含量显著高于CK组(P<0.05)。
烷烃类和烯烃类由于阈值较高,所以不是风味的主要贡献者。接种复配菌株发酵处理组中β-倍半水芹烯、D-柠檬烯、β-石竹烯等烃类化合物含量显著高于CK组(P<0.05),烯烃类可能来自葱姜粉、辣椒等香辛料。
2.6 发酵香肠感官评价
对发酵28 d的香肠进行感官评价,评价指标包括色泽、形态、香味和滋味,各处理组得分结果如图8所示。其中接种复配菌株的处理组Lp10+Ss和Lp10+LpN+Ss在香肠色泽、形态和滋味3 个方面都显著高于CK组和接种单菌株的处理组Lp10(P<0.05)。在香肠香味评分结果中,接菌处理组Lp10和Lp10+LpN+Ss表现出良好的风味,评分显著高于CK组和Lp10+Ss组(P<0.05)。CK组的感官评分低于接菌处理组,可能是接菌加速了蛋白质的水解,产生了更多能促进风味物质生成的游离氨基酸,更好地形成发酵香肠的风味和滋味。此外,通过酸诱导的蛋白质变性可以改善香肠结构。结合感官结果和上述挥发性风味分析结果,可以看出接种发酵剂显著提高了香肠的风味感官品质,尤其是接种复配菌株的处理组Lp10+LpN+Ss不仅产生更高含量的特征性风味物质,并且在色泽、香味和滋味方面优于其他的处理组。
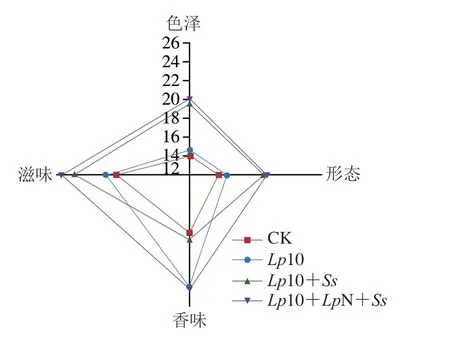
图8 发酵香肠感官得分Fig.8 Sensory scores of fermented sausage
3 结论
在香肠发酵成熟的过程中,接种3 株菌株的复配处理组Lp10+LpN+Ss能够赋予发酵香肠更好的色泽,改善发酵香肠的质构特性,同时降低发酵香肠的蛋白氧化程度以及增加挥发性风味物质的种类和含量,得到的成品获得了较高的感官评价得分。说明LpN、Lp10和Ss联合复配在改善发酵香肠品质及风味的同时降低了蛋白氧化程度,可以作为发酵香肠的优良发酵剂。

