传统清香型白酒发酵过程中细菌群落演替及自组装机理
乔美灵,任宇婷,张桂莲,杨玉珍,刘梦宇,孙子羽,陈忠军,满都拉,*
(1.内蒙古农业大学食品科学与工程学院,内蒙古 呼和浩特 010018;2.内蒙古驰原酒业有限公司,内蒙古 呼和浩特 011500;3.内蒙古河套酒业集团股份有限公司,内蒙古 巴彦淖尔 015400)
白酒是我国酿造历史悠久的传统酒类,开放的生产方式使其在发酵过程中涉及多种微生物共同参与。研究显示,白酒中含有上千种风味物质[1],这与其由多种微生物参与发酵密不可分[2]。近年来,基于纯培养[3]、磷脂脂肪酸分析[4]、变性梯度凝胶电泳[5]和高通量测序[6-9]等技术对白酒酿造微生物物种组成、群落结构及群落演替开展大量研究,为后续探究微生物与白酒酿造之间的关系提供理论参考。由于参与白酒酿造的微生物受地理、气候及工艺影响较大,一些特定地区白酒发酵过程中微生物群落自组装,及其朝着有序、有规律方向演替的推动因素还需进一步了解。
鉴别微生物种类、准确了解白酒发酵过程中微生物群落结构及其随时间变化的规律是研究白酒发酵微生物的主要内容。高分辨的菌种注释为揭示白酒微生物群落结构、演变及自组装提供了基础。与二代短片段测序相比,以PacBio SMRT为代表的三代测序技术具有长读长、高通量的优点,通过其特有的CCS(circular consensus sequencing)模式,可将同一条序列多次重复测序后的结果相互校正,从而获得测序质量非常高的一致性序列[10]。借助该技术,研究人员可以进一步获得种水平的物种组成,得到更好的物种注释分辨率,进一步深入解析群体样本的物种组成情况[11]。
环境因素的变化可以驱动微生物群落组成变化[12]。以往有关白酒酿造微生物自组装机制的研究通常基于“整个群落”进行评估[13]。而有学者认为微生物群落自组装过程的真实情况更可能是在基因型和种群水平上发生,而不是整个群落,Ning Daliang等[14]提出基于系统发育的零模型分析方法——iCAMP,这为量化生态过程在控制微生物群落多样性和演替中的相对重要性提供了可靠的工具。研究揭示白酒发酵过程中微生物群落结构组成、演变及自组装规律是深入了解控制群落结构潜在因素以及白酒风味物质形成机理的关键,也是优化多种微生物混合发酵过程,提高产品品质的重要理论基础。因此,本研究以中国传统清香型白酒为研究对象,利用PacBio SMRT测序技术结合统计学方法深入解析清香型白酒发酵过程中细菌物种组成及群落结构,进一步利用iCAMP模型开展清香型白酒发酵过程中群落自组装机理的研究。
1 材料与方法
1.1 材料与试剂
酒醅样品采集自内蒙古一清香型白酒厂(地缸发酵),采集时间为2020年11、12月。分别采集发酵第0、3、5、7、10、12、15、18、21、24、28天的酒醅,每个时间点采集3 个地缸。分别采集地缸的上、中以及底层酒醅(共500 g),混合为一个样品后立即用无菌密封袋包装保存于-80 ℃冰箱。
1.2 仪器与设备
YXQ-LS-100SII立式压力蒸汽灭菌 上海博讯实业有限公司医疗设备厂;DHG-9053A电热恒温鼓风干燥箱上海一恒科学仪器有限公司;SIGMA3-18KS高速冷冻离心机 德国Sigma公司;Veriti梯度聚合酶链式反应仪美国应用生物系统公司;SE602F电子天平 奥豪斯仪器(上海)有限公司;DYY-6D电泳仪 北京六一生物科技有限公司;XW-80A旋涡仪 上海驰唐电子有限公司。
1.3 方法
1.3.1 理化指标测定
温度测定:采用测温计直接测量取样点附近的温度,30 s不变温,记录数值;水分含量、pH值和酸度的测定参考贾丽艳等[15]的方法;淀粉含量的测定参考李大和等[16]的方法;蛋白质含量测定参考GB 5009.5—2010《食品中蛋白质的测定》,采用凯氏定氮法;游离氨基酸态氮含量测定参考GB 5009.239—2016《食品酸度的测定》,采用比色法;乙醇含量的测定参考刘晓等[17]的方法。
1.3.2 酒醅微生物基因组的提取及测序
酒醅微生物基因组采用试剂盒直接提取。称取0.5 g酒醅样品,按照TIANamp Soil DNA Kit说明书进行。利用含有Barcode 引物27 F(5’-AGAGTTTGATCCTGGCTCAG-3’)和1492R(5’-GGTTACCTTGTTACGACTT-3’)扩增细菌16S rRNA V1~V7区域[18]。产物经纯化、定量和均一化形成测序文库(SMRT Bell),质检合格的文库用PacBio Sequel进行测序。
1.4 数据处理与分析
1.4.1 下机数据处理
利用Smrtlink version8.0软件从下机数据中导出CCS文件,根据Barcode序列识别不同样品的数据并转化为fastq格式数据。利用UCLUST软件划分序列(相似度100%)为无重复的单一16S rRNA基因全长序列集。使用USEARCH(version10.0)以相似性97%对序列进行操作分类单元(operational taxonomic units,OTU)划分,用Chimera Slayer去掉含嵌合体的OTU序列,并抽取代表性序列与SILVA(Release132,http://www.arb-silva.de)数据库进行比对注释,确定各OTU的分类学信息,进而计算各样品在属和种水平的相对含量。使用eggNOG数据库(http://eggnog.Embl.de/)对细菌群进行功能预测。
1.4.2 生物信息学分析
通过Shannon指数、Simpson指数[19]、Chao1指数、覆盖率以及Shannon-Wiener曲线[20]评估各样本α多样性和测序质量。基于OTU水平采用加权UniFrac算法和Bray-Curtis算法计算样本间距离矩阵,通过构建UPGMA聚类树[21]和主坐标分析(principal co-ordinates analysis,PCoA)研究不同发酵时间样本间差异。进一步通过LEfSe分析评估各发酵阶段的差异物种[22]。通过计算Spearman相关系数(r),选择|r|>0.60、P<0.05作为网络强相关节点的条件,构建相关性网络图并绘制功能及理化因子与物种间的相关性热图。基于典范对应分析(canonical correspondence analysis,CCA)将微生物群落与理化因子进行关联分析。微生物群落变化使用β多样性分解进行评估[23]。计算归一化随机比(normalized stochasticity ratio,NST)和iCAMP分析细菌群落自组装机制[24]。使用R语言(v4.1.2)进行统计分析和绘图,采用方差分析进行组间差异显著性检验。
2 结果与分析
2.1 发酵过程中细菌群落α多样性
经测序共获得413 198 条细菌CCS序列(均长度为1 500 bp),以97%相似性划分共得到1 761 个OTU。Shannon指数和Simpson指数表征样品中群落的多样性信息,Shannon指数越大、Simpson指数越小,表示群落多样性越高[25]。如图1A、B所示,细菌群落的Shannon指数0 d最高随后逐渐降低,Simpson指数0 d最低随后逐渐升高,说明随发酵进行细菌群落多样性逐渐降低,发酵起始(0 d)时上述两个指数均与发酵结束(28 d)时存在显著差异(P<0.05)。总体来看,发酵12 d后是发酵过程中细菌多样性变化的关键时间段。Chao1指数表征样品中群落的丰度信息,其值越大代表物种总数越多。本研究中,随发酵的进行,细菌菌群的Chao1指数总体呈下降趋势,这表明随着发酵进行物种数逐渐降低,除0 d与10 d的Chao1指数差异显著(P<0.05)外,其余无显著差异(图1C)。如图1D所示,覆盖率均大于0.99,说明样本文库的覆盖率较高。Shannon-Wiener曲线随着测序量的扩大,最终均达到饱和状态(图1E),测序深度满足要求。从α多样性(Simpson、Shannon指数和Chao1指数)变化可以看出,由于入缸时带入不同来源的微生物[26],细菌群落的微生物多样性在0 d达到最大,之后由于发酵过程的进行,微生物需要适应环境的变化以及菌群之间的相互作用导致细菌多样性发生动态变化。
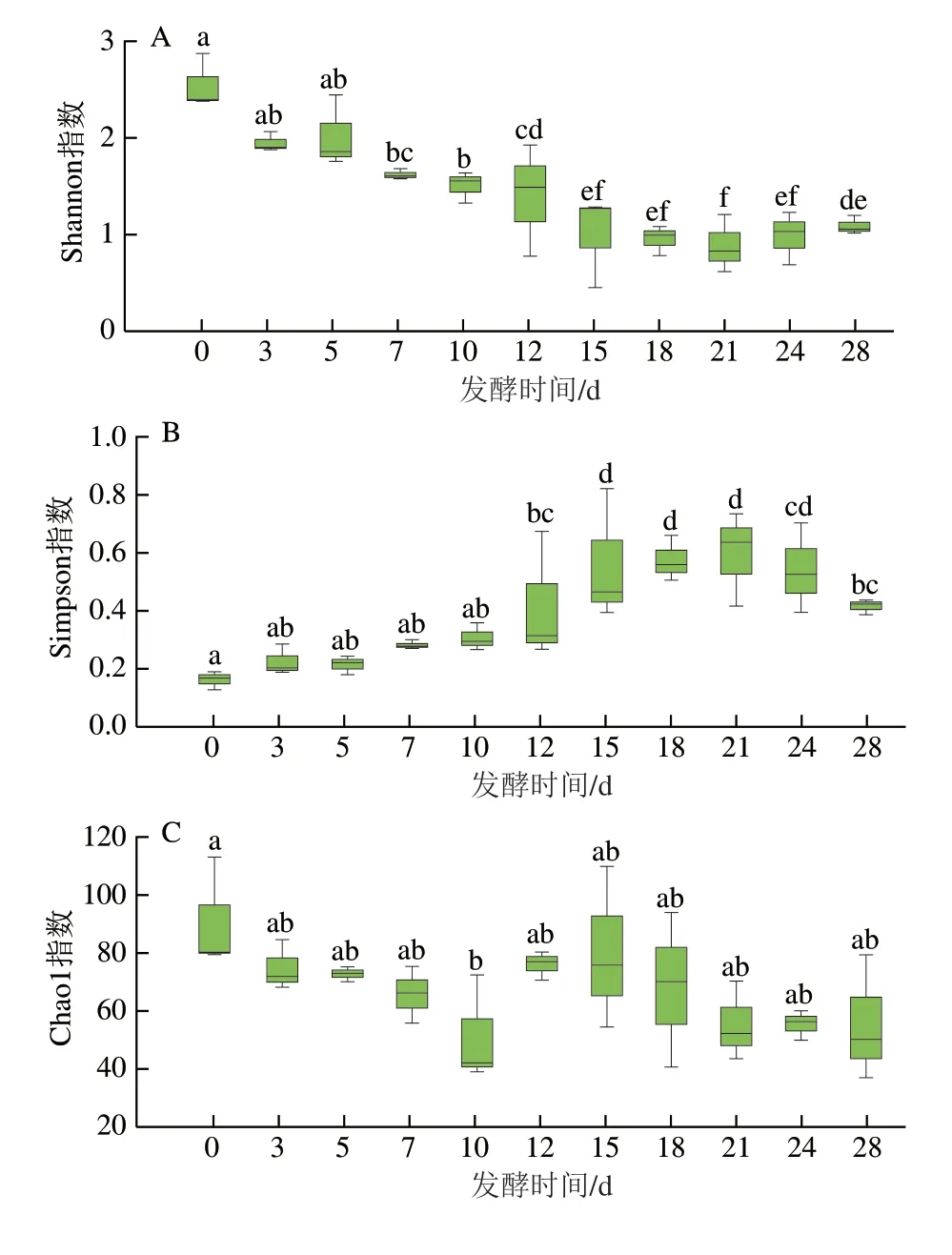
图1 发酵过程中细菌菌群Shannon指数(A)、Simpson指数(B)、Chao1指数(C)、覆盖率(D)和Shannon-Wiener曲线(E)Fig.1 Shannon index (A),Simpson index (B),Chao1 index (C),coverages (D) and Shannon-Wiener curve (E) of bacterial flora during fermentation process
2.2 发酵过程中细菌群落组成分析
如图2A所示,利用所测得的OTU经物种注释共得到87 个菌属,其中乳杆菌属(Lactobacillus)、醋酸菌属(Acetobacter)、片球菌属(Pediococcus)和魏斯氏菌属(Weissella)为优势属(相对丰度大于1%)。发酵0~3 d,Acetobacter的相对丰度从35%下降至0.9%,Weissella从15%下降至0.5%,Pediococcus从10%下降至8%,而Lactobacillus的相对丰度从10%迅速上升至90%。发酵3~10 d,Acetobacter和Weissella的相对丰度一直维持在较低水平(相对丰度小于0.1%),Pediococcus的相对丰度从8%下降至1%。发酵10 d后,Lactobacillus成为绝对优势属(相对丰度大于98%)。发酵12 d时,Acetobacter和其他属的相对丰度呈现小幅度增加。明串珠菌属(Leuconostoc)、葡糖杆菌属(Gluconobacter)、芽孢杆菌属(Bacillus)、驹形杆菌属(Komagataelibacter)和拟杆菌属(Bacteroides)在发酵0 d时相对丰度均较小(小于0.5%)。
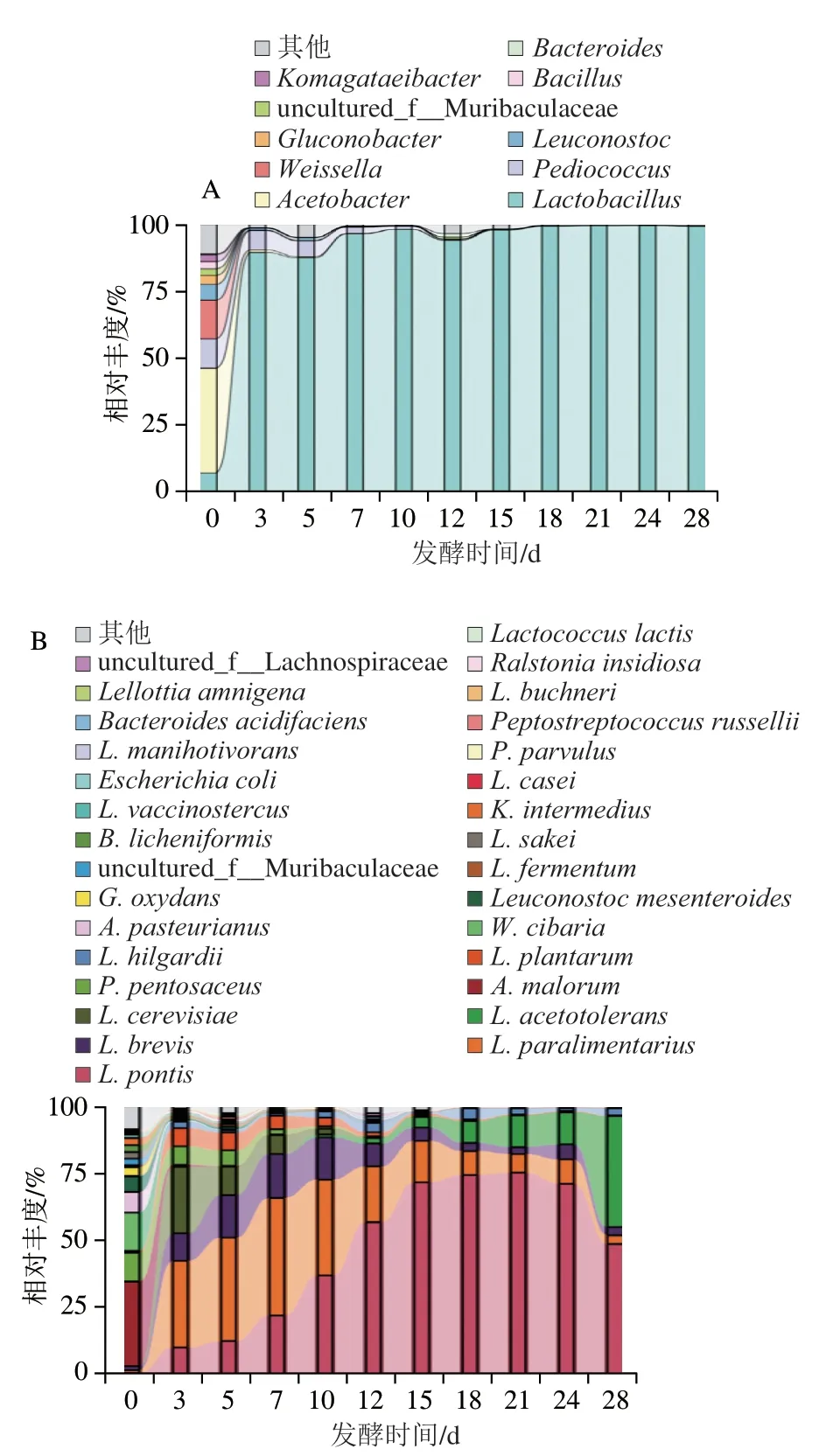
图2 发酵过程中细菌群落属水平(A)和种水平(B)组成Fig.2 Composition of bacterial communities at the genus level (A) and species level (B) during the fermentation process
在种水平上共得到124 个菌种,其中桥乳杆菌(L.pontis)、类消化乳杆菌(L.paralimentarius)、短乳杆菌(L.brevis)、耐酸乳杆菌(L.acetotolerans)、啤酒乳杆菌(L.cerevisiae)、苹果醋杆菌(A.malorum)、戊糖片球菌(P.pentosaceus)、植物乳杆菌(L.plantarum)、希氏乳杆菌(L.hilgardii)和食窦魏斯氏菌(W.cibaria)为优势菌种(相对丰度大于1%)。在发酵0~3 d时,L.pontis、L.paralimentarius、L.brevis、L.cerevisiae和L.plantarum的相对丰度逐渐升高,而A.malorum、P.pentosaceus和W.cibaria的相对丰度逐渐下降至1%。发酵3~10 d时,L.cerevisiae和P.pentosaceus的相对丰度逐渐下降至1%,而L.pontis的相对丰度逐渐升高。发酵12~28 d时,L.acetotolerans相对丰度从1%上升至40%。发酵28 d时,L.acetotolerans和L.pontis成为优势菌。其余细菌在发酵0 d相对丰度较高,但随着发酵过程的进行,相对丰度逐渐降低并维持在较低水平(相对丰度小于1%)(图2B)。
2.3 发酵过程中细菌群落β多样性
如图3A所示,发酵0 d样品与其他时间样品存在显著差异,成为单独一个分支。其他时间样品又分为3~10 d和12~28 d两个分支,说明整个发酵可分为3 个阶段:0(I)、3~10 d(II)和12~28 d(III)。PCoA结果(图3B)显示,PCo1的贡献率为55.3%,权重最大,说明细菌群落随发酵过程的推进主要沿PCo1轴方向发生变化,并且沿PCo1轴正方向相邻时间点样本的间距越来越小,说明群落结构逐渐趋于一致,这与聚类分析结果一致。综上,发酵第0、3、12天可能是反映整个发酵过程微生物群落动态变化的主要时间节点。进一步利用方差分析(图3C)研究3 个发酵阶段的差异性发现,3 组组间差异大于组内差异,且差异显著(P<0.001),表明将发酵过程分为3 个发酵阶段是合理的。
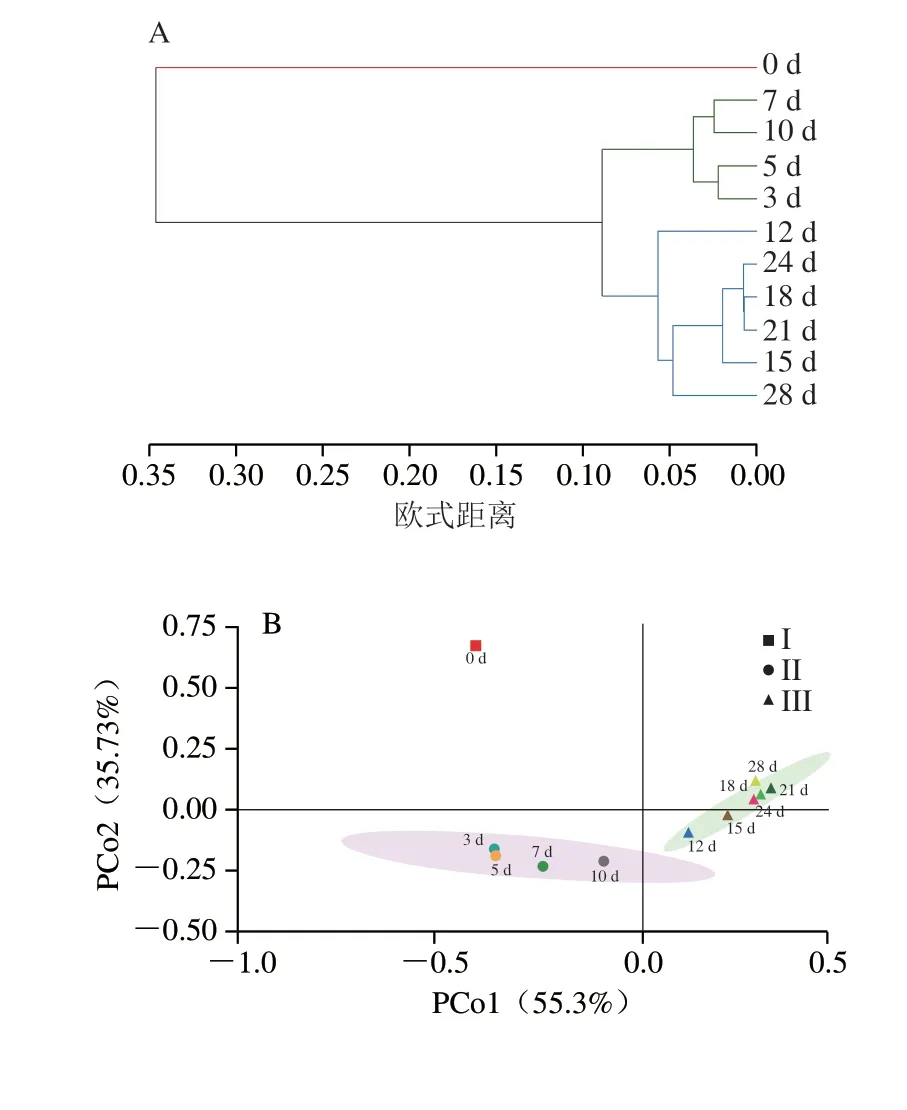
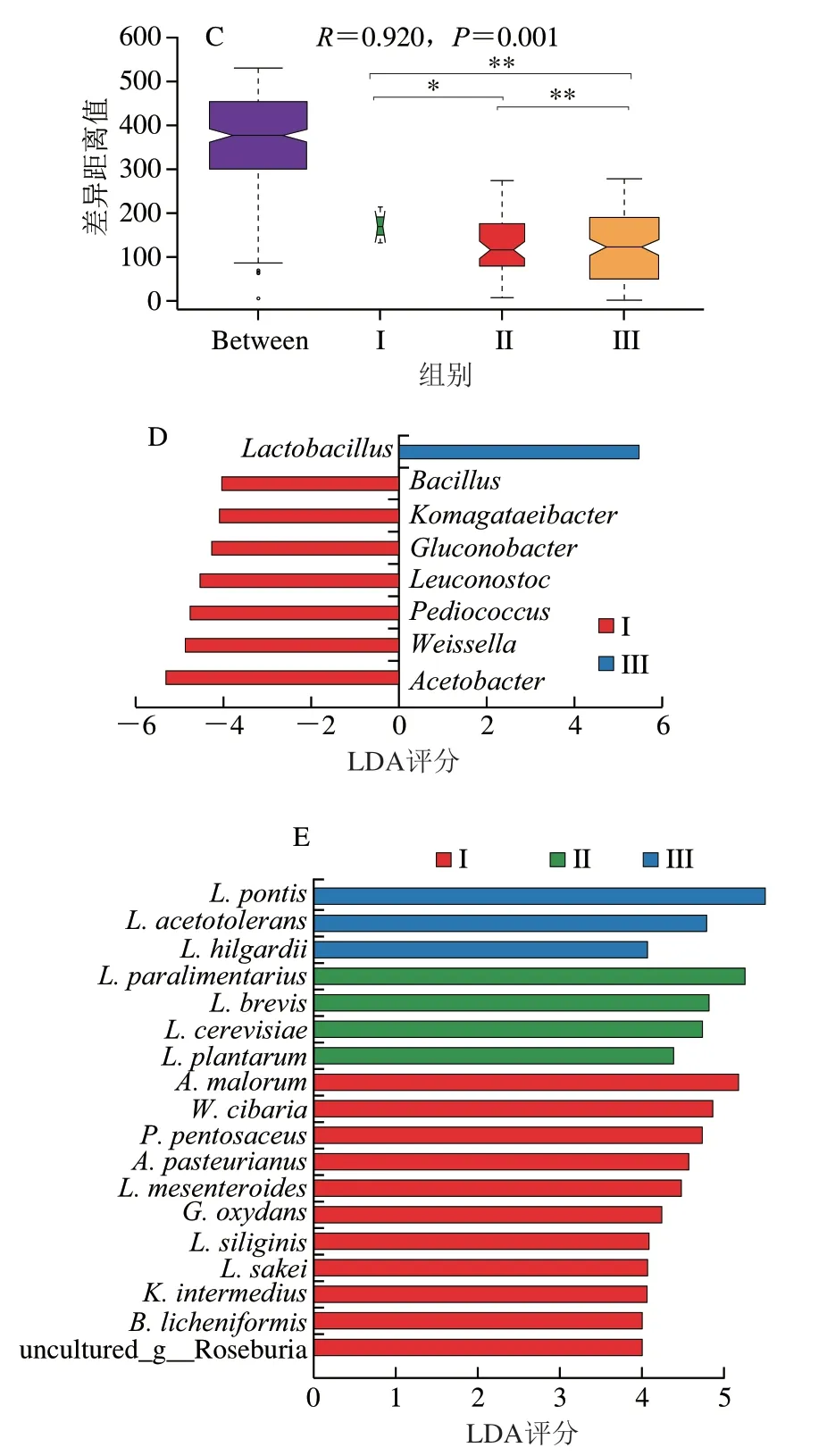
图3 发酵过程中细菌群落的β多样性Fig.3 β-Diversity of bacterial flora during fermentation
为进一步明确不同发酵阶段中具有显著差异物种信息,通过LEfSe分析研究各阶段差异菌种。如图3D所示,各发酵阶段细菌群落的差异物种主要来自8 个属,大部分为优势属,但阶段II中没有差异菌属。其中阶段I有11 个显著性差异物种,分别为A.malorum、W.cibaria、P.pentosaceus、巴氏醋杆菌(A.pasteurianus)、肠膜明串珠菌(L.mesenteroides)、氧化葡萄糖杆菌(G.oxydans)、白面粉乳杆菌(L.siliginis)、清酒乳酸杆菌(L.sakei)、中间驹形氏杆菌(K.intermedius)、地衣芽孢杆菌(B.licheniformis)和罗氏菌属中未分类的种(uncultured_g_Roseburia)。阶段II有4 个显著性差异菌种,为L.paralimentarius、L.brevis、L.cerevisiae和L.plantarum。阶段III有3 个显著性差异菌种,分别为L.pontis、L.acetotolerans和L.hilgardii。阶段I、II和III中A.malorum、L.paralimentarius和L.pontis的线性判别分析(linear discriminant analysis,LDA)评分最高,分别为其主要的差异菌种(图3E)。
2.4 差异菌种间相关性网络分析
通过计算Spearman相关系数研究发酵过程中差异细菌间的共存关系。选择|r|>0.60、P<0.05作为网络强相关节点的条件筛选出10 个菌种,进行绘图,如图4所示。细菌群落中L.acetotolerans与各发酵阶段的差异细菌具有显著相关性(P<0.05)。阶段I的差异菌种之间均呈正相关,其中A.malorum、W.cibaria、A.pasteurianus、K.intermedius、P.pentosaceus、G.oxydans和L.sakei,这些菌种具有较高的有机酸和乙酸生产能力,可以导致酒醅酸化,维持发酵的正常进行,也为乳酸乙酯的合成提供了前体物质;L.siliginis多分离于酸面团中;而L.mesenteroides和B.licheniformis可以释放各种酶水解酒醅中的蛋白质和淀粉,为发酵过程中微生物提供物质及能量[27]。阶段II的差异菌种之间呈正相关,其中L.paralimentarius利用葡萄糖发酵产酸,L.plantarum可产丁酸[28],L.brevis具有较高的γ-氨基丁酸生产能力[29],而L.cerevisiae在白酒中的研究较少,其在白酒酿造过程中的具体作用还需进一步研究。阶段III的3 个差异菌种之间也呈正相关,L.pontis为异型发酵乳酸菌,可改善面包的风味和味道[30-31],L.acetotolerans可以促进具有水果味、花香和甜香酯类物质风味的产生[32],L.hilgardii参与葡聚糖的产生[33],促使某些细菌的生长。发酵过程中微生物群落结构的差异影响微生物之间的相互作用。不同发酵阶段的差异菌种之间呈负相关,同一发酵阶段的差异菌种之间呈正相关,这是可能由于各阶段的“分工”不同导致微生物之间存在竞争和共生等关系[34]。
2.5 发酵过程中环境因子变化及其与细菌群落间的关系
如图5所示,随着发酵的进行,理化因子呈明显动态变化。水分含量、酸度和蛋白含量呈现上升趋势,淀粉含量和pH值呈现下降趋势。而温度呈现先上升后下降趋势,氨基酸态氮和乙醇含量呈现先升高后降低再升高的变化规律。
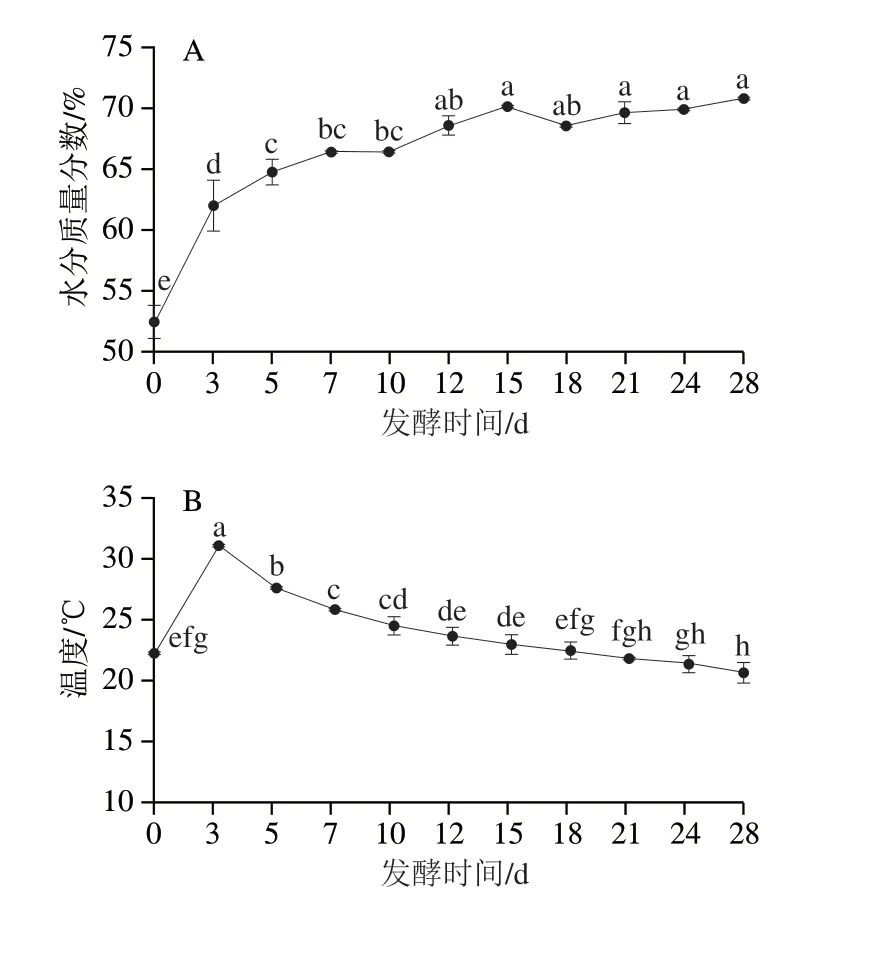
图5 发酵过程中理化指标动态变化Fig.5 Dynamic changes in physicochemical indicators during fermentation
基于CCA将微生物群落与理化因子进行关联分析,排序轴CC1贡献率为54.19%,排序轴CC2贡献率为28.44%(图6A)。pH值和淀粉含量主要影响阶段I的细菌群落,其中淀粉含量的影响最大,在这一阶段中淀粉分解成还原糖,充足的糖供应有利于微生物的生长和代谢[35]。温度和氨基酸态氮含量主要影响发酵阶段II的细菌群落,其中温度对细菌群落的影响最大,温度的变化反应酒醅发酵是否正常,这是微生物的生长代谢产生生物热与酒醅发酵环境热能传递平衡的结果[36]。酸度、水分和蛋白质含量主要影响发酵阶段III的细菌群落,其中水分含量影响较大,水分含量是酿酒过程中关键指标之一,酒醅所含水分含量影响发酵空间的气密性,水分含量偏高导致发酵的气密性差,抑制好氧菌的生长,增加厌氧菌的生长,容易发生酸败;如果酒醅水分含量偏低,对出酒率和酒品质都有影响[37]。差异菌种与环境因子相关性(图6B)表明,阶段I的差异菌种主要与pH值呈正相关,与酸度呈负相关,其中L.mesenteroides和P.pentosaceus呈高度正相关(P<0.001)。阶段II的差异菌种主要与温度呈正相关,其中L.plantarum和L.cerevisiae与温度高度相关(P<0.001)。在阶段III的差异菌种中L.acetotolerans与水分和酸度呈高度正相关(P<0.001),与pH 值、温度呈高度负相关(P<0.001),这表明不同种类的细菌受不同环境影响较大,具体情况还需对菌株进一步分离验证。

图6 细菌群落与理化因子CCA(A)和差异菌种与理化指标相关性热图(B)Fig.6 CCA of bacterial community and physicochemical factors (A) and heatmap of correlation between differential species and physicochemical indicators (B)
2.6 发酵过程中细菌群落自组装机理
微生物群落变化通常归于两种现象:物种替换(不同样本间物种交换和替代)和物种流失(物种的增加或减少)[38]。如图7A、B所示,本研究的发酵过程中物种替换(图7B)几乎贡献了大部分的细菌群落演替。随着发酵过程的进行,物种替换呈现先上升后下降再上升的变化趋势,与物种流失(图7A)呈现相反的变化。阶段I细菌群落的替换最低,可能是由于环境细菌的进入导致细菌多样性增加,而阶段II、III,由于在发酵过程中微生物的代谢活动导致酿造环境发生变化,从而使替换迅速升高。总之,替换是群落演替的主要机制,同时流失对于细菌群落结构的演替也至关重要。不同发酵阶段的替换发生率呈现上升趋势,表明发酵阶段中的细菌群落中的物种在不断发生交换和替代,细菌群落因发酵过程的进行而发生演替。
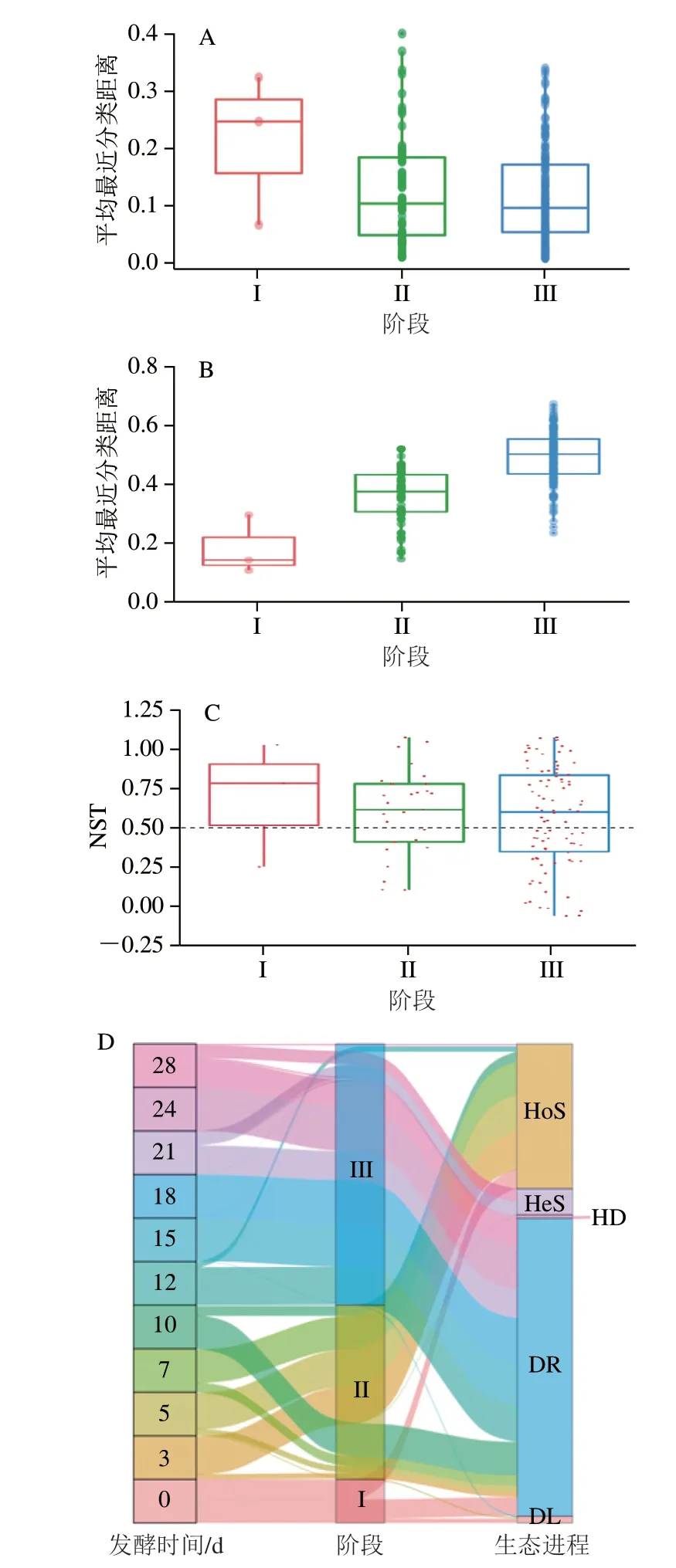
图7 β多样性分解(A、B)、NST评价(C)和自组装动态变化Sankey图(D)Fig.7 Decomposition of beta-diversity (A and B),NST evaluation (C) and Sankey diagram showing dynamic changes in self-assembly (D)
为探索确定性和随机性对微生物群落组装的相对重要性,基于零模型的NST进行评价,如图7C所示,随机过程主导了整个发酵过程中细菌群落的组装结果。发酵过程中细菌群落的绝大部分NST>0.5,表明整个过程主要受到随机性过程的影响。而在阶段II和III,少数细菌群落也会受到确定性(NST<0.5)的影响,表明随着发酵过程的进行,微生物对原料的分解和其自身代谢活动使细菌群落受到随机性和确定性过程的影响。此外,iCAMP方法将确定性和随机性过程分为5 个特定的生态过程(图7D)。确定性过程包括均匀选择(homogeneous selection,HoS)和异质选择(heterogeneous selection,HeS),而随机过程包括扩散限制、均匀扩散和漂移(drift,DR)[14]。其中DR是发酵过程中细菌群落的主要过程,其次是HoS和HeS。然而,不同发酵阶段呈现不同的过程,阶段I小部分为HoS,可能因为发酵0 d引入大量的环境微生物导致酒醅中某些微生物发生变化。阶段II大部分为HoS,这种均匀选择是由于一定的环境选择压力导致,阶段III大部分为DR,这很大可能是因为发酵环境的随机性扰动。综上,随着发酵进行,细菌群落自组装主要受到随机过程中DR的影响。
结合理化因子与细菌群落之间的相关性,因此推测淀粉含量是影响阶段I的细菌群落演替的主要因素,温度和水分含量分别是影响阶段II和阶段III的细菌群落演替的重要因素。
3 讨论
微生物多样性赋予传统发酵食品多样的菌群结构,其中核心微生物既为风味赋予特征性与多样性,也为产品的质量提供稳定性[39]。精准定位参与传统发酵食品中微生物物种、揭示发酵过程中微生物群落结构变化及群落自组装机理对进一步提升产品质量及安全性意义重大。本实验利用PacBio SMRT测序技术开展传统清香型白酒发酵过程中细菌群落的多样性及结构演替规律的研究。
在发酵过程中,细菌的多样性和丰度表现出明显的特征和动态变化。高丰度优势微生物通常被认为是食品发酵的重要组成部分[40]。经注释分析,在本研究中有4 个广泛分布的细菌属(Lactobacillus、Acetobacter、Pediococcus和Weissella),这与其他研究报道结果[41]有所差异,这可能与地区原料环境不同有关。扩增子全长测序能够更精确地定位物种信息,也为进一步分析其功能奠定基础。本研究中优势物种主要有L.pontis和L.acetotolerans,这与山西汾酒[42]、牛栏山二锅头[43]和青稞酒[44]等清香型白酒酿造系统中报道的优势乳酸菌种有明显差异。此外,发酵0、3 d和12 d是细菌α多样性、β多样性和物种组成动态变化的主要时间节点。
进一步根据细菌菌群的差异将整个发酵过程可分为3 个阶段:I阶段(0 d)、II阶段(3~10 d)和III阶段(12~28 d)。不同发酵阶段具有不同的标志性差异菌种,这些差异菌种一部分来自优势菌种,另一部分来自稀有菌种。其中A.malorum(阶段I)、L.paralimentarius(阶段II)和L.pontis(阶段III)是各发酵阶段主要的差异菌种。微生物群落是在资源竞争、营养共生和群体感应等相互作用下形成的复杂生态系统[45]。L.acetotolerans、L.pontis与其他菌种均相关,不同发酵阶段中差异菌种之间呈负相关,属于同一发酵阶段的差异菌种之间呈正相关,说明其中各物种在发酵过程中发挥的作用不同,此外还存在物种之间的相互竞争与共生等关系[43]。
清香型白酒的酿造属于固态发酵法,是边糖化边发酵工艺[46]。糖化主要是淀粉等多糖酶解转化形成葡萄糖等可发酵性糖,发酵主要完成葡萄糖到乙醇及微量风味组分的转变[47]。阶段I中淀粉含量高,微生物繁殖快,短时间内生成大量发酵热,导致酒醅温度升高,微生物利用氧气进行生长繁殖及各类代谢活动产生CO2,引起pH值降低,酸度升高。阶段II中随着淀粉被消耗,微生物繁殖速度降低,酒醅温度下降,厌氧及兼性厌氧细菌微生物的大量增殖生成多种有机酸,导致酒醅酸度增加,适量的酸能增加白酒的后味,使酒体更加丰满。在阶段III中一些具有酯化作用的微生物代谢产生较多的酶,对阶段I生成的酸和醇产生催化酯化反应的作用,酸度的增加有利于酯类物质的形成,酯类物质的生成会消耗酸类物质,导致pH值逐步降低。酯类的生成会消耗乙醇以及厌氧微生物利用乙醇进行生长繁殖[48],造成乙醇含量呈现动态变化。酒醅中的水分一部分来自于酿造用水,另一部分来自于酿酒微生物发酵代谢[49],水分为整个发酵顺利进行奠定基础。差异菌种与理化因子关联分析发现,阶段I和II的微生物与淀粉含量、pH值和温度正相关,阶段III的差异菌种主要与酸度、水分含量和氧化还原电位呈正相关。因此,发酵环境对发酵过程影响显著[50]。
发酵过程中,物种替换和物种流失两种现象导致微生物群落多样性的形成,而影响其形成和自组装的生态进程包括基于环境选择和生物竞争生态位理论的确定性过程,以及基于扩散和随机出生死亡中性理论的随机性过程[51]。清香型白酒发酵过程中大部分细菌群落几乎都是替换现象[13],基于iCAMP群落组装进一步挖掘发现主要为随机性过程中的生态DR[52],即入缸时(阶段I)带入的微生物定植并占据酒曲微生物的生态位造成细菌菌群的随机出生、死亡和繁殖,这种现象可能来源于淀粉含量的影响,白酒酿造中多数细菌依赖真菌降解淀粉产生的还原糖作为碳源,进行生长繁殖和代谢。酿造过程中因为原料和酒曲的不同导致所产生的还原糖不同,进而导致细菌所利用的碳源不同,最终影响细菌群落的结构差异[53]。因此淀粉含量是影响阶段I细菌群落自组装的主要因素。温度可以在短时间内影响白酒酿造过程中功能微生物群落结构(阶段II),导致发酵环境发生扰动,细菌受到均匀选择促使一些细菌群落发生系统发育性聚集,使得更适应这种环境微生物的相对丰度提高。水分含量的控制是代谢活动和生命的关键组成部分,阶段III作为细菌呼吸作用的最后阶段,各种芳香化合物(主要是酸和酯)通过物理变化(范德华相互作用等)与化学反应(如还原、氧化和酯化等)实现平衡[54]。所以水分含量是导致阶段III的细菌群落自组装的主要因素。而且不同生物体对环境变化的反应也存在很大的差异。在不同微生物种群中,分散能力、多样化和对DR的敏感性也有本质上的不同。这些因素最终造成发酵过程由选择的确定性过程逐渐向DR主导的随机性过程转变。
综上所述,由于开放的发酵环境和动态的发酵过程,清香型白酒发酵过程中所涉及的微生物群落表现出明显的多样性和动态性。本研究通过对清香型白酒发酵过程中细菌菌群物种进行精准定位,揭示细菌群落结构的演替及自组装机制,为进一步提升清香型白酒酿造工艺,优化产品稳定性和安全性提供了基础理论。然而,本研究只关注了酒醅发酵过程中优势细菌菌种的演替,除此之外还存在大量的低丰度物种,这些物种随着发酵过程的进行还可能具有一定的功能和对群落自组装的贡献。因此,未来应结合测序技术的理论知识,将PacBio SMRT测序和传统微生物培养方法相结合,根据酒醅发酵基质环境和不同微生物生物学特征,进一步对中、低丰度的微生物物种进行分离和功能验证。

