食用菌发酵对人参不溶性膳食纤维结构及功能特性的影响
赵宇楠,贾丹丹,蔡 丹,王泽贤,高 飞,刘景圣
(吉林农业大学食品科学与工程学院,小麦和玉米深加工国家工程中心,吉林 长春 130000)
人参是我国传统名贵中药材,也是药食同源的滋补佳品[1]。人参渣是人参活性成分提取过程中伴随产生的副产物,含有大量膳食纤维[2],在生产加工中常常被丢弃,造成了资源的浪费和环境的污染[3]。不溶性膳食纤维(insoluble dietary fiber,IDF)是膳食纤维的主要成分,含有大量如羟基、羧基、酰胺基等活性基团,赋予其较好的水油保持能力、吸附能力和阳离子交换能力,能够调节血糖、降低胆固醇和预防肥胖等[4]。但是天然IDF结构紧密,不能使这些活性基团充分暴露出来,功能特性也因此受限[5],而且由于其不溶于水、口感粗糙的特点,被加入到食品中后,可能会对食品的颜色、质地、风味和味道产生不利影响。因此,采用适当的改性技术充分改善IDF的结构和理化性质,进而提高其功能特性成为近年来的研究热点[6]。
目前,IDF的改性方法主要有物理法、化学法和生物法,如挤压法、蒸汽热处理法、超声处理法、纤维素酶法、木聚糖酶法以及微生物发酵法。微生物发酵法是一种温和、高效的改性膳食纤维方法[7],利用微生物发酵制备的IDF,通常具有更好的结构和功能特性[8-9]。Chu Jiaxi等[10]用纳豆芽孢杆菌处理小米糠IDF,改性后样品结构更加疏松多孔,对葡萄糖、胆固醇和胆酸盐的吸附能力显著提高。Wang Xiujuan等[11]用马克思克鲁维酵母对豆渣IDF进行改性,改性后的样品具有疏松多孔的微观结构,热稳定性提高,持水力、持油力、胆固醇吸附能力、胆汁酸吸附能力、葡萄糖吸附能力均得到改善,可作为食品中的功能成分。羊肚菌、猴头菌和蜜环菌是我国著名的食药两用型真菌,也是公认的安全菌株[12-14],其子实体含有大量营养物质和活性成分,被广泛应用于功能食品的开发和利用中。但食用菌子实体栽培时间较长、且对环境有较高要求,因此通过液态发酵技术获得食用菌发酵产物成为近年来的研究热点[15-16]。研究表明,食用菌发酵物(菌体和发酵液)和子实体一样不仅富含营养成分,还富含多糖、多酚、酶类等活性成分,可应用于功能性食品的开发与研制中[17-18]。羊肚菌、猴头菌和蜜环菌在液态发酵过程中能产生丰富的酶系,包括羧甲基纤维素酶、木聚糖酶、漆酶等,可以分解利用IDF的主要成分——纤维素、半纤维素和木质素[14,19-20],在实现对IDF改性的同时赋予其更多功效。
本研究以人参渣为主要研究对象,采用羊肚菌、猴头菌和蜜环菌生物转化人参IDF,比较发酵前后人参IDF的结构差异和功能特性,探究食用真菌发酵对人参IDF的影响,为人参渣的综合利用提供理论依据。
1 材料与方法
1.1 材料与试剂
人参渣由陕西鑫田生物科技有限公司提供;蜜环菌Am-07-22(Armillaria mellea)、猴头菌He-02-06(Hericium erinaceus)、羊肚菌Me-01-09(Morchella esculenta)由吉林农业大学小麦和玉米深加工国家工程中心提供。
热稳定α-淀粉酶液、蛋白酶液、淀粉葡萄糖苷酶液上海今品化学技术有限公司;其他试剂均为分析纯。
1.2 仪器与设备
Sigma 300扫描电镜(scanning electron microscope,SEM)德国ZEISS公司;VERTEX 70傅里叶变换红外光谱(Fourier transform infrared spectroscopy,FTIR)仪德国Bruker公司;Q2000差示扫描量热(differential scanning calorimetry,DSC)仪 美国TA公司;BT-9300HT型激光粒度分布仪 丹东百特科技有限公司;FD-1A-50冷冻干燥机 北京博医康实验仪器有限公司;DK-S-S24数显恒温水浴锅 常州市金坛友联仪器研究所;S/N415-1966全波长全自动多功能酶标仪 美国Omega公司;LD5-2B低速离心机 北京雷勃尔离心机有限公司;HZQ-F160全温振荡培养箱 哈尔滨市东联电子技术开发有限公司;DSX-18L-I手提式高压蒸汽灭菌器上海申安医疗器械厂;FW100高速粉碎机 天津市泰斯特仪器有限公司。
1.3 方法
1.3.1 菌种活化与培养基制备
菌种活化:将保藏的蜜环菌、猴头菌及羊肚菌转接至麦芽汁斜面培养基,放置于培养箱,在27 ℃条件下培养12 d至菌丝体长满斜面后,分别接种到各自发酵培养基,接种量10%、转速160 r/min、27 ℃的条件下恒温培养6 d,制备发酵种子液。
Am-07-22发酵培养基:马铃薯20%、蚕蛹粉0.5%、葡萄糖1%、蔗糖1%、酵母浸粉2%、磷酸二氢钾0.15%、七水合硫酸镁0.075%、VB10.001%,pH值自然,121 ℃灭菌20 min;He-02-06发酵培养基:葡萄糖2%、酵母浸粉1%、磷酸二氢钾0.12%、七水合硫酸镁0.075%、七水合硫酸铁0.001%,pH值自然,121 ℃灭菌20 min;Me-01-09发酵培养基:葡萄糖2%、酵母浸粉1%、可溶性淀粉2%、磷酸二氢钾0.3%、七水合硫酸镁0.06%,pH值自然,121 ℃灭菌20 min。
人参发酵培养基的制备:按照料液比1∶15(g/mL)配制人参发酵培养基,121 ℃灭菌20 min,完成后冷却备用,根据实验室前期研究,接入发酵种子液(8%)于发酵培养基中,培养条件27 ℃、160 r/min,培养6 d后备用。
1.3.2 人参IDF的提取
参照GB 5009.88—2014《食品中膳食纤维的测定》中的酶解方法。
1.3.3 人参IDF的结构测定
1.3.3.1 SEM分析
通过SEM对人参IDF的微观结构进行表征,设置加速电压为5 kV,将冷冻干燥样品镀金后上机观察。
1.3.3.2 粒径分析
使用激光粒度分析仪测定样品粒度分布,颗粒折射率与分散剂折射率分别为1.470和1.330。
1.3.3.3 FTIR
将样品与溴化钾以1∶100的比例混匀,研磨成粉后压制成片,进行全波段扫描(4 000~500 cm-1),测定FTIR光谱曲线。
1.3.3.4 X射线衍射
利用X射线衍射仪分析样品的晶体结构。主要参数:Cu靶,管压20 kV,扫描速率4°/min,测试范围5°~50°(2θ角),角度步长为0.02°。
1.3.3.5 DSC分析
参考牛希等[21]的方法,IDF热特性通过DSC仪测定,取3 mg样品于铝盒中,压片并以空铝盒为对照。以10 ℃/min速率由30 ℃升至300 ℃。使用Universal Analysis软件分析得到热曲线。
1.3.4 人参IDF功能特性的测定
1.3.4.1 持水力
参照周贺霞等[22]方法稍作修改,将50 mL离心管干燥至质量恒定,准确称取0.1 g(精确到0.001 g)样品干粉于离心管中,加入10 mL蒸馏水,摇匀,室温下浸泡1 h,随后4 500 r/min离心15 min,弃上清液,称样品质量,重复3 次。持水力计算公式如下:
式中:M0为样品质量/g;M1为吸水后品质量/g。
1.3.4.2 持油力
参照Marcin等[23]方法稍作修改,将50 mL离心管干燥至质量恒定,准确称取0.1 g(精确到0.001 g)样品干粉于离心管中,加入10 mL食用油,室温下混合1 h。在4 500 r/min离心15 min,弃上清液,称样品质量,重复3 次。持油力计算公式如下:
式中:M0为样品质量/g;M1为吸油后样品质量/g。
1.3.4.3 水膨胀力
参照Zhang Zipei等[24]的方法略作修改,准确称取0.3 g样品于干燥后的10 mL量筒中,使表面平整,记录体积读数V2。倒入5 mL蒸馏水,室温下混合24 h,记录水合后体积读数V1,重复3 次。水膨胀力计算公式如下:
式中:M0为样品质量/g;V2为膨胀前样品体积/mL;V1为静置24 h后液体体积/mL。
1.3.4.4 葡萄糖吸附能力
参考Peerajit等[25]的方法稍作修改,向50 mL浓度分别为50、100、150、200 mmol/L的葡萄糖溶液中加入0.5 g样品,充分振摇。37 ℃水浴6 h后以4 000 r/min离心20 min,取上清液,利用3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)法测定葡萄糖质量浓度,以未加入样品的葡萄糖溶液为对照。测定吸附前后葡萄糖质量浓度,根据下式计算样品的葡萄糖吸附能力:
式中:M0为样品质量/g;C1为吸附前上清液中葡萄糖质量浓度/(mg/mL);C2为吸附后上清液中葡萄糖质量浓度/(mg/mL);V为葡萄糖溶液体积/mL。
1.3.4.5 葡萄糖透析延缓能力
参考Zheng Yajun等[26]的方法稍作修改,将0.5 g样品与15 mL 0.2 g/100 mL葡萄糖溶液混匀并装入透析袋(mw=80 000~14 000 Da)中。将透析袋放入含200 mL蒸馏水的三角瓶中,37 ℃振荡1.5 h,每隔15 min取2 mL透析液,利用DNS法测定葡萄糖质量浓度。用蒸馏水替换葡萄糖以除去样品中的糖作为空白组,以不含样品的葡萄糖溶液作为对照组,根据下式计算样品葡萄糖透析延缓能力:
式中:A1为样品组中的葡萄糖质量浓度/(mg/mL);A2为样品空白组中的葡萄糖质量浓度/(mg/mL);A3为对照组中的葡萄糖质量浓度/(mg/mL)。
1.3.4.6 胆固醇吸附能力
参考程明明[27]的方法稍作修改,取鸡蛋黄,用9 倍蒸馏水将其充分搅打成乳液,调节体系pH 2(模拟胃环境)和pH 7(模拟肠道环境),准确称取1.0 g样品于100 mL三角瓶中,加入25 mL蛋黄乳液,充分搅拌后置于摇床中,在37 ℃充分振荡2 h,随后4 000 r/min离心20 min,采用邻苯二甲醛法测定胆固醇含量,根据下式计算样品胆固醇吸附能力:
式中:M1为吸附前上清液中胆固醇含量/mg;M2为吸附后上清液中胆固醇含量/mg;M0为样品质量/g。
1.3.4.7 胆酸钠吸附能力
称取0.1 g样品于100 mL三角瓶中,加入0.2 mg/mL胆酸钠溶液20 mL,调节体系pH 7(胆汁酸只在肠道中代谢,只需模拟肠道环境),37 ℃振荡,分别进行15、30、45、60、75、90 min后,4 000 r/min离心20 min,采用糠醛比色法测定胆酸钠含量,根据下式计算样品胆酸钠吸附能力:
式中:M1为吸附前上清液中胆酸钠含量/mg;M2为吸附后上清液中胆酸钠含量/mg;M0为样品质量/g。
1.3.4.8 亚硝酸钠吸附能力
参考杨晓宽等[28]方法稍作改动,准确称取0.1 g样品于250 mL三角瓶中,加入50 mL 20.0 μg/mL NaNO2溶液,调节体系pH 2(模拟胃环境)和pH 7(模拟肠道环境),37 ℃振荡,分别进行15、30、60、120、150、180 min后,各取5 mL样液稀释至100 mL,再取25.0 mL稀释液,加入2 mL 4 g/L对氨基苯磺酸溶液,混匀静置3 min,再加入1 mL 2 g/L盐酸萘乙二胺溶液,加蒸馏水至刻度并混匀,静置15 min后在538 nm波长处测定吸光度。以等比稀释的未添加样品溶液为空白组进行对照实验,根据下式计算样品的亚硝酸盐吸附能力:
式中:M1为吸附前体系中亚硝酸盐含量/μg;M2为吸附后体系中亚硝酸盐含量/μg;M0为样品质量/g。
1.3.4.9 阳离子交换能力
参考Zhang Mengyun等[29]的方法稍作修改。准确称取1.0 g样品,与50 mL 0.1 mol/L盐酸溶液充分混合,并于37 ℃充分酸化24 h。酸化结束后,4 000 r/min离心15 min,收集沉淀并用蒸馏水进行充分洗涤,直到无Cl-检出为止。随后放置于60 ℃烘箱中干燥得到酸化后的样品。称取0.1 g样品,加入50 mL 5%的NaCl溶液并充分混匀,用0.01 mol/L NaOH溶液进行滴定,记录初始pH值和每加入50 μL NaOH溶液后混合物体系的pH值。
1.4 数据处理与分析
2 结果与分析
2.1 SEM分析
如图1所示,经3 种食用菌发酵后的样品相比发酵前出现大量片状结构以及蜂窝状孔洞,比表面积增大,整体结构变得疏松。说明3 种食用菌在发酵过程中都能产生活性物质破坏纤维的结构,使原本较为致密的结构变得疏松多孔。这种疏松多孔的结构可以导致更多的极性和非极性基团暴露,从而提高膳食纤维的水合特性和吸附能力[30]。Chu Jiaxi等[10]报道了经纳豆芽孢杆菌发酵后小米糠膳食纤维结构更加松散,疏松多孔,使其吸附特性增强。Wang Chaofan等[31]报道了经纤维素酶处理过的姜渣IDF结构由致密变得松散,表面出现类似海绵状结构且产生大量孔隙。本研究也表现出类似的变化及特征。
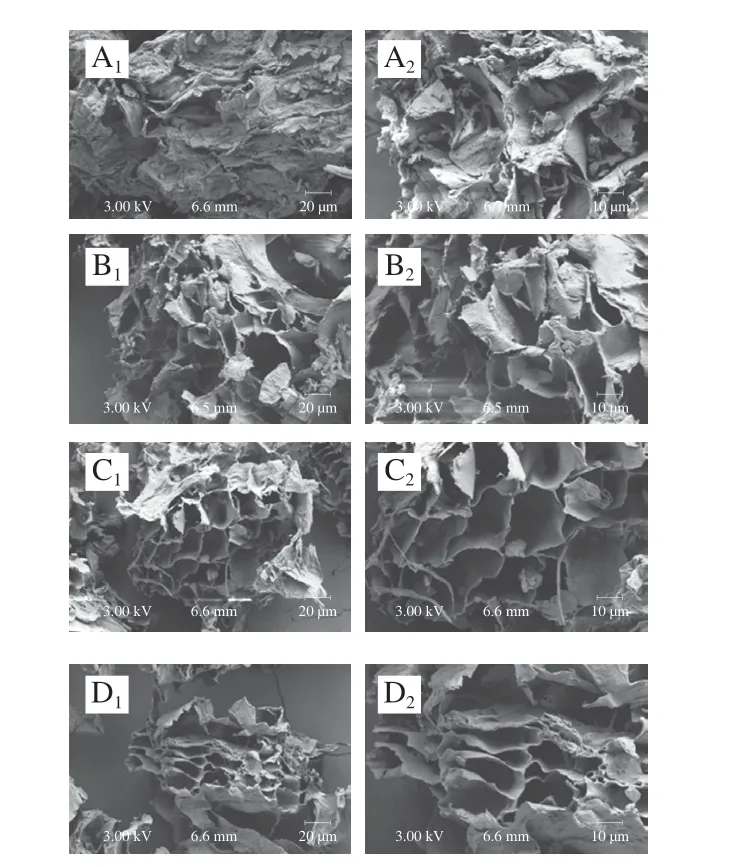
图1 不同食用菌发酵人参SEM图Fig.1 SEM images of ginseng fermented with different edible fungi
2.2 粒径分析
如图2所示,经3 种食用菌发酵后的人参IDF粒径分布的主峰都出现了左移现象,未发酵样品只有一个粒径分布峰,发酵后的样品在3~26 μm出现小峰,说明发酵产生的纤维素酶等活性物质对人参IDF有一定降解作用,人参IDF的大颗粒物质被分解成小分子颗粒[32],这与SEM结果一致。粒径的减小会使人参IDF暴露出更多功能基团,有助于人参IDF发挥出更好的理化及功能特性[6]。
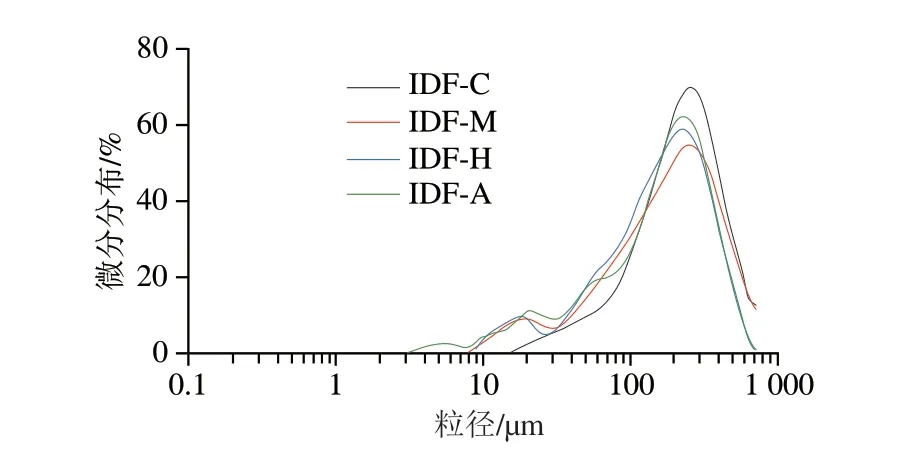
图2 人参IDF的粒径分布Fig.2 Particle size distribution of ginseng IDF
2.3 FTIR分析
如图3所示,发酵前后人参IDF均具有膳食纤维的典型特征,具有基本一致的吸收峰,在吸收强度上有所变化[33]。3 413 cm-1对应纤维素和半纤维素羟基伸缩振动峰,2 800~3 000 cm-1间对应纤维素—CH和—CH2基团的振动峰,发酵后人参IDF在这两处的峰强度变弱,说明发酵产生的活性物质对样品中的纤维素和半纤维素产生了一定的降解作用,破坏了其组内氢键,促进了羟基基团的暴露[6]。位于1 620 cm-1附近的特征峰与糖醛酸和多酚中的羧基有关[34],发酵后的人参IDF在此处峰强度有一定程度的增强。1 345 cm-1处对应纤维素与半纤维素的O—H或C—O基团振动的特征峰,峰强度无明显变化。1 050 cm-1处的吸收峰则源于木质素或半纤维素的C—O—O伸缩振动,发酵后人参IDF在此处的峰强度明显减弱,说明发酵产生的活性物质对样品中的木质素也有一定的降解作用。综上,食用菌发酵并没有破坏纤维的基本化学结构。但峰值强度的差异表明发酵处理能够有效地去除人参IDF结构中的非晶态成分。
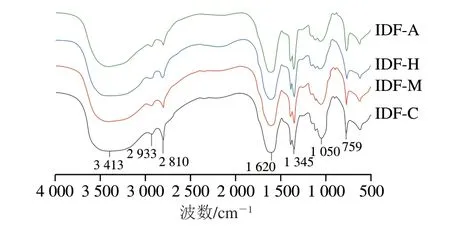
图3 人参IDF的FTIR图Fig.3 FTIR spectra of ginseng IDF
2.4 X射线衍射分析
如图4所示,发酵前后样品在2θ为21.72°时出现较强的吸收峰,在2θ为14.81°时出现微弱吸收峰,具有典型的纤维素I型结构特征[35],说明发酵并未使人参IDF晶体构型发生变化,只是在峰强度上有所差异。Origin软件计算结果显示,未发酵样品结晶度为13.78%,经羊肚菌、猴头菌和蜜环菌发酵后的样品结晶度分别为15.37%、18.57%和19.36%。结晶度的增加说明3 种食用菌发酵产生的活性物质对人参IDF的非结晶物质产生了一定的降解作用,促进了结晶区的暴露,从而导致人参IDF持水力、持油力、水膨胀力等理化特性的变化[36]。
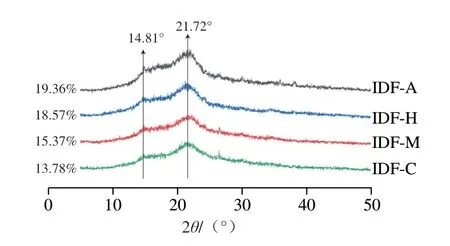
图4 人参IDF X射线衍射图像Fig.4 XRD patterns of ginseng IDF
2.5 DSC分析
如图5所示,所有样品均出现两个吸热峰,IDF-C、IDF-M、IDF-H和IDF-A第1个吸热峰分别出现在110.82、137.84、139.80 ℃以及145.84 ℃,推断是在此温度下样品中的水分出现吸热蒸发现象。IDF-C、IDF-M、IDF-H和IDF-A第2个吸热峰分别出现在203.02、248.41、250.15 ℃以及257.56 ℃,可能是样品中的一些可溶性物质以及半纤维素多糖受热分解,也可以看作纤维素的预碳化过程[37]。与未发酵相比,经3 种食用菌发酵后的人参IDF两个吸热峰均呈现明显右移的趋势,说明发酵后的人参IDF具有更高的热稳定性[38],这可能是由于在发酵过程中去除了部分纤维素和木质素,使IDF具有更高的结晶度导致。
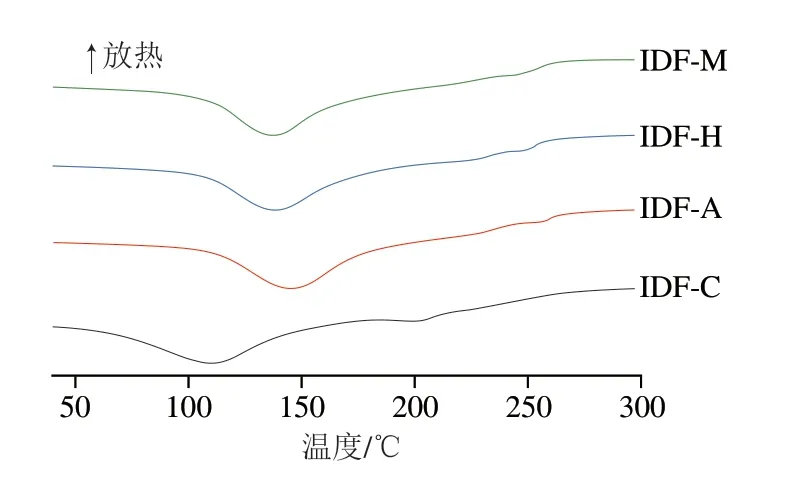
图5 人参IDF DSC热分析图Fig.5 DSC thermograms of ginseng IDF
2.6 水合特性
如表1所示,经3 种食用菌发酵,人参IDF的持水力、持油力和水膨胀力都显著提高,这是由于发酵使其结构发生变化,表面出现大量孔洞,比表面积增大,亲水、亲油的功能基团得以暴露,从而增加了样品对水分子、油分子的渗透和吸收能力[39-41],SEM、粒径分析结果也印证了这一结果。对比3 个菌种,蜜环菌发酵后的人参IDF对比未发酵提高程度最大,持水力、持油力和水膨胀力分别提高了74.2%、93.6%和124.38%。综上,食用菌发酵能够赋予人参IDF更好的水合性能,有助于其发挥出更好的功能特性。

表1 人参IDF的水合特性Table 1 Hydration properties of ginseng IDF
2.7 葡萄糖吸附能力
如图6所示,对比未发酵处理,经3 种食用菌发酵处理后的人参IDF葡萄糖吸附能力显著提高,其中经蜜环菌发酵样品的葡萄糖吸附能力显著强于其他两个菌种,且随着葡萄糖浓度的梯度上升,样品的吸附能力在大幅提高,最高达到83.56 mg/g。这可能是由于粒度减小使内部的功能基团暴露出来,从而增加了与葡萄糖的接触面积,且发酵后样品疏松多孔的结构也有利于促进葡萄糖的吸附作用,这与Meng Xuemei[35]、Jiang Guihun[33]等的研究结果一致。膳食纤维具有体外降血糖的功能主要源于其有效吸附葡萄糖的能力,能够在葡萄糖扩散和吸收过程中产生阻碍作用,从而降低肠道中葡萄糖浓度,减少肠壁吸收,维持餐后血糖水平[42],发酵后人参IDF所表现的有效吸附葡萄糖的能力为功能性食品的开发提供了思路。
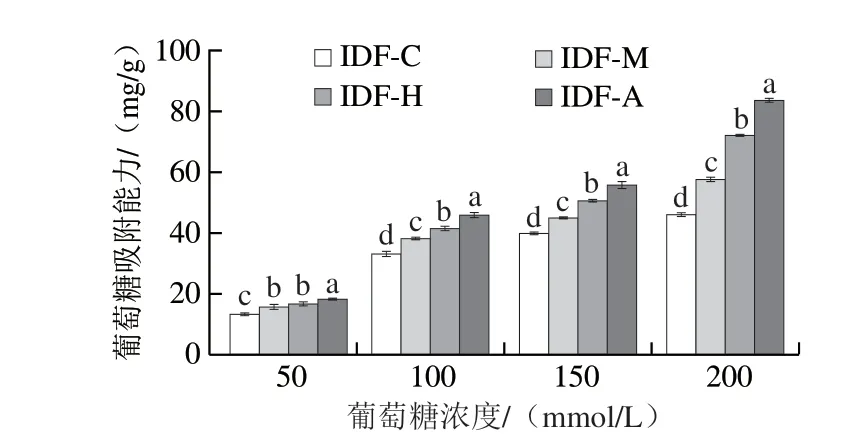
图6 人参IDF的葡萄糖吸附能力Fig.6 Glucose adsorption capacity of ginseng IDF
2.8 葡萄糖透析延缓能力
如图7所示,经3 种食用菌发酵的人参IDF的葡萄糖透析延缓能力明显高于未发酵样品,其中经蜜环菌发酵样品的葡萄糖透析延缓能力较未发酵样品提升最大为68.27%。在15~45 min内,所有样品的葡萄糖透析延缓能力随透析时间的延长而不断增大,到45 min达到最大值后迅速降低。2.7节结果表明人参IDF可以有效吸附葡萄糖,把葡萄糖阻截在纤维网络结构内,发酵后的人参IDF表面变得疏松,出现大量蜂窝状孔洞,增强了对葡萄糖的吸附作用,从而阻截了更多的葡萄糖分子。样品对葡萄糖的阻截能够降低小肠内葡萄糖的有效浓度,从而降低餐后血糖水平[43],但这种吸附和阻截作用有时间限制,很快会达到饱和,45 min之后扩散速度加快,这是由于IDF吸水膨胀达到饱和,黏度降低,从而降低了对葡萄糖的束缚力[44]。

图7 人参IDF的葡萄糖透析延缓能力Fig.7 GDRI of ginseng IDF
2.9 胆固醇吸附能力
如图8所示,与对未发酵人参IDF相比,经3 种食用菌发酵后人参IDF具有更好的胆固醇吸附能力,其中经蜜环菌发酵的人参IDF在pH 2和pH 7下的胆固醇吸附能力分别为8.44 mg/g和12.35 mg/g,是未发酵的1.28 倍和1.14 倍,这可能是发酵使人参IDF表面结构变得疏松,孔隙增加,粒径减小,从而增强了对胆固醇吸附作用。此外,体系的酸碱性也会影响人参IDF对胆固醇的吸附能力,在中性条件下的吸附能力大于在酸性环境中的吸附能力,这表明肠道环境更有利于膳食纤维对胆固醇的吸附,这是由于在酸性条件下体系中存在大量氢离子。随着pH值的升高,膳食纤维分子中的羧基解离并转化为与胆固醇分子具有较强结合能力的羧基阴离子,从而增强了膳食纤维对胆固醇的吸附能力,这与Wang Yanqiu[45]、Si Jiangyu[46]等的研究结果一致。2.10 胆酸钠吸附能力
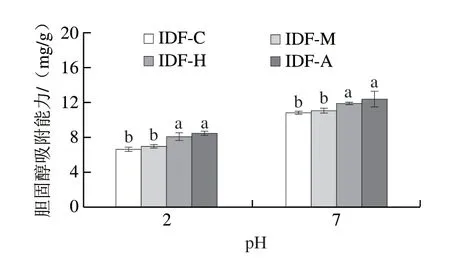
图8 人参IDF的胆固醇吸附能力Fig.8 Cholesterol adsorption capacity of ginseng IDF
如图9所示,与对未发酵人参IDF相比,发酵后人参IDF的胆酸钠吸附能力均有不同程度的提升,随着吸附时间的延长呈现先升高后降低的趋势,在45~60 min达到最大值为12.7 mg/g,这与田海龙[47]研究结果一致。研究表明,膳食纤维对胆酸盐的吸附能力主要是由于IDF的吸附和裹挟能力。食用菌发酵过程中会产生纤维素酶等物质,对IDF有一定的降解作用,结构测定显示发酵后的人参IDF表面出现大量孔洞,能够有效束缚和裹挟胆酸盐分子,从而提高样品对胆酸钠的结合能力。
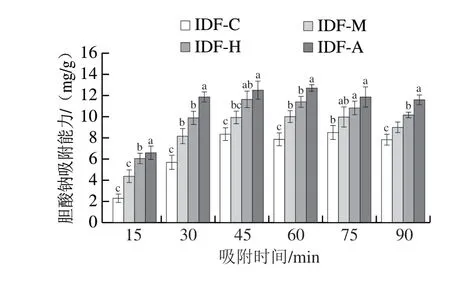
图9 人参IDF的胆酸钠吸附能力Fig.9 Sodium cholate adsorption capacity of ginseng IDF
2.11 亚硝酸盐吸附能力
如图10所示,与未发酵人参IDF相比,经3 种食用菌发酵后的人参IDF对亚硝酸盐的吸附能力都显著增强,且随着吸附时间的延长,吸附量在不断增加。经蜜环菌发酵所得样品具有最好的吸附效果,吸附时间150 min在pH 2下和pH 7下的吸附量达1 642.37 μg/g和1 249.13 μg/g。IDF对亚硝酸盐的吸附主要通过其蓬松的结构进行物理吸附以及分子的活性基团,特别是酚酸基团进行化学吸附[40]。SEM结果显示发酵使人参IDF表面结构变得疏松,FTIR结果显示发酵后的样品酚酸基团增多,二者共同促进了人参IDF对亚硝酸盐的物理和化学吸附。此外,pH 2时IDF吸附效果好于pH 7,表明pH值对IDF吸附亚硝酸盐有较大影响,这可能是由于pH值的升高使IDF中的羧基解离,表面负电荷增多,产生排斥作用,从而阻碍了样品对N吸附,这也说明人参IDF在胃中比在肠中能吸收更多的N[48]。
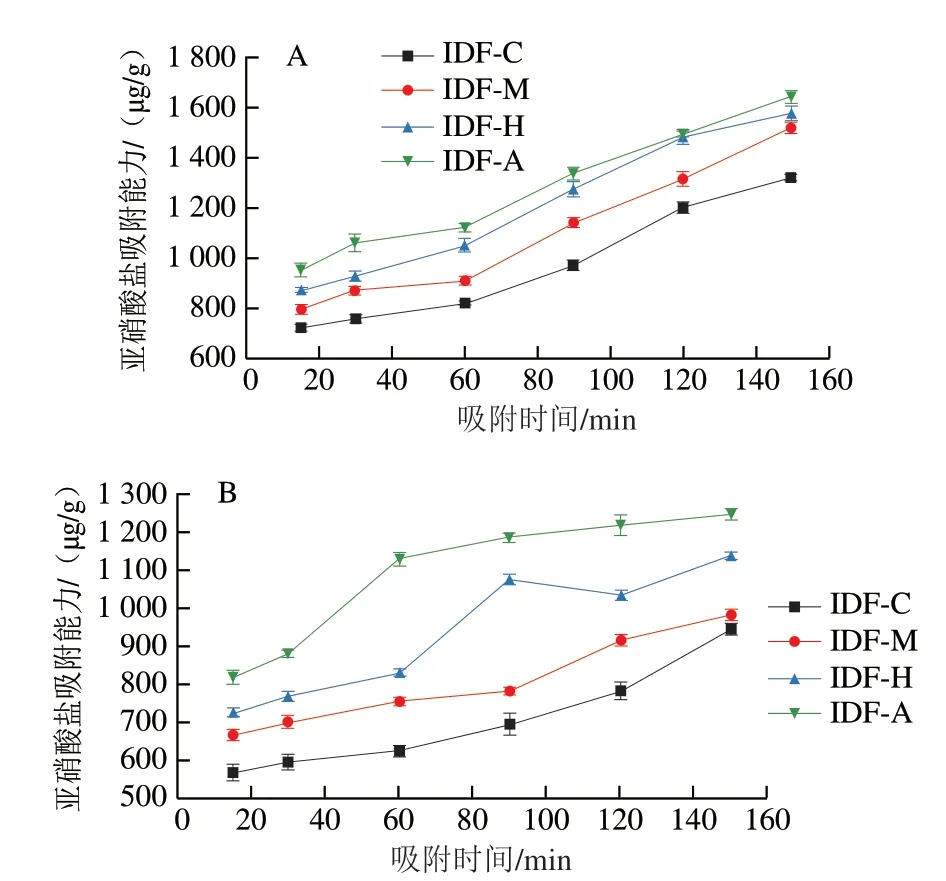
图10 人参IDF的亚硝酸盐吸附能力Fig.10 Nitrite adsorption capacity of ginseng IDF
2.12 阳离子交换能力
如图11所示,随着NaOH溶液的添加,几个样品所在的溶液体系的pH值持续升高,其中未发酵IDF-C溶液的pH值从3.12升高至9.45,经3 种食用菌发酵后的IDF-M(2.91~9.30)、IDF-H(2.69~9.16)和IDF-A(2.63~9.12)所在溶液体系pH值升高幅度以及起始、终止pH值都明显低于IDF-C,其中经蜜环菌发酵IDF保持较低pH值的时间最长。研究表明IDF的结构中含有大量特殊官能团,如羟基、羧基等,因此被赋予弱酸性阳离子交换能力[49]。结合对结构的分析,发酵处理能够破坏人参IDF结构,使其变得疏松,暴露出更多的羧基和羟基等功能性基团,FTIR结果对官能团的分析也印证了这一点,发酵后的样品拥有更多的糖醛酸基团,包含大量羟基和羧基,从而更加有利于样品发挥其阳离子交换性能,这与Ren Feiyue[50]、Wang Chaofan[31]等研究结果一致。
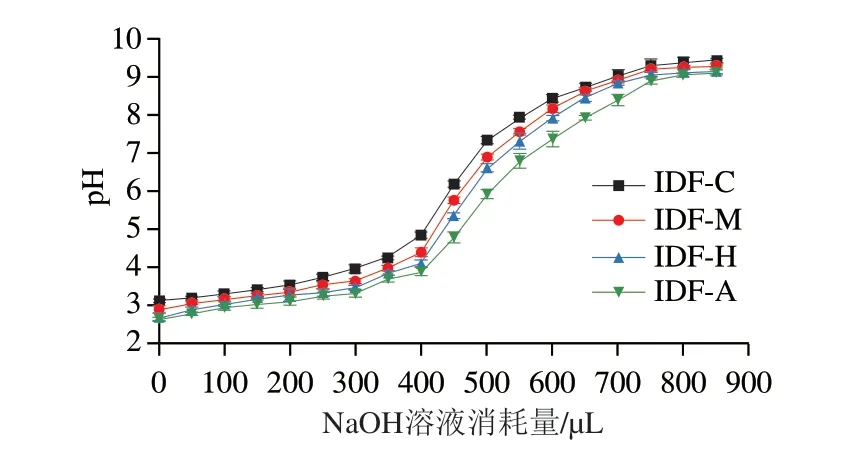
图11 人参IDF阳离子交换能力Fig.11 Cation exchange capacity of ginseng IDF
3 结论
采用羊肚菌、猴头菌、蜜环菌发酵人参渣制备人参IDF,并对人参IDF进行结构的表征和功能特性的测定。结果表明,3 种食用真菌发酵都能够对人参IDF产生一定的降解作用,使其粒径减小,表面结构变得疏松多孔,暴露出更多的活性基团,结晶度提高,拥有更高的热稳定性。结构的变化进而影响了人参IDF的功能特性,对比3 个菌种,经蜜环菌发酵得到的人参IDF具有最好的功能特性,其持水力、持油力、水膨胀力、葡萄糖吸附能力、葡萄糖透析延缓能力、胆固醇吸附能力、胆酸钠吸附能力、亚硝酸盐吸附能力较未发酵样品分别提高了74.2%、93.6%、124.38%、82.17%、20.24%、14.04%、49.41%、24.49%,阳离子交换能力较未发酵也有显著提高。综上,大型食用真菌发酵可作为制备高活性人参IDF的方法之一,为人参渣中大量IDF的高品质利用提供思路。

