基于响应面法优化四氢嘧啶羟化酶体外催化合成5-羟基四氢嘧啶条件※
王诗瑞,缪增强,邢江娃,沈国平,朱德锐,李永臻
(青海大学医学院基础医学研究中心,西宁 810016)
相容性溶质是耐盐或嗜盐菌为抵抗高盐等外界极端条件而在体内合成的有机小分子。四氢嘧啶类相容性溶质具有耐高温、抗干燥等特性,其中四氢嘧啶羟化酶(ectoine hydroxylase,EctD)是5-羟基四氢嘧啶(5-Hydroxyectoine,5-HE)在体内合成的关键酶[1],是非含血红素依赖的Fe2+与α-酮戊二酸(α-ketoglutarate)辅助的双加氧超家族酶。本研究基于影响EctD催化合成5-HE的温度、酸碱度、底物浓度和酶浓度等单因素实验,利用响应面法探索用EctD于体外催化合成5-HE的最优条件。
1 材料与方法
1.1 材料与仪器
EctD为课题组自制品。α-ketoglutarate购自上海麦克林生化科技有限公司,FeSO4、KCl、SDS、Tris和EDTA均购自天津市大茂化学试剂厂,四氢嘧啶(Ectoine,Ect)标准品、5-羟基四氢嘧啶(5-Hydroxyectoine,5-HE)标准品购自西格玛奥德里奇(上海)贸易有限公司。
酶标仪(Bio-Rad,XmarkTM)购自美国BioRad公司,恒温水浴锅(EYELA OSB-2200)购自日本东京理化公司,酸碱度计(PHS-25-3C-2F)购自上海雷磁公司,高效液相色谱仪(HPLC,Agilent 1260II)购自美国安捷伦公司。
1.2 实验方法
1.2.1 5-HE标准曲线的建立

1.2.2 EctD反应体系的建立
参照文献[4]建立EctD反应体系。配制10 mM TES缓冲液和0.5 mM Ect、1 mM Fe2+、10 mM α-ketoglutarate溶液,依次向反应管中加入各溶液30 μL及酶液50 μL,得到最终酶反应体系的总量为200 μL。反应25 min后,利用HPLC检测,并根据2.1.1所示标准曲线相关方程计算5-HE合成量。
1.2.3 pH对EctD催化反应的影响
将反应溶液的pH分别调至5、6、7、8、9,在室温下根据1.2.2所示反应条件进行催化反应实验,研究酸碱性对酶催化反应的影响。
1.2.4 温度对EctD催化反应的影响
在最适酸碱度下,将酶反应混合液分别置于25、30、35、40、45℃下,根据1.2.2所示反应条件进行催化反应实验,研究温度对酶催化反应的影响。
1.2.5 底物浓度对EctD催化反应的影响
在最适酸碱度和温度下,在酶反应混合液中分别加入不同浓度(0.25、0.50、1.00、1.25、1.50 mM)Ect,根据1.2.2所示反应条件进行催化反应实验,研究Ect浓度对酶催化反应的影响。
1.2.6 响应面Box-Benhnken实验设计
以单因素实验结果为基础,选择X1(温度)、X2(酸碱度)、X3(Ect浓度)、X4(EctD浓度)为影响因素,以5-HE产量为响应值,设计4因素3水平响应面Box-Benhnken实验29组,每组实验重复3次,其数据以平均值±标准差表示,用Design-Expert 12.0软件对实验数据进行统计分析,并得到相关回归方程。EctD反应体系响应面实验因素水平表见表1,响应面实验设计方案与结果见表2。

表1 EctD酶反应体系响应面实验因素水平表

表2 响应面实验设计方案与结果
1.3 统计学方法
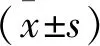
2 结果
2.1 酶促反应单因素实验
2.1.1 5-HE标准曲线的绘制
按1.2.1所示方法得到5-HE浓度与峰面积的对应关系。不同浓度5-HE的HPLC峰面积见表3。以峰面积为纵坐标、5-HE标准液浓度为横坐标绘制标准曲线。5-HE标准曲线图见图1。拟合得到回归方程y=3874.9x+63.754,R2=0.9999,说明回归方程可靠,可用以EctD反应产物5-HE的定量分析。
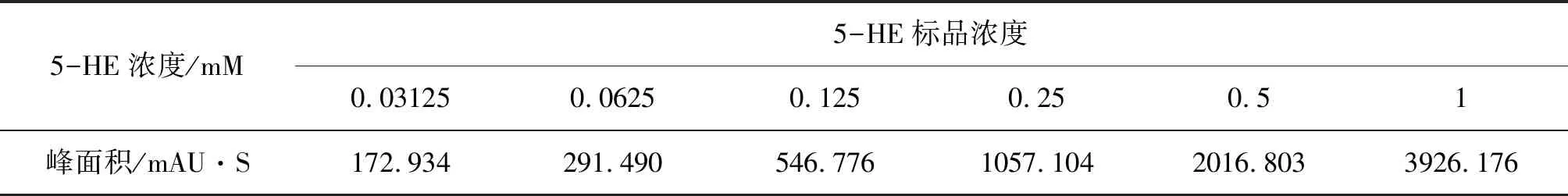
表3 不同浓度5-HE的HPLC峰面积
2.1.2 pH对EctD催化反应的影响
pH对EctD催化反应的影响见表4、图2。5-HE的产量随着pH的增大呈现先增高后降低的趋势,且pH在5~6及6和9之间时无差异,其余各指标间的5-HE产量均有差异(P<0.05)。在pH为7时5-HE的产量达到最高值,说明EctD催化反应的最适pH为7。
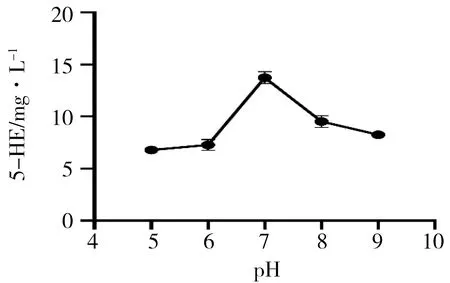
图2 pH对EctD催化反应影响图
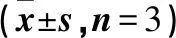
表4 不同pH下EctD酶催化合成5-HE的产量
2.1.3 温度对EctD催化反应的影响
温度对EctD催化反应的影响见表5、图3。5-HE的产量随着温度的增加呈现先增高后降低的趋势,且温度在35℃~40℃之间时无差异,其余各指标间5-HE产量均有差异(P<0.05)。在温度为35℃~40℃之间时,5-HE的量达到最高值,但在40℃~45℃之间时,5-HE的产量快速降低。
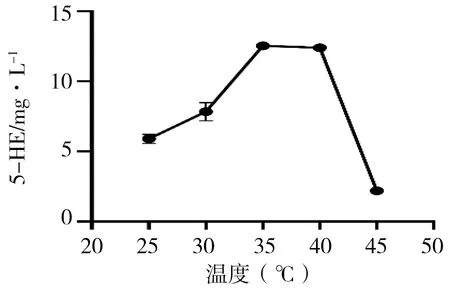
图3 温度对EctD催化反应影响图
表5 不同温度下EctD催化合成5-HE的产量
2.1.4 Ect浓度对EctD催化反应的影响
Ect浓度对EctD催化反应的影响见表6、图4。5-HE的产量随着Ect浓度的增加呈现先增高后逐渐稳定的趋势,且浓度在1.25~1.5 mM之间时无差异,其余各指标间5-HE产量均有差异(P<0.05)。当Ect浓度在1.25~1.5 mM之间时,随着Ect浓度的增加5-HE的产量几乎不再增加,说明此时底物Ect与酶催化活性中心的结合达到饱和,酶促反应效果达到最佳。
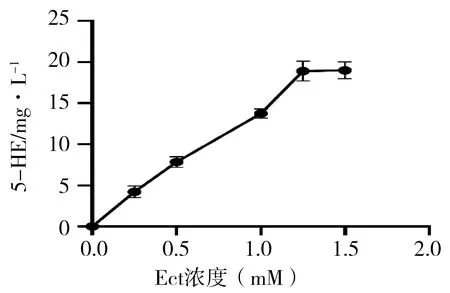
图4 Ect浓度对EctD催化反应影响图
表6 不同Ect浓度下EctD催化合成5-HE的产量
2.2 响应面回归模型的建立及分析
响应面实验设计与结果见表2,利用Design-Expert12.0软件对实验数据进行分析,经方差分析结果可知,X1(温度)、X2(酸碱度)、X3(底物Ect浓度)、X4(EctD浓度)的单独作用及X1(温度)与X4(EctD浓度)的交互作用对EctD催化合成5-HE产量的影响具有统计学意义(P<0.05),而X1(温度)与X2(酸碱度)、X1(温度)与X3(底物Ect浓度)、X2(酸碱度)与X3(底物Ect浓度)、X2(酸碱度)与X4(EctD浓度)及X3(底物Ect浓度)与X4(EctD浓度)的交互作用对EctD催化合成5-HE产量的影响无统计学意义(P>0.05)。二次多项式模型的回归方程:
Y=19.63-2.74X1-0.6845X2+2.46X3+4.35X4-4.13X1X4-7.06X12-10.87X22-4.20X32-5.16X42
由方差分析得出,所选模型的F为9.41,P<0.0001,表明模型具有显著性,各因素对其响应值的影响具有统计学意义[2]。失拟项P为0.0634,不具有显著性,因此该回归方程可用于预测EctD催化合成5-HE产量的结果。影响EctD催化合成5-HE产量的最显著因素是X4(EctD浓度),其次是X3(底物Ect浓度)和X1(温度),而X2(酸碱度)的影响不大。X1(温度)与X4(EctD浓度)的交互作用对EctD催化合成5-HE的产量具有显著影响(P<0.05),其他交互项对EctD催化合成5-HE的产量影响相对较小。
2.3 响应面优化
三维响应面图和等高线图可分析各因素之间对EctD催化合成5-HE产量的影响,每个响应面图都代表着其中任意一个因素保持零水平时,其余两个独立因素之间的相互作用对响应值影响的变化趋势。响应曲面坡度平缓,表明响应值可以耐受处理因素的变异,不影响响应值的大小;响应面坡度陡峭,表明响应值对处理因素敏感[3]。响应面三维立体图曲面的最高点表示各因素相互作用后的最佳反应结果。根据回归方程可做三维响应面图和等高线图,见图5,A1A2、B1B2、C1C2分别是温度与酸碱度、Ect浓度与EctD浓度、温度与EctD浓度相互作用对EctD催化合成5-HE产量影响的三维立体图和等高线图。其中温度与EctD浓度交互作用的等高线图见图5C2(接近椭圆形),表明两者交互作用显著,其余交互作用不显著,与方差分析结果一致。由图5C1和A1可知当酶浓度介于(0.4~1) U/mL、温度介于30℃~45℃、酸碱度介于5~9之间时,EctD催化合成5-HE的产量可达到最大值。

图5 响应面分析图
由Box-Benhnken优化实验得到了EctD体外催化反应的最优条件:温度为35℃、pH为7、底物Ect浓度为1 mM、EctD浓度为0.6 U/mL。此条件下EctD催化合成5-HE产量的预测值为19.83/mg·L-1,实验测得EctD催化合成5-HE的产量为(20.69±1.63) mg·L-1,与预测值接近(相对误差=4.2%)。说明所得最优条件可用于5-HE体外酶法合成。
3 讨论
5-HE不仅具有抵抗高渗透压、高温、冷冻及干燥等作用[4],而且具有对生物大分子的保护功能[5],在生物医药和化妆品领域具有良好的应用前景[6]。但现有5-HE生产工艺产量偏低,限制了其在各领域的研究和应用。ectD是嗜盐菌应对极端环境时合成相容性溶质5-HE的关键基因,广泛存在于Firmicutes、Proteobacteria、Actinobacteria等嗜盐微生物中。目前提高5-HE产量的合成策略有工程菌的构建和体外酶催化合成,但在工程菌胞内合成5-HE的调控机制复杂,且后期5-HE与其前体物Ect分离纯化困难。因此,本研究主要从EctD体外催化合成5-HE的方向研究酸碱度、温度、底物浓度、酶浓度对EctD催化合成5-HE产量的影响。
源自Sphongopyxisalaskensis[7]、Paenibacilluslautus[8]、Alkalilimnicolaehrlichi[9]、Acidiphiliumcryptum[10]、Halomonaselongata[11]和Paenibacillusstutzeri[12]等菌株的EctD催化机制研究显示,与Fe2+结合的His146、Asp148、His248,与α-ketoglutarate结合的Arg259、Ser250、Phe143、Arg131、Asn133、Phe95,及与Ect结合的Gln129、Trp152、Ser165、Phe242、Phe263等氨基酸残基是保持EctD活性的必须结构[13]。EctD催化合成5-HE的机理是,先由共底物α-ketoglutarate脱去羧基形成琥珀酸并释放一分子二氧化碳,与此同时,氧分子中的一个氧原子被纳入琥珀酸盐,而另一个氧原子取代四氢嘧啶芳香环上的5-位氢原子形成羟基,得到产物5-HE[14]。
响应面优化法是一种实验条件寻优方法,通过连续对实验过程中各个因素水平进行分析,构建预测模型,找出实验的最优条件。本实验利用此方法来优化EctD催化反应条件,通过实验数据的方差分析结果发现,模型的F为9.41,P小于0.0001,失拟项P为0.0634时,模型具有显著性而失拟项不具有显著性,说明该回归方程可信。X1(温度)、X3(底物Ect浓度)、X4(EctD浓度)的单独作用及 X1(温度)与X4(EctD浓度)的交互作用对EctD催化合成5-HE的产量影响显著,回归方程一次项系数的绝对值的大小依次为X4(EctD浓度)>X3(底物Ect浓度)>X1(温度)>X2(酸碱度),说明X4(EctD浓度)对EctD催化反应的影响最大。
综上所述,本实验主要筛选了对酶催化反应影响较大的温度、酸碱度和Ect、EctD浓度四个因素,利用Box-Benhnken法设计实验对EctD体外催化合成5-HE的体系进行优化,获得了EctD体外催化反应的最优条件,为5-HE的相关研究及工业利用奠定了实验基础。

