用聚乙二醇沉淀法提取脐带间充质干细胞源外泌体抑制PASMCs增殖※
张雨薇,牛菊红,刘川川,毛稼琦,张晴晴,刘 红,陈 英#,马 兰*
(1.青海大学医学部公共卫生系,西宁 810001;2.青海大学高原医学研究中心,西宁 810001;3.青海大学附属医院包虫病实验室,西宁 810001)
肺血管重构是低氧性肺动脉高压(hypoxic pulmonary artery hypertension,HPAH)形成的关键环节之一,而导致肺血管重构的重要原因之一是肺动脉平滑肌细胞(Pulmonary artery smoothmuscle cells,PASMCs)的增殖。本研究拟探讨如何以合适的聚乙二醇(polyethylene glycol 6000,PEG 6000)浓度提取人脐带间充质干细胞源外泌体(human umbilical cord mesenchymal stem cells exosome,hUCMSCs-exo),且观察其对低氧诱导的PASMCs增殖的影响,探讨低氧环境下外泌体(exosome,exo)的治疗潜力。
1 材料与方法
1.1 材料
PEG 6000粉剂(北京索莱宝公司,P8250),DMEM 高糖培养基(武汉Procell公司,PM150210),DMEM/F12培养基(武汉Procell公司,PM150312),100×青霉素-链霉素混合液(上海生工公司,penicillin-streptomycin mixed solution,PS,E607011-0100),胰蛋白酶溶液(武汉Procell公司,PB180224),胎牛血清(美国Gibco公司,fetal bovine serum,FBS,12483020),EdU试剂盒(上海碧云天公司,C0071S),BCA蛋白定量试剂盒(美国ThermoFisher公司,23225),内参β-actin抗体(武汉Abclonal公司,AC026),核增殖抗原蛋白PCNA抗体(武汉Abclonal公司,A0264),外泌体纯化柱(上海Umibio公司,UR52121)。CO2细胞培养箱(美国ThermoFisher公司,Thermo HERAcell 150i),三气培养箱(德国BINDER公司,BINDER CB53),蛋白电泳仪(美国Biorad公司,1645050),生物显微镜(德国蔡司Zeiss公司,Ax10 Axio),激光共聚焦显微镜(德国蔡司Zeiss公司,LSM880),荧光显微成像设备(日本Olympus Corporation公司,Olympus IX71),超灵敏多功能成像仪(美国Cytiva公司,Amersham Imager 600)。
1.2 方法
1.2.1 新生儿脐带收集方法
从青海大学附属医院产科收集长期生活于青海西宁地区(海拔2 261米)的24~27岁汉族健康孕产妇新生儿脐带组织5份,采集5~10 cm脐带,用预冷的无菌生理盐水冲洗后,置于预冷(4℃)含双抗和1%血清白蛋白的转移缓冲液里。
1.2.2 hUCMSCs的原代分离培养与免疫表型鉴定方法及诱导分化能力鉴定方法
1.2.2.1 hUCMSCs的原代分离培养方法
用无菌PBS冲洗脐带组织3遍,将剥离脐动脉和脐静脉的组织块用组织贴壁法均匀地贴在培养皿底部。用hUCMSCs专用完全培养基(DMEM/F12)培养,48 h后弃未贴壁的组织块,以后每3 d换液1次,3 w左右可长出原代间充质干细胞。
1.2.2.2 hUCMSCs的免疫表型鉴定方法
取生长良好的第3代hUCMSCs细胞,用胰蛋白酶消化后离心(800 r·min-1,5 min)。用PBS洗涤后,向细胞中分别加入PE-CD29、PE-CD90、PE-CD105、APC-CD44、APC-CD34、APC-CD45抗体避光孵育(4℃,30 min)。孵育结束用PBS洗涤两次去除未结合抗体,并将细胞悬浮在200 μL PBS中。用流式细胞仪检测hUCMSCs细胞表面抗原标志的表达量。
1.2.2.3 脐带间充质干细胞诱导分化能力鉴定方法
成骨诱导分化:将6孔培养板提前用明胶包被,取第3代生长良好的hUCMSCs细胞,用胰蛋白酶消化后接种于6孔(5×104个/孔)培养板中,24 h后更换为成骨诱导分化液(含10%FBS完全培养基和0.1 μM地塞米松、10 mM β-磷酸甘油及50 μg·mL-1抗坏血酸磷酸盐)于恒温培养箱(37°C,5% CO2)培养,每3 d更换培养基1次。成骨诱导21 d后,使用4%多聚甲醛固定(室温,30 min)。用PBS洗涤3次后,用茜素红染液染色(室温,30 min)。用PBS洗涤后,于显微镜下观察成骨情况并拍照。
成脂诱导分化:将6孔培养板提前用明胶包被,取第3代生长良好的hUCMSCs细胞,用胰蛋白酶消化后接种于6孔(5×104个/孔)培养板中,24 h后更换为成脂细胞诱导分化液(含10%FBS完全培养基和2 mM左旋谷氨酰胺、1 μM地塞米松、0.5 mM异丁基甲基黄嘌呤、0.5 mM吲哚美辛、10 μM胰岛素)于恒温培养箱(37℃,5% CO2)培养,每3 d更换培养基1次。共诱导21 d。使用4%多聚甲醛固定(室温,30 min),用油红O染色液染色(30 min)。用PBS洗涤后,于显微镜下观察成脂情况并拍照。
1.2.3 配制PEG溶液并提取hUCMSCs-exo的方法
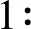
1.2.4 hUCMSCs-exo鉴定方法
透射电镜鉴定hUCMSCs-exo形态:取20 μL重悬后的hUCMSCs-exo滴加于载样铜网上,用2.5%戊二醛固定(1 min),静置(室温,5 min)后用滤纸从侧面吸干液体,滴加4%醋酸双氧铀溶液(约20 μL)于铜网上敷染(室温,5 min)。用滤纸吸干敷染液并烤干(白炽灯)后,于透射电子显微镜下观察hUCMSCs-exo形态并拍照。
hUCMSCs-exo表面marker检测:通过Western Blot法标记相应蛋白,用电泳分离蛋白,并用5%的脱脂奶粉封闭(1 h),按照抗体说明书所示剂量加入稀释倍数不同的CD63/Alix/TSG101一抗过夜(4℃),再用1×TBST洗3次(5 min/次),加入稀释过的羊抗兔IgG二抗孵育(1 h)后用1×TBST洗3次(5 min/次)。用ECL发光试剂盒显影、化学发光成像仪显像。
1.2.5 BCA蛋白测定及hUCMSCs-exo提取方法
将hUCMSCs无血清培养上清液(共40 mL)混合均匀,分别取4份(10 mL/份)在hUCMSCs培养上清液中依次加入终浓度为10%、8%、6%、4%的PEG 6000溶液,按照BCA试剂盒说明书所示方法测定从不同浓度PEG 6000溶液中提取的hUCMSCs-exo浓度。
配置考马斯亮蓝染色液,测定从不同浓度PEG 6000溶液中提取的hUCMSCs-exo蛋白浓度。按照如下方法配制考马斯亮蓝染色液,R250配方(100 mL):考马斯亮蓝(R250) 0.25 g、甲醇45 mL、冰醋酸10 mL、ddH2O 45 mL;考马斯亮蓝脱色液配方(500 mL):甲醇125 mL、冰醋酸40 mL、ddH2O定容至500 mL。取用上述方法提取的hUCMSCs-exo 35 μg进行凝胶电泳。待电泳结束后,切取含有Marker蛋白以及少许样品的凝胶进行染色,取凝胶放入适量考马斯亮蓝染色液中,确保染色液充分覆盖凝胶,用微波炉加热(1 min)后取出置于侧摆摇床缓慢摇动染色(室温,1~2 h)。之后再用配置好的脱色液进行脱色,直至蓝色背景基本被洗脱,并且蛋白条带染色效果达到预期。
1.2.6 hUCMSCs-exo内化方法
将上述提取的hUCMSCs-exo用0.5 mL PBS重悬,以0.2 μm的滤头过滤除菌后,加入0.5 mL PKH26(4μM)混合孵育(室温,3 min)后用外泌体纯化柱离心去除多余染料。然后将课题组之前冻存的第2代大鼠PASMCs复苏并传至第3代后与hUCMSCs-exo共培养24 h,24 h后用DAPI染细胞核,5 min后弃染料,并用PBS洗涤3次,最后用激光共聚焦显微镜观察摄取情况。
1.2.7 PASMCs增殖和PASMCs增殖标志物蛋白表达检测方法
1.2.7.1 PASMCs增殖检测(EdU法)
大鼠PASMCs用0.125%的胰蛋白酶消化后将大鼠PASMCs分为3组,分别为常氧对照组(C-con),O2体积分数为21%;低氧对照组(H-con),O2体积分数为1%;外泌体组(exo),O2体积分数为1%,接种于3个24孔(1×104个/孔)细胞培养板。随后,每孔加入终浓度为10 μmol·l-1的EdU,分别放置三气培养箱和CO2培养箱中孵育2 h,后续按照EdU说明书所示方法操作。共做6个复孔,在荧光显微镜下选择6个复孔视野中央拍照,计算各组阳性细胞占总细胞数的比值,比较各组阳性细胞率。
1.2.7.2 PASMCs增殖标志物蛋白表达检测(Western Blot法)
将大鼠PASMCs分为3组,分别为C-con、H-con、exo。收集各组细胞,加入适量RIPA裂解液于冰上裂解15 min,离心(4℃,12 000 r·min-1,10 min)后取上清液。用BCA蛋白定量法检测样品总蛋白浓度,放入金属浴恒温(99℃)器煮10 min后取蛋白样品,按照20 μg/孔在10% SDS-PAGE凝胶上进行电泳,电泳结束后用180 mA恒流将凝胶上的蛋白及蛋白转至PVDF膜,用5%脱脂奶粉封闭(室温1 h),再用TBST(pH为7.5)漂洗膜3次(5 min/次),加入β-actin、PCNA一抗抗体孵育(4℃,过夜)。用TBST缓冲液洗膜3次(10 min/次),加入用HRP标记的羊抗兔IgG二抗孵育(室温,1 h)。用TBST缓冲液洗膜3次(10 min/次),用ECL超敏发光液在化学发光成像仪下检测特异性免疫反应蛋白条带后,用Image J软件分析条带灰度值,计算蛋白相对表达量。
1.2.7.3 PASMCs增殖检测(cck-8法)
使用cck-8试剂盒检测hUCMSCs-exo对PASMCs增殖的抑制率。将PASMCs用0.125%胰蛋白酶消化后,按照 5×103个/孔接种到96孔细胞培养板,放入培养箱(37℃、5% CO2)培养(过夜)。待细胞贴壁后,加入无血清DMEM培养基作饥饿处理(24 h)。然后分别加入0、10、20、40、80、160、320 μg·mL-1的含hUCMSCs-exo的培养基后置三气培养箱中培养(48 h)。随后,每孔加入10 μL cck-8试剂孵育(37℃,1 h),用酶标仪在450 nm处检测各组吸光度值,与空白对照组比较。
本研究经青海大学伦理委员会批准(2020-03)。
1.2.8 统计学方法
2 结果
2.1 hUCMSCs鉴定
2.1.1 hUCMSCs免疫表型鉴定(流式细胞术)
流式细胞术鉴定结果显示,hUCMSCs高表达CD29(98.5%)、CD44(98.93%)、CD90(95.52%)、CD105(98%),几乎不表达CD34(0.64%)、CD45(0.08%),如图1。

图1 流式细胞术鉴定图
2.1.2 hUCMSCs成脂成骨分化能力(诱导液诱导其分化能力)鉴定
为观察hUCMSCs的多向分化能力,加入诱导液观察hUCMSCs成脂成骨能力。茜素红染色和油红O染色结果显示,诱导21 d后经油红O染色的脂肪滴外观如图2A箭头所指;21 d后,经茜素红染色的钙结节外观如图2B箭头所指。
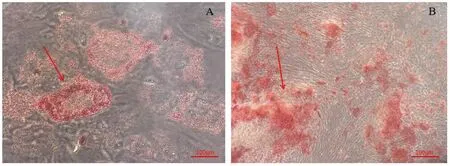
A:脂肪滴(×40) B:钙结节(×40)
2.2 hUCMSCs-exo的形态学观察(透射电镜观察)
hUCMSCs-exo形态见图3,图中杯口状小泡为hUCMSCs-exo颗粒,囊泡内含有致密的云状物质,为hUCMSCs-exo内含物。

×30 000 ×6 000
2.3 从不同浓度PEG 6000溶液中提取的hUCMSCs-exo含量比较
将40 mL hUCMSCs无血清培养上清液混合均匀,分别取10 mL hUCMSCs培养上清液依次加入终浓度为10%、8%、6%、4%的PEG 6000溶液做电泳,将凝胶做考马斯亮蓝染色,如图4,明显看出从浓度为8%、10%的PEG 6000提取的exo蛋白条带相较于6%、4%的exo蛋白条带更加清晰。
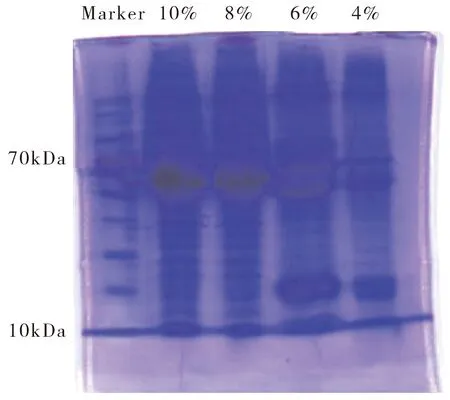
图4 电泳条带图
测定从不同浓度PEG 6000溶液中提取的hUCMSCs-exo浓度结果显示,当PEG 6000溶液浓度为10%时,所提取的hUCMSCs-exo浓度最高,为4.86 μg·mL-1,见表1。
表1 不同浓度PEG 6000溶液所含hUCMSCs-exo浓度
2.4 hUCMSCs-exo表面标记物鉴定
Western Blot检测结果显示,从PEG 6000溶液中提取的hUCMSCs-exo中的CD63、Alix、TSG101如图5所示。图5说明所提取的样品中存在hUCMSCs-exo。
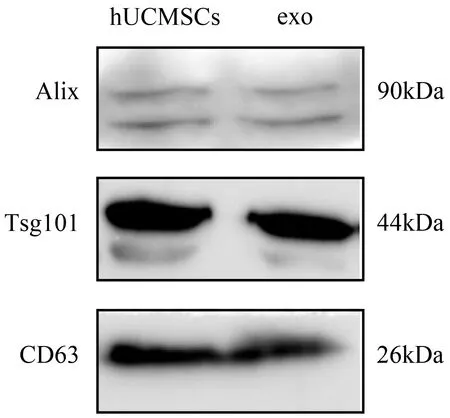
图5 Western Blot电泳条带图
2.5 hUCMSCs-exo内化
激光共聚焦显微镜下显示,由PKH26标记的hUCMSCs-exo被PASMCs摄取,hUCMSCs-exo聚集在PASMCs内,如图6所示。

图6 激光共聚焦显微图
2.6 hUCMSCs-exo抑制
EdU检测结果显示,与C-con组比,H-con组的PASMCs在48 h内增殖的数量明显增多,exo组可显著降低低氧诱导的细胞增殖(P<0.05),见表2、图7。Western Blot法结果显示,与C-con组比,H-con组细胞的PCNA表达升高;与H-con组比,经hUCMSCs-exo干预后的PCNA表达水平降低(P<0.05),见表3、图8。与对照组比,10、20、40μg·mL-1组的细胞吸光度值没有明显差异,而80、160、320μg·mL-1组的细胞吸光度值明显降低(P<0.05),见表4。

表2 各组细胞增殖情况
表3 各组细胞核增殖抗原(PCNA)蛋白表达情况
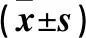
表4 hUCMSCs-exo对PASMCs活力的影响
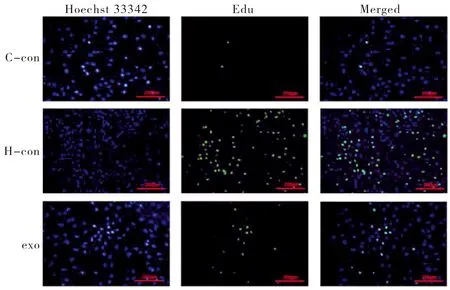
图7 各组细胞增殖图
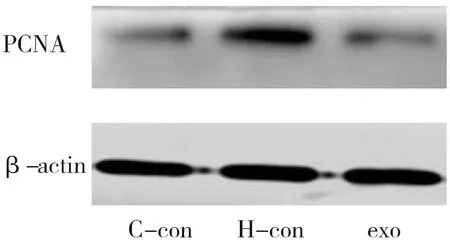
图8 各组细胞核增殖抗原(PCNA)蛋白表达图
3 讨论
缺氧环境可以导致PASMCs增生肥大、内皮细胞功能紊乱、成纤维细胞增殖和细胞外基质沉积,致肺血管重塑,使肺动脉血流动力学发生改变,进而引发HPAH。有研究表明,抑制PASMCs增殖可以抑制血管重构,从而缓解HPAH疾病的发展[1-2],因此,寻找能够抑制PASMCs增殖的方法成为学科研究重点。
hUCMSCs是典型的成体干细胞之一,与其他来源的干细胞相比,具有免疫原性低、易获取且易于体外扩增等优点[3]。移植后的干细胞可通过旁分泌起作用,其所分泌的hUCMSCs-exo对机体具有重要保护作用。hUCMSCs-exo是一种携带大量功能性蛋白质、脂质等生物物质和mRNA、miRNA、DNA等生物分子,可在细胞间转移的分子,可调节受体细胞的生命活动[4]。hUCMSCs-exo通过受体配体结合,以及与受体细胞胞膜直接结合或相互融合的方式,调节受体细胞,起到传递生物信息的作用[5-6]。
从hUCMSCs上清液中分离出高纯度且生物活性良好的exo是相关研究的首要环节。目前,提取exo的方法很多,包括超速离心法、凝胶排阻层析法、免疫亲和层析法、试剂盒提取法[7]。上述方法均存在不足:超速离心法耗时且对设备要求高;凝胶排阻层析法提取到的exo纯度较低;免疫亲和层析法提取到的exo量较低;试剂盒提取法价格昂贵。由于exo的大小和密度与病毒类似,分离病毒或病毒载体常用PEG 6000[8-9],且已有研究使用PEG沉淀法成功提取exo[10]。因此,本研究选用相关方法提取并纯化exo。
本研究通过相关实验设计观察了hUCMSCs-exo对低氧诱导的PASMCs的增殖抑制作用。EdU、cck-8、WB实验结果均显示,经hUCMSCs-exo处理后大鼠的PASMCs增殖被抑制。提示hUCMSCs-exo具有抑制低氧诱导大鼠PASMCs增殖的能力。有学者通过建立野百合碱诱导的肺动脉高压小鼠模型证明[11],胞外囊泡发挥治疗作用主要是通过exo实现的,静脉注射含exo的培养上清液可以阻止低氧诱导的PAH的血管重建,但是注射无exo的hUCMSCs培养上清液无此作用[12]。
综上所述,本研究用PEG 6000沉淀法提取到的hUCMSCs-exo可抑制低氧诱导的大鼠PASMCs增殖,此结论为后续的相关机制研究提供了思路、奠定了基础。

