松针多酚提取工艺优化及其抗氧化、酶活性抑制特征
张家旭 王信 叶倩女 董学凤 郭玉儿 彭腾腾 尹盼盼 李海燕 石晓峰



摘要: 為优化松针多酚的提取工艺,并考察其体外抗氧化作用以及对α-葡萄糖苷酶、α-淀粉酶、酪氨酸酶活性的抑制作用,本研究利用超声辅助提取法,在提取温度、提取时间、乙醇体积分数、液料比等要素对松针多酚提取单因素试验的基础上,利用响应面法优化松针多酚提取工艺;并利用优化工艺条件,测定了6种松科植物松针的多酚提取量。进一步利用不同多酚含量的松针提取液,分析松针多酚对1,1-二苯基-2-苦基肼自由基(DPPH)、2,2′-联氮-双-3-乙基苯并噻唑啉-6-磺酸自由基(ABTS+)、羟基自由基(·OH)的清除能力及其对α-葡萄糖苷酶、α-淀粉酶、酪氨酸酶活性的抑制能力。结果表明,松针多酚的最佳提取工艺为提取温度60 ℃、提取时间28 min、乙醇体积分数60%、料液比1 g∶25 ml;在此条件下,6种松科植物松针多酚提取量为19.97~53.41 mg/g。6种松科植物松针多酚对DPPH自由基清除的IC50值范围为22.76~159.90 μg/ml,对ABTS+自由基清除的IC50值范围为0.092~0.184 mg/ml,对·OH自由基清除的IC50值范围为2.176~8.134 mg/ml,对α-葡萄糖苷酶活性的抑制IC50值范围为6.421~18.120 μg/ml,对α-淀粉酶活性的抑制IC50值范围为0.399~10.570 mg/ml,对酪氨酸酶活性的抑制IC50值范围为0.121~3.725 mg/ml。总之,松针具有较高的多酚含量,明显的抗氧化活性,对α-葡萄糖苷酶、α-淀粉酶、酪氨酸酶活性有较强的抑制作用,在天然抗氧化剂、降糖药的研发中有广泛的应用前景。
关键词: 松针;多酚;提取工艺;抗氧化;酶活性抑制
中图分类号: TS201.4 文献标识码: A 文章编号: 1000-4440(2023)07-1593-13
Optimization of extraction process of polyphenols from pine needles and its antioxidant and enzyme activity inhibitory characteristics
ZHANG Jia-xu1,2, WANG Xin1,2, YE Qian-nü1,2, DONG Xue-feng1,2, GUO Yu-er2,3, PENG Teng-teng1,2, YIN Pan-pan1,2, LI Hai-yan1,2, SHI Xiao-feng1,2,3
(1.College of Pharmacy, Gansu University of Chinese Medicine, Lanzhou 730030, China;2.Gansu Provincial Academic Institute for Medical Research, Lanzhou 730050, China; 3. Lanzhou University of Technology, Lanzhou 730050, China)
Abstract: In order to optimize the extraction process of pine needle polyphenols, and to investigate its antioxidant effect in vitro and its inhibitory effect on the activities of α-glucosidase, α-amylase and tyrosinase, based on the single factor test of extraction temperature, extraction time, ethanol volume fraction and liquid-to-material ratio on the content of polyphenols in pine needle extract, the extraction process of pine needle polyphenols based on ultrasonic-assisted extraction was optimized by response surface method. The extraction of polyphenols from pine needles of six pine plants was determined by using the optimized process conditions. The scavenging ability of pine needle polyphenols on 1,1-diphenyl-2-picrylhydrazyl radical (DPPH), 2,2 ′-azino-bis-3-ethylbenzothiazoline-6-sulfonic acid radical (ABTS+) and hydroxyl radical (·OH) and their inhibitory ability on the activities of α-glucosidase, α-amylase and tyrosinase were further analyzed by using pine needle extracts with different polyphenol contents. The results showed that the optimum extraction conditions were as follows: extraction temperature 60 ℃, extraction time 28 min, ethanol volume fraction 60%, liquid-solid ratio 1∶25 (g∶ml). Under these conditions, the extraction amount of polyphenols from pine needles of six pine plants ranged from 19.97 mg/g to 53.41 mg/g. The IC50 values of DPPH free radical, ABTS+ free radical, ·OH free radical were 22.76-159.90 μg/ml, 0.092-0.184 mg/ml, 2.176-8.134 mg/ml, respectively, and the IC50 values of α-glucosidase, α-amylase and tyrosinase were 6.421-18.120 μg/ml, 0.399-10.570 mg/ml and 0.121-3.725 mg/ml, respectively. In summary, pine needles have high polyphenol content, obvious antioxidant activity, strong inhibitory effects on the activities of α-glucosidase, α-amylase and tyrosinase, and have broad application prospects in the development of natural antioxidants and hypoglycemic drugs.
Key words: pine needles;polyphenols;extraction process;antioxidant;enzyme activity inhibition
多酚是植物体内的次生代谢物,具有抗肿瘤、抗病毒、抗炎等多种药理作用[1-3]。目前植物多酚的提取方法主要有超声辅助提取法、微波辅助提取法、溶剂浸提法等,而超声辅助提取法具有方便快捷的优点,是目前应用最为广泛的植物多酚提取方法[4-5]。
松针是松科(Pinaceae)植物的针叶。松针富含的黄酮类、木脂素类、挥发油类化合物,具有祛风、止痛等药理作用[6-8];富含的维生素、矿物质元素、氨基酸等物质,具有较高的营养价值[9-10]。中国的松树资源非常丰富,目前松针的年产量约2.1×108 t[11]。但目前松针大多以饲料形式应用于畜牧生产,造成了大量的浪费。目前针对不同松科植物松针的活性成分含量差异及其清除DPPH自由基的能力[12]、松针提取物的体外抗氧化活性差异[13]有一些研究。但松针多酚的提取工艺及其降糖、抑制酪氨酸酶活性研究较少,因此本研究以雪松、白皮松、落叶松、油松、樟子松、华山松等6 种松科植物松针为研究对象,采用超声辅助法提取松针多酚,通过单因素试验分析了提取温度、提取时间、乙醇浓度、液料比对松针多酚含量的影响,然后采用响应面法优化松针多酚的提取工艺,并对松针多酚的抗氧化活性和对α-淀粉酶、α-葡萄糖苷酶、酪氨酸酶活性的抑制作用进行了讨论,以期为松针资源的综合利用及产品开发提供科学依据。
1 材料与方法
1.1 仪器与试剂
1.1.1 仪器 光吸收酶标仪(Spectra Max 190,美谷分子仪器上海有限公司产品);超声波清洗仪(SK 3100,上海科导超声仪器有限公司产品);电热恒温水浴锅(HH.S21-6,上海博迅实业有限公司医疗设备厂产品);高速多功能粉碎机(CXP-100,上海晟喜制药机械有限公司产品)
1.1.2 材料及溶液配制 雪松、白皮松、落叶松、油松、樟子松、华山松等6 种松科植物松针分别采自甘肃省兰州市与天水市,采集后漂洗干净,室内常温阴干后粉碎,过30目筛,置于干燥器中保存备用;没食子酸购自上海源叶生物科技有限公司;1,1-二苯基-2-苦基肼自由基(DPPH)购自Sigma公司;2,2′-联氮-双-3-乙基苯并噻唑啉-6-磺酸(ABTS+)购自上海麦克林生化科技有限公司;α-葡萄糖苷酶、对硝基苯基-α-D-吡喃葡萄糖苷(PNPG)购自北京迈瑞达科技有限公司,α-淀粉酶、酪氨酸酶、左旋多巴(L-DOPA)、曲酸、阿卡波糖、磷酸盐缓冲液干粉(PBS)购自北京索莱宝科技有限公司;无水乙醇、福林酚试剂购自上海展云化工有限公司;NaCO3·7H2O、水杨酸、30% H2O2、硫酸亚铁、过硫酸钾、抗坏血酸、可溶性淀粉、Na2SO3、NaOH、苯酚、C4H4Na2O6·4H2O,均为分析纯。
溶液配制方法如下:0.2 mmol/L的DPPH溶液:精密称取0.003 9 g DPPH,用无水乙醇定容至50 ml;7.4 mmol/L的ABTS+溶液:精密称取0.040 6 g ABTS+,用纯化水定容至10 ml;2.6 mmol/L的过硫酸钾溶液:精密称取0.007 0 g过硫酸钾,用纯化水定容至10 ml;9.0 mmol/L的FeSO4溶液:精密称取0.068 0 g FeSO4,用纯化水定容至50 ml;9.0 mmol/L的水杨酸溶液:精密称取0.062 0 g 水杨酸,用无水乙醇定容至50 ml;9.0 mmol/L的H2O2溶液:精密吸取46 μl 30%的H2O2溶液,用纯化水定容至50 ml;0.2 U/ml的α-葡萄糖苷酶溶液:精密称取0.200 mg 50 U/mg的α-葡萄糖苷酶,用纯化水定容至50 ml;10mmol/L的PNPG溶液:精密称取0.105 6 g PNPG,用純化水定容至50 ml;0.1 mol/L的PBS 缓冲液:用纯化水将1袋磷酸盐缓冲液干粉(0.02 mol PO3-4)溶解并定容至200 ml;8 U/ml的α-淀粉酶溶液:称取0.025 g 1 600 U/g的淀粉酶,用纯化水定容至50 ml;1%的可溶性淀粉溶液:称取1.00 g淀粉,用纯化水定容至100 ml;100 U/ml的酪氨酸酶溶液:精密称取4.032 2 mg 1 240 U/mg的酪氨酸酶,用纯化水定容至50 ml; 0.5mmol/L的L-DOPA溶液:精密称取0.004 9 g L-DOPA,用纯化水定容至50 ml;以上所有溶液均用棕色容量瓶配制,避光保存。ABTS+工作液的配制:将7.4 mmol/L的ABTS+溶液与2.6 mmol/L的过硫酸钾溶液1∶1混合,室温避光静置12 h,再用无水乙醇稀释上述混合溶液,使其734 nm波长处吸光度为0.70±0.02。DNS溶液的配制:称取0.315 g(3,5)-二羟基水杨酸,加少量纯化水溶解,再称取9.10 g酒石酸钾钠,加15 ml纯化水溶解后,加入1.05 g NaOH,完全溶解后,将二者混匀,再称取0.25 g苯酚,0.25 g亚硫酸钠,加少量蒸馏水完全溶解,定容至50 ml棕色容量瓶中。
1.2 方法
1.2.1 标准曲线的绘制 采用Folin-ciocalteu法测定松针多酚含量,以没食子酸为对照品,称取10.0 mg没食子酸,置于10 ml容量瓶中,用纯化水将其为质量浓度1.0 mg/ml的储备液,再将储备液依次稀释为10μg/ml、20μg/ml、30μg/ml、40μg/ml、50μg/ml、60 μg/ml的对照品溶液,取不同质量浓度对照品溶液与纯化水各0.5 ml置于10 ml比色管中,加入1.0 ml福林酚试剂,充分振荡摇匀后静置5 min,加入2.0 ml 10% Na2CO3溶液,加水定容至10 ml,30 ℃水浴锅中反应1 h,在波长765 nm处测定其吸光度,得到回归方程Y=0.006 6x+0.049 9,其中x为溶液没食子酸质量浓度(μg/ml),Y为溶液吸光度,线性相关系数为0.997 7,表明当没食子酸浓度在10~60 μg/ml时,标准曲线方程线性良好,适用于落叶松松针多酚提取率的测定。
1.2.2 松针中多酚含量的测定 称取6种松科植物松针粉末各1.00 g,采用超声辅助法提取多酚,得到松针多酚提取液V ml,取1 ml提取液置于10 ml容量瓶中,加纯化水稀释至10 ml,再取0.5 ml稀释后的溶液置于10 ml比色管中,加入1.0 ml福林酚试剂,充分振荡摇匀后静置5 min,加入2.0 ml 10%Na2CO3溶液,加纯化水定容至10 ml,30 ℃水浴锅中反应1 h,在波长765 nm处测定其吸光度,再根据标准曲线及测定的吸光度,得到多酚质量浓度。进而利用下式,计算松针样品提取的多酚含量:
多酚含量(mg/g)=C×V×nm×100%(1)
式1中,C为样品中多酚质量浓度(μg/ml),V为提取液体积(ml),n等于稀释倍数(n=10),m为样品质量(g)。
1.2.3 松针提取工艺的优化 首先以天水落叶松松针样品为例,考察温度、时间、乙醇体积分数、液料比4个因素对松针多酚提取率的影响:(1)准确称量1.0 g松针粉末置于50 ml锥形瓶内,加入25 ml 40%的乙醇,分别在30 ℃、40 ℃、50 ℃、60 ℃、70 ℃下超声提取40 min;(2)准确称量1.0 g松针粉末置于50 ml锥形瓶内,加入25 ml 40%的乙醇,在40 ℃条件下分别超声提取20 min、30 min、40 min、50 min、60 min;(3)准确称量1.0 g松针粉末置于50 ml锥形瓶内,加入25 ml不同体积分数(40%、50%、60%、70%、80%)的乙醇溶液,在40 ℃條件下分别超声提取40 min;(4)准确称量1.0 g松针粉末置于50 ml锥形瓶内,加入15 ml、20 ml、25 ml、30 ml、35 ml的40%乙醇溶液,在40 ℃条件下分别超声提取40 min;经上述处理后得到的提取液按方法1.2.2中介绍的方法测定多酚含量。每处理3个重复。
以上述各单因素试验最优的3个水平开展响应面优化试验:运用Design-Expert 13软件进行4因素(提取温度、提取时间、乙醇体积分数、料液比)3水平响应面优化试验设计,测定各组合条件下的多酚含量。各处理3个重复。 进而进行松针多酚提取工艺的优化设计。
1.2.4 松针多酚抗氧化与酶抑制能力的测定 利用6种松科植物松针粉末,依据上述优化工艺,采用超声辅助法得到多酚提取液,测得多酚含量,进一步用60%乙醇稀释得到不同质量浓度的松针多酚溶液。同样以60%乙醇稀释抗坏血酸得到相同质量浓度的抗坏血酸溶液。进而进行松针多酚抗氧化与酶活性抑制能力的测定。
1.2.4.1 DPPH自由基清除能力测定 参照文献[14]的方法,在96孔板中分别加入50 μl不同质量浓度(10 μg/ml、20 μg/ml、40 μg/ml、60 μg/ml、80 μg/ml、120 μg/ml)的松针多酚溶液及抗坏血酸溶液,然后再加入50 μl的0.2 mmol/L的DPPH溶液,摇匀,在室温下避光反应30 min,517nm处测得吸光度A1,用无水乙醇溶液代替DPPH溶液,测得松针多酚与乙醇混合溶液的吸光度A2,用无水乙醇溶液代替样品溶液,测得乙醇与DPPH混合溶液的吸光度A0,按公式(2)计算自由基清除率:
自由基清除率=1-A1-A2A0×100%(2)
1.2.4.2 ABTS+自由基清除能力测定 参照文献[15]的方法,在96孔板中分别加入50 μl不同质量浓度(0.05 mg/ml、0.10 mg/ml、0.20 mg/ml、0.30 mg/ml、0.40 mg/ml、0.50 mg/ml)的松针多酚溶液及抗坏血酸溶液,加入200 μl的ABTS+工作液,振荡摇匀,25 ℃条件下避光充分反应 5 min,734 nm下测得吸光度A1;以200 μl纯化水代替ABTS+溶液,测得松针多酚与水溶液的吸光度A2;以50 μl纯化水代替样品溶液,测得水和ABTS+溶液的吸光度A0。按公式(2)计算ABTS+自由基清除率。
1.2.4.3 ·OH自由基清除能力测定 参照文献[16]的方法,在96孔板中分别加入50 μl不同质量浓度(1 mg/ml、2 mg/ml、3 mg/ml、4 mg/ml、6 mg/ml、8 mg/ml)的松针多酚溶液以及与样品相同质量浓度的抗坏血酸溶液,50 μl 9.0 mmol/L的FeSO4溶液和50 μl 9.0 mmol/L的水杨酸溶液,最后再加入50 μl 9.0 mmol/L的H2O2溶液,37 ℃水浴加热30 min,510 nm下测得吸光度A1;取50 μl纯化水代替水杨酸溶液,测得上述混合溶液的吸光度A2;以50 μl纯化水代替多酚溶液,测得混合溶液的吸光度A0。按公式(2)计算·OH自由基清除率。
1.2.4.4 α-葡萄糖苷酶活性抑制率测定 参照文献[17]、[18]的方法,在96孔板中分别加入10 μl不同质量浓度(2.5 μg/ml、5.0 μg/ml、10.0 μg/ml、20.0 μg/ml、40.0 μg/ml、80.0 μg/ml)的样品溶液以及与样品相同质量浓度的阿卡波糖溶液,在上述溶液中分别加入20 μl 0.2 U/ml的α-葡萄糖苷酶溶液,37 ℃下反应10 min,加入30 μl 10 mmol/L 的PNPG溶液,37 ℃下反应30 min,加入80 μl 1 mol/L的Na2CO3溶液终止反应,405 nm下测吸光度,记为A1;用0.1 mol/L PBS 缓冲液代替α-葡萄糖苷酶,测得混合溶液的吸光度A2;用PBS 缓冲液代替样液作为对照,测得混合溶液的吸光度A3;用PBS缓冲液代替样品和酶溶液作为空白,测得混合溶液的吸光度A4。按公式(3)计算酶活性抑制率:
抑制率=1-A1-A2A3-A4×100%(3)
1.2.4.5 α-淀粉酶活性抑制率测定 参照文献[19]、[20]的方法,在96孔板中加入20 μl不同质量浓度(0.10 mg/ml、0.25 mg/ml、0.50 mg/ml、1.00 mg/ml、2.00 mg/ml、4.00 mg/ml,樟子松质量浓度为2 mg/ml、4 mg/ml、6 mg/ml、8 mg/ml、10 mg/ml、12 mg/ml)的样品溶液以及与样品相同质量浓度的阿卡波糖溶液,然后分别加入20 μl 8 U/ml的α-淀粉酶溶液,37 ℃下反应10 min后,加入40 μl 1%的可溶性淀粉溶液,37 ℃下继续反应10 min,最后加入20 μl DNS溶液,100 ℃下反应10 min后,在540 nm下测得吸光度A1;用0.1 mol/L的 PBS 缓冲液代替α-淀粉酶,测得上述混合溶液的吸光度A2;用PBS 缓冲液代替样液作为对照,测得混合溶液的吸光度A3;用PBS缓冲液代替样品和酶溶液作为空白,测得混合溶液的吸光度A4。按公式(3)计算酶活性抑制率。
1.2.4.6 酪氨酸酶活性抑制率测定 参照文献[21]、[22]的方法,向96孔板中依次加入50 μl不同质量浓度(0.05 mg/ml、0.10 mg/ml、0.25 mg/ml、0.50 mg/ml、0.75 mg/ml、1.00 mg/ml,樟子松质量浓度为0.25 mg/ml、0.50 mg/ml、1.00 mg/ml、2.00 mg/ml、3.00 mg/ml、4.00 mg/ml)的样品溶液以及与样品相同质量浓度的曲酸溶液,然后分别加入50 μl 100 U/ml酪氨酸酶溶液,在37 ℃水浴中孵育10 min,接着加入50 μl 0.5 mmol/L的L-DOPA溶液,在37 ℃水浴中孵育10 min后,475 nm波长下测得吸光度A1;以50 μl PBS替代酪氨酸酶溶液,测得混合溶液的吸光度A2,以PBS替代样品溶液,测得混合溶液的吸光度A3;以PBS替代样品溶液和酪氨酸酶溶液,测得混合溶液的吸光度A4。按公式(3)计算酪氨酸酶活性抑制率。
1.3 数据处理
根据不同多酚质量浓度下得到的清除率或抑制率,采用SPSS 26软件,计算半清除或半抑制质量浓度(IC50)。
采用SPSS 26 软件及单因素方差分析法,进行处理间差异显著性分析。
2 结果与分析
2.1 单因素提取条件对松针多酚提取含量的影响
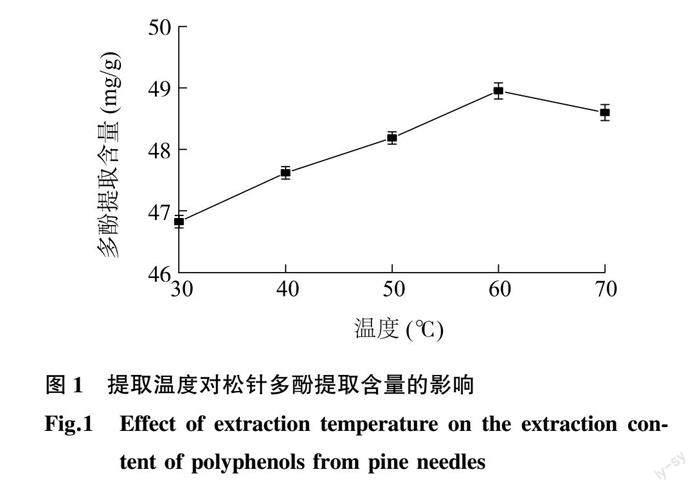
2.1.1 提取温度对松针多酚提取含量的影响 松针多酚的提取含量随提取温度的变化如图1所示。在30~60 ℃,随着温度升高,多酚提取含量呈增加趋势,温度60 ℃时,多酚提取含量达到最大值(48.95 mg/g)。这说明较高的温度有利于细胞中多酚类物质溶解。但当温度过高时会使松针中的多酚结构遭到破坏,导致提取的多酚含量下降。
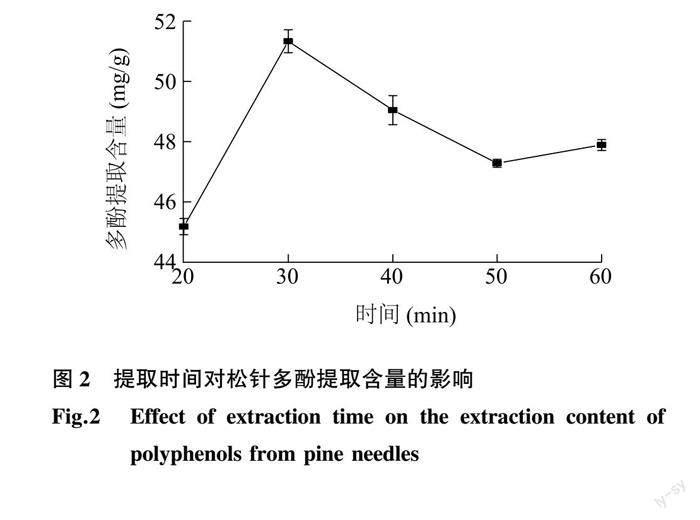
2.1.2 提取時间对松针多酚提取含量的影响 松针多酚提取含量随着提取时间的变化如图 2 所示。从图中可以看出,提取时间为30 min时,提取的多酚含量达到最大(51.32 mg/g)。当提取时间过长时,提取的多酚含量逐渐降低,原因可能是松针多酚中大量的酚羟基在长时间的提取中,发生氧化、水解或者缩合等反应,同时提取时间的延长也会造成杂质溶出增多,使得多酚提取含量降低。
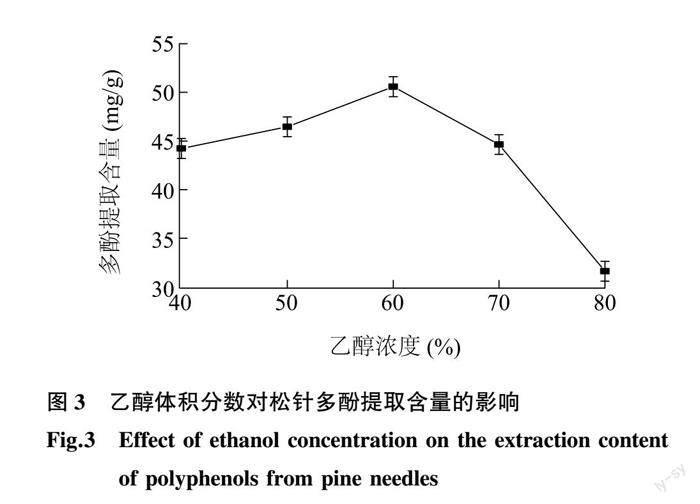
2.1.3 乙醇体积分数对松针多酚提取含量的影响 松针多酚在不同体积分数乙醇中的溶出效果如图 3 所示。当乙醇体积分数低于60%时,随着乙醇体积分数的增大,提取的多酚含量逐渐增大;在乙醇体积分数为60%时,提取的多酚含量达到最大(50.58 mg/g)。此后,随着乙醇体积分数的增加,提取的多酚含量迅速减少。这说明当乙醇体积分数较低时,溶剂极性较大,松针中含有的多酚不易溶于强极性溶剂,导致松针多酚溶解较少;当乙醇体积分数过高时,由于多酚类化合物的结构中含有大量的极性基团,溶剂极性降低同样会导致多酚的溶解性降低,松针中多酚也不易溶出。
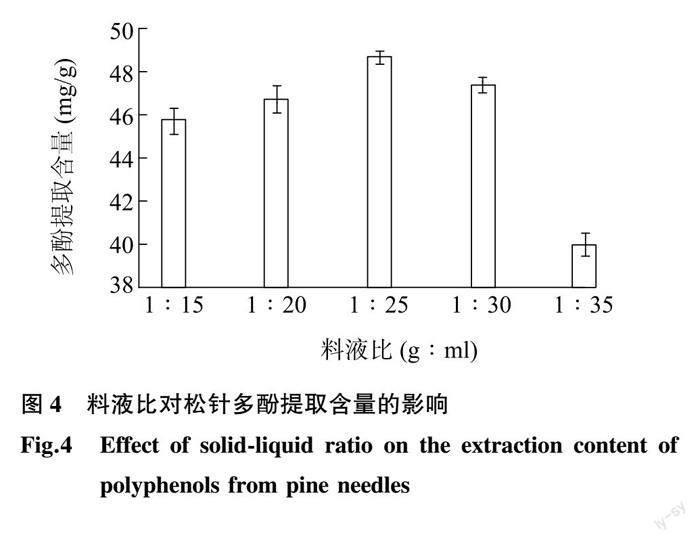
2.1.4 料液比对松针多酚提取含量的影响 松针多酚提取含量随着提取料液比的变化如图 4 所示。当料液比低于1∶25 (g∶ml)时,随着料液比的增大,提取的多酚含量逐渐增大,在料液比为1∶25 (g∶ml)时,提取的多酚含量达到最大(48.64 mg/g)。当料液比高于1∶25 (g∶ml)时,随着料液比的增大,提取的多酚含量迅速减少。这说明,适宜的料液比有利于松针中的多酚溶出。料液比低时,松针与乙醇接触不充分,而当料液比过高时,松针中的其他物质也会溶出,这些物质可能会影响765 nm的吸光度,从而导致多酚提取含量的降低。
2.2 响应曲面法优化松针多酚提取工艺
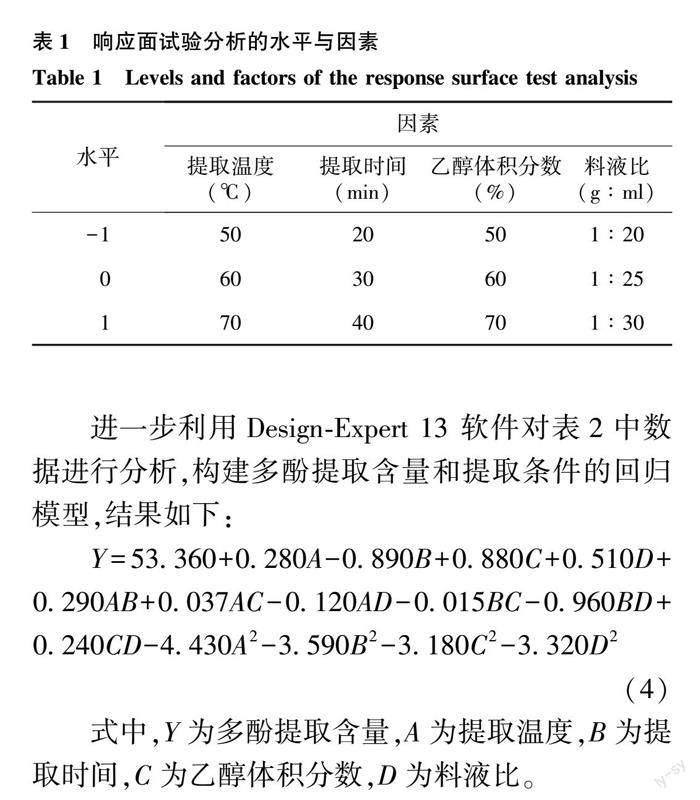
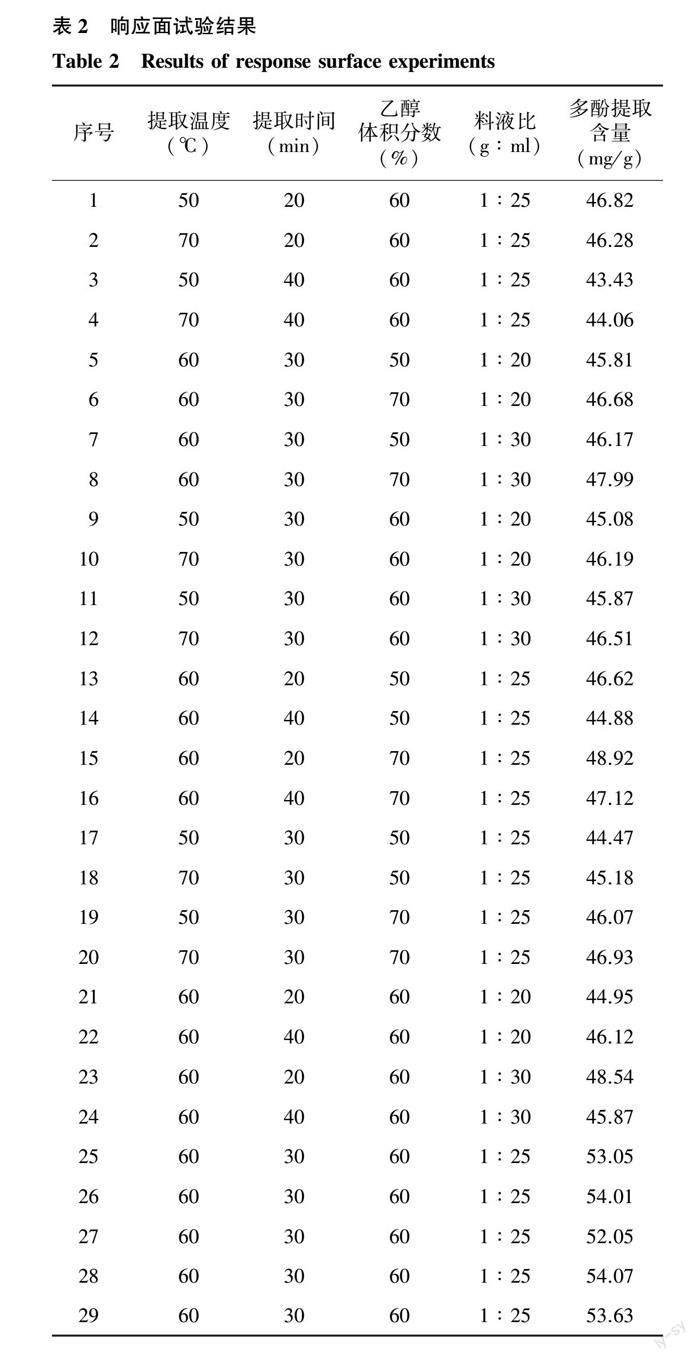
2.2.1 响应面试验设计与结果 根据上述单因素试验的结果,选取提取温度、提取时间、乙醇体积分数、料液比4个因素中多酚提取含量较高的3个水平(表1),运用Design-Expert 13软件进行4因素3水平的响应面试验设计。结果如表2。
进一步利用Design-Expert 13 软件对表2中数据进行分析,构建多酚提取含量和提取条件的回归模型,结果如下:
Y=53.360+0.280A-0.890B+0.880C+0.510D+0.290AB+0.037AC-0.120AD-0.015BC-0.960BD+0.240CD-4.430A2-3.590B2-3.180C2-3.320D2(4)
式中,Y为多酚提取含量,A为提取温度,B为提取时间,C为乙醇体积分数,D为料液比。
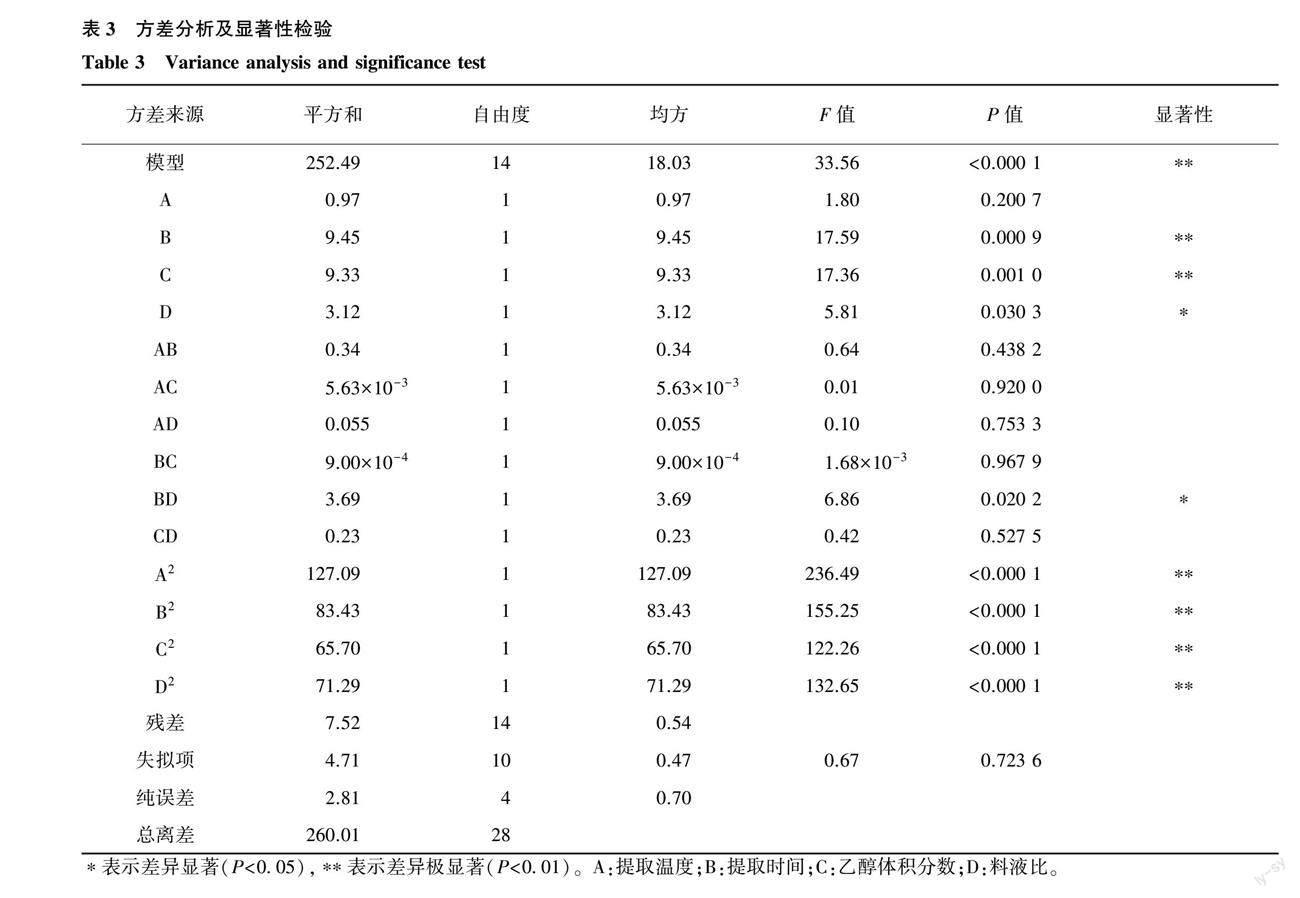
各因素对多酚提取含量的影响程度可由上式各系数绝对值反映。上述拟合关系的方差分析及显著性检验见表3。
由表3可知,模型F值为33.56,P值<0.000 1,说明模型极显著;失拟项P值大于0.05,说明该项不显著;决定系数(R2)=0.971 1,说明该模型能够很好地拟合落叶松松针多酚提取含量。除提取温度以外,提取时间、乙醇体积分数、料液比 3 个因素对落叶松松针多酚提取含量均有显著影响;提取时间与料液比之间的交互作用(BD)对提取液多酚含量有显著影响,而提取温度与提取时间的交互项(AB)、提取温度与乙醇体积分数的交互项(AC)、提取温度与料液比的交互项(AD)、提取时间与乙醇体积分数的交互项(BC)、乙醇体积分数与料液比的交互项(CD)之间对提取液多酚含量无显著性影响;二次项A2、B2、C2、D2对多酚提取含量的影响均达到极显著水平。从表3中F值大小可知,影响松针多酚提取含量最主要的因素为提取时间,其次是乙醇体积分数、料液比,影响最小的是提取温度。
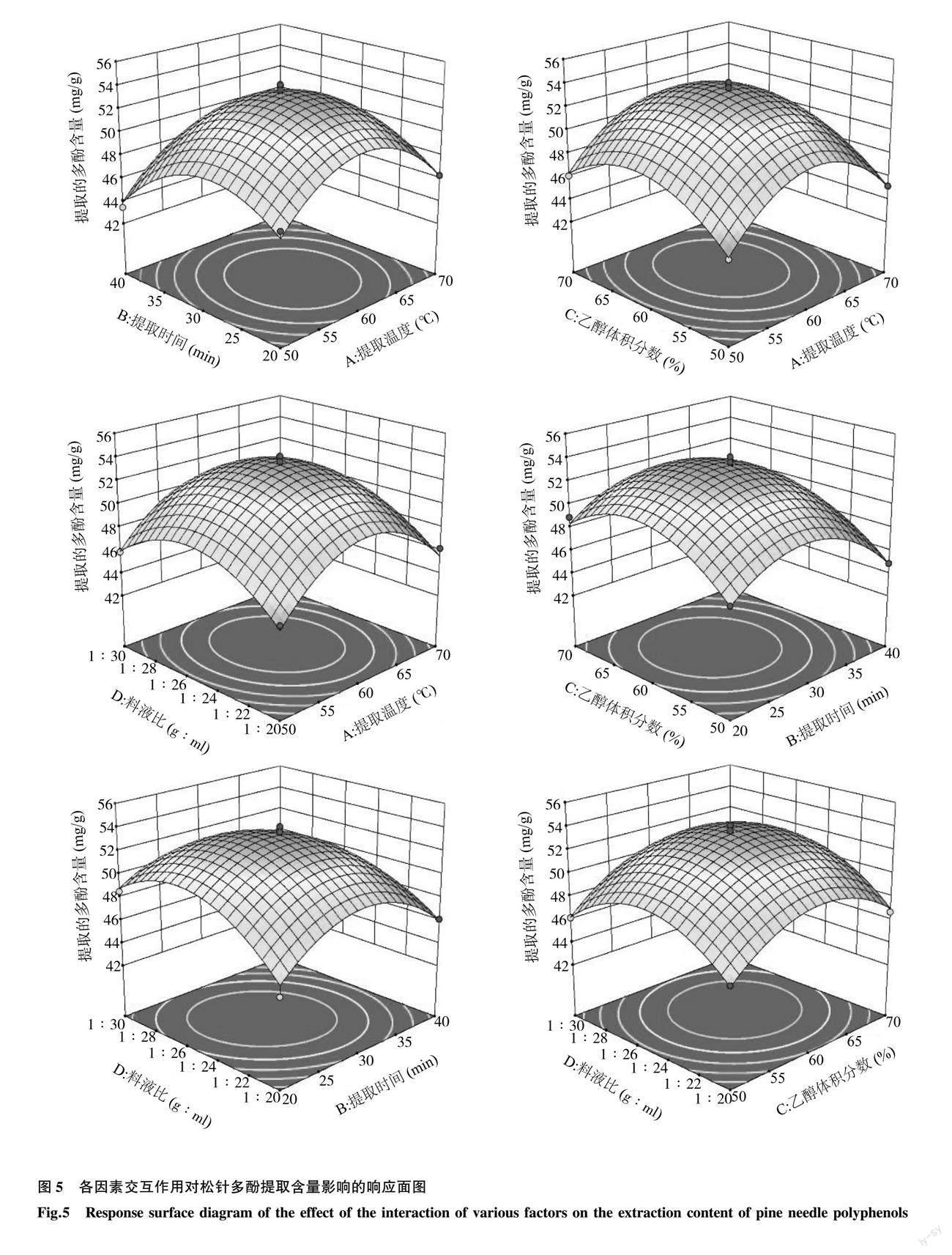
2.2.2 响应曲面图分析 各因素交互作用对落叶松松针多酚提取含量影响的响应面图如图5所示。
由图 5可知,响应面均为凸面,且开口朝下,等高线近似圆形,其中心位于考察区域内,说明各因素的水平设计数据合理。不同因素对落叶松松针多酚提取含量的影响反映在响应面曲面的陡峭程度上,响应面曲面弧度变化越陡峭,说明该因素对提取含量的影响越明显。
2.2.3 响应面验证试验 根据公式(4)可以得到松针多酚最佳提取工艺条件为提取温度60.26 ℃,提取时间28.64 min,乙醇体积分数61.42%,料液比1∶25.51(g∶ml),提取液多酚含量拟合值为53.52 mg/g。考虑到实际操作的简便性,将提取工艺参数优化为提取温度60 ℃、提取时间28 min、乙醇体积分数60%、料液比1∶25 (g∶ml)。按优化的工艺条件进行松针多酚提取,多酚提取含量为(53.41±0.21) mg/g,与响应面模型的拟合值基本一致。因此,本研究得到的松针多酚提取工艺参数是合理的,可用于松针多酚的提取。
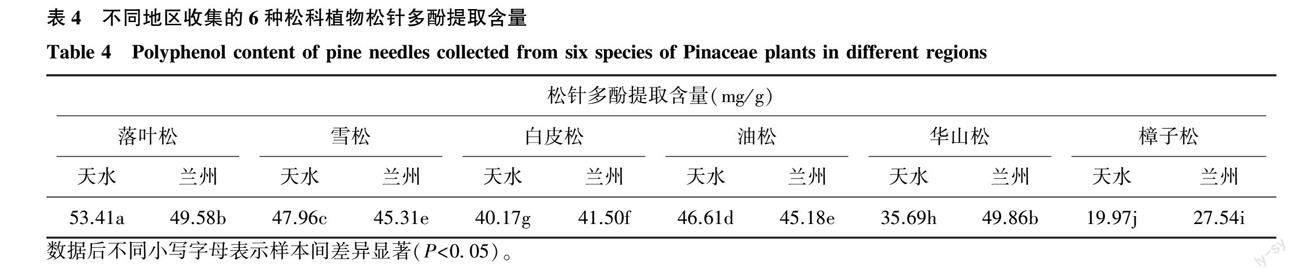
2.2.4 6种松科植物的松针多酚提取含量 按照上述优化的提取工艺对6种松科植物松针进行多酚提取和含量测定,结果见表4。6种松针多酚提取含量为(19.97±0.09)~(53.41±0.21) mg/g,其中天水落叶松松针多酚提取含量最高,为(53.41±0.21) mg/g,天水樟子松松针多酚提取含量最低,为(19.97±0.09) mg/g;不同松科植物、不同地区松针多酚提取含量差异显著,可见松针多酚含量随品种、地区而变化。
2.3 6种松科植物松针多酚生物活性测定
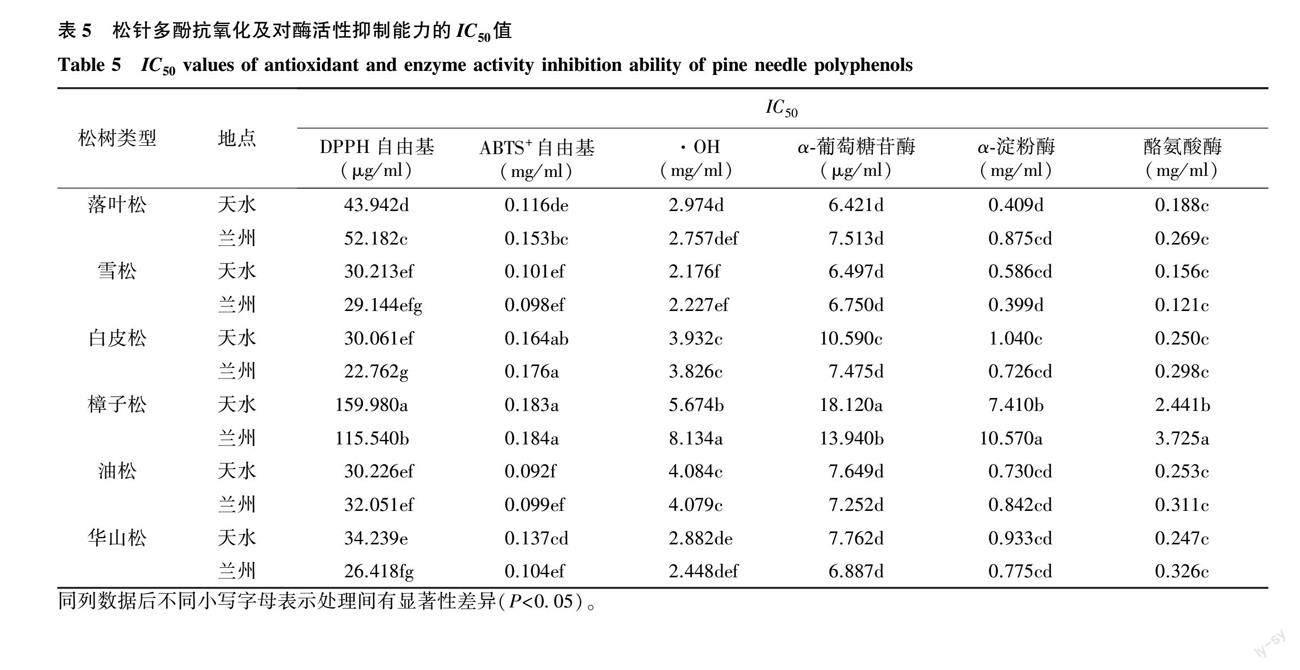
2.3.1 松针多酚对DPPH自由基的清除能力 6种松科植物松针多酚与抗坏血酸对DPPH自由基的清除率见图 6。由图可知,在质量浓度为10~120 μg/ml,随着松针多酚质量浓度的增大,其对DPPH自由基的清除能力也逐渐升高。由表 5可知,对DPPH自由基清除效果最强的为兰州白皮松松针多酚,IC50值为22.76 μg/ml,最弱的为兰州樟子松松针多酚,IC50值为159.9 μg/ml;其中雪松、白皮松、油松、华山松松针多酚对DPPH自由基的清除能力较强,落叶松、樟子松稍弱;6种松科植物之间差异性较大;兰州和天水2地的雪松和油松松针多酚对DPPH自由基的清除能力差异性较小,其余4种松科植物的松针多酚对DPPH自由基的清除能力差异较大。
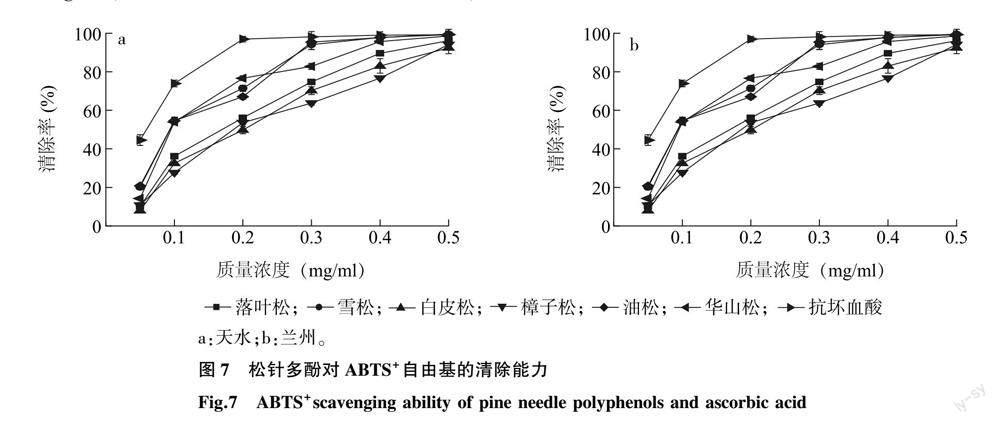
2.3.2 松针多酚对ABTS+自由基的清除能力 6种松科植物松针多酚与抗坏血酸对ABTS+自由基的清除率见图 7。由图 7可知,在0.05~0.50 mg/ml范围内,随着松针多酚质量浓度的增大,其清除ABTS+自由基的能力也逐渐升高。由表 5可知,对ABTS+自由基清除效果最强的为天水油松松针多酚,IC50值为0.092 mg/ml,最弱的为兰州樟子松松針多酚,IC50值为0.184 mg/ml;其中雪松和油松松针多酚对ABTS+自由基的清除能力较强,白皮松、樟子松松针多酚的清除能力最差;6种松科植物松针多酚对ABTS+自由基的清除能力差异较大;兰州和天水2个地区落叶松、华山松松针多酚对ABTS+自由基的清除能力有显著差异。
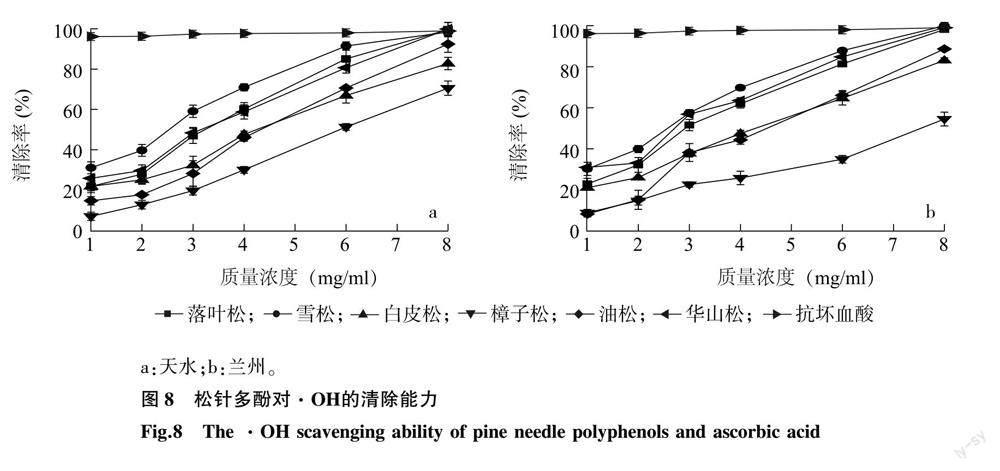
2.3.3 松针多酚对羟基自由基(·OH)的清除能力 6种松科植物松针多酚与抗坏血酸对·OH的清除率见图 8。由图 8可知,在1.0~8.0 mg/ml范围内,随着松针多酚质量浓度的增大,其清除·OH的能力也逐渐升高。由表 5可知,对·OH清除效果最强的为天水雪松松针多酚,IC50值为2.176 mg/ml,最弱的为兰州樟子松松针多酚,IC50值为8.134 mg/ml;其中雪松、华山松松针对·OH的清除能力较强,白皮松、樟子松、油松稍弱;6种松科植物的松针多酚对·OH的清除能力差异较大;兰州、天水两个地区樟子松松针多酚的·OH清除能力差异较大,其余5种松针多酚的清除能力无显著差异。
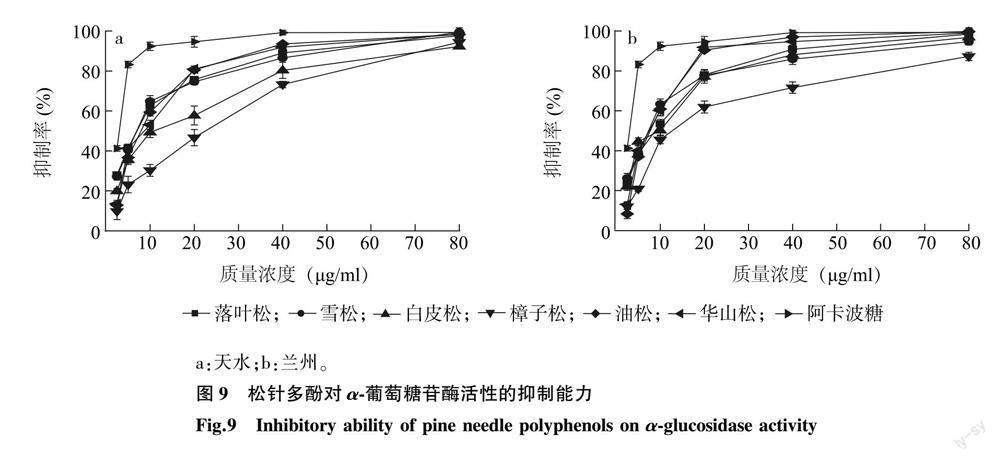
2.3.4 松针多酚对α-葡萄糖苷酶活性的抑制能力 6种松科植物松针多酚与阿卡波糖对α-葡萄糖苷酶活性的抑制率见图 9。由图 9可知,在2.5~80.0 μg/ml范围内,随着多酚质量浓度的增大,松针多酚对α-葡萄糖苷酶活性的抑制能力也逐渐升高。由表 5可知,6种松科植物松针多酚中对α-葡萄糖苷酶活性抑制能力最强的为天水落叶松松针多酚,IC50值为6.421 μg/ml,最弱的为兰州樟子松松针多酚,IC50值为18.120 μg/ml;落叶松、雪松、油松、华山松松针多酚对α-葡萄糖苷酶活性的抑制能力较强,白皮松、樟子松稍弱;兰州、天水两个地区落叶松、雪松、油松、华山松松针多酚对α-葡萄糖苷酶活性的抑制能力无显著性差异,而2地区樟子松和白皮松松针多酚的抑制能力差异较大。
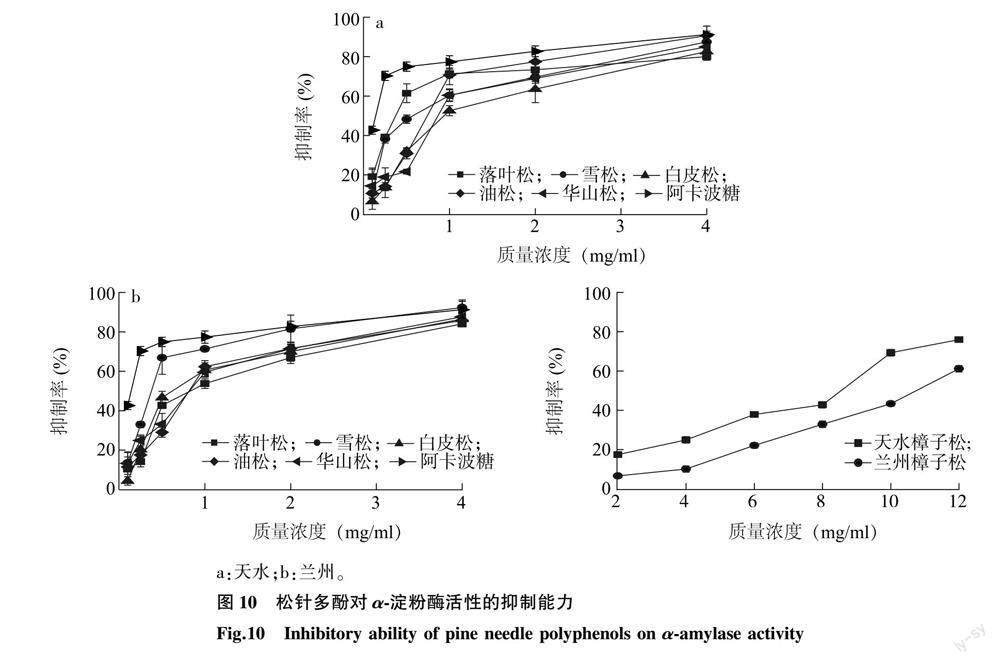
2.3.5 松针多酚对α-淀粉酶活性的抑制能力 6种松科植物松针多酚与阿卡波糖对α-淀粉酶活性的抑制率见图 10。由图10可知,在0.1~4.0 mg/ml(樟子松松针多酚为2~8 mg/ml)范围内,随着松针多酚质量浓度的增大,松针多酚对α-淀粉酶活性的抑制能力也逐渐升高。由表 5可知,6种松科植物松针多酚对α-淀粉酶活性抑制能力最强的为兰州雪松松针多酚,IC50值为0.399 mg/ml,最弱的为兰州樟子松松针多酚,IC50值为10.570 mg/ml;6种松科植物中,樟子松松针多酚的抑制能力稍弱,其余5种松科植物松针多酚的抑制能力较强,且相互之间差异较小;兰州、天水两个地区的落叶松、雪松、白皮松、油松、华山松松针多酚对α-淀粉酶活性的抑制能力差异较小,而兰州、天水两地区的樟子松松针多酚对α-淀粉酶活性的抑制能力存在显著差异。
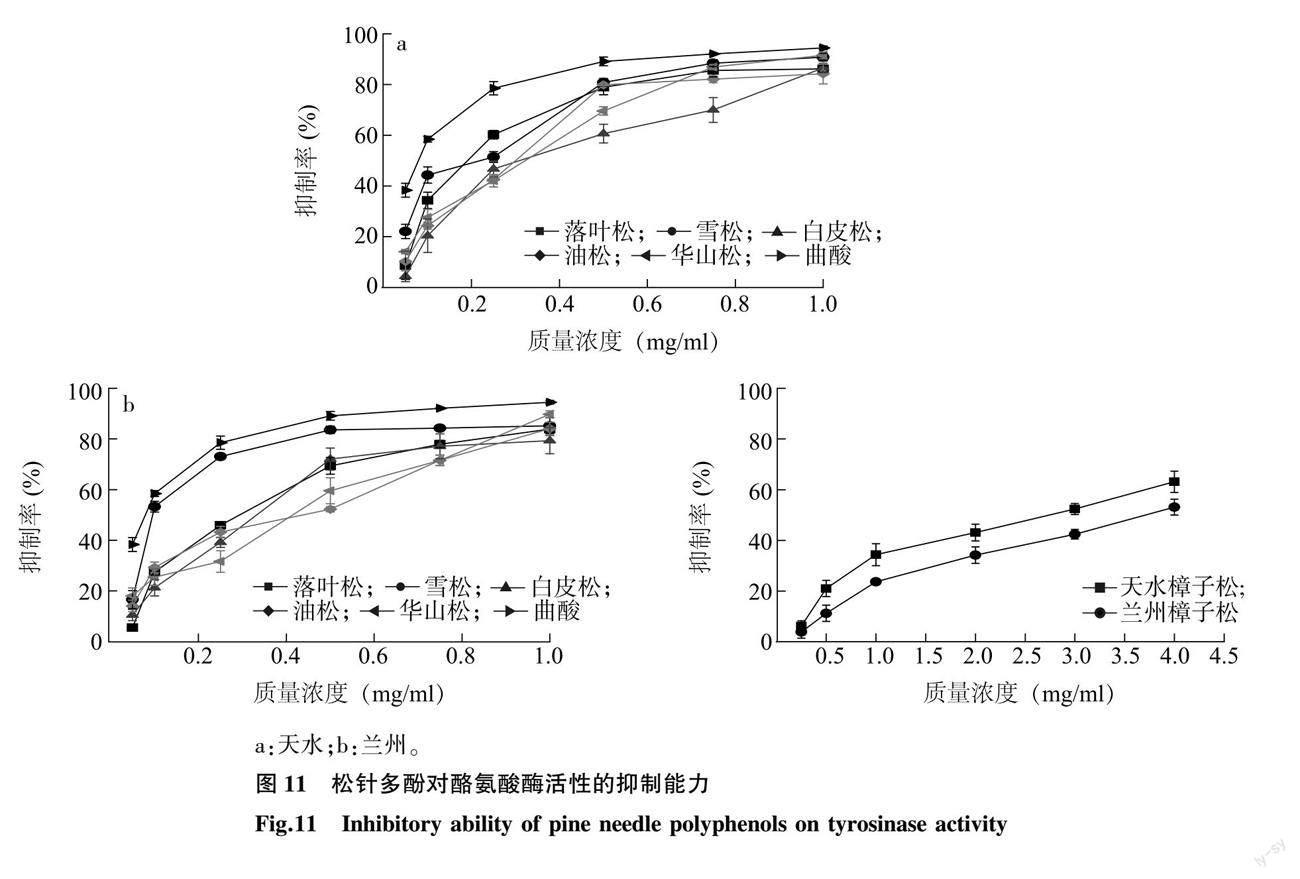
2.3.6 松针多酚对酪氨酸酶活性的抑制能力 6种松科植物松针多酚与曲酸对酪氨酸酶活性的抑制率见图 11。由图 11可知,在0.05~1.00 mg/ml(樟子松松针多酚为0.25~4.00 mg/ml)范围内,随着松针多酚质量浓度的增大,松针多酚对酪氨酸酶活性的抑制能力也逐渐升高。由表5可知,6种松科植物松针多酚中对酪氨酸酶活性抑制能力最强的为兰州雪松松针多酚,IC50值为0.121 mg/ml,最弱的为兰州樟子松松针多酚,IC50值为3.725 mg/ml;落叶松、雪松、白皮松、油松、华山松松针多酚对酪氨酸酶活性的抑制能力都较强,天水、兰州两地的樟子松松针多酚抑制能力稍弱;6种松科植物中,樟子松松针多酚对酪氨酸酶活性的抑制能力显著偏低,其余5种松科植物松针多酚的抑制能力没有显著差异;兰州与天水两地的落叶松、雪松、白皮松、油松、华山松松针多酚对酪氨酸酶活性的抑制能力无显著性差异,而两地区樟子松松针多酚的抑制能力存在显著差异。
3 讨论与结论
影响松针多酚提取效率的因素除本试验分析的4个因素外,还包括溶剂种类、超声功率、提取次数等。不同溶剂的极性不同,能溶解的多酚类型和效率也不同;超声功率的增大,可以使物料的空化气泡运动加速,加快有效物质的溶出,但过大的功率也会破坏多酚类化合物的结构,而提取次数的增加在一定程度上能增加溶质的溶出,但另一方面也造成了溶剂的消耗;张桂芳等[23]的研究结果表明,不同样品干燥方法与不同溶剂提取对红松松针多酚提取量亦有影响,热风干燥松针的提取物活性最佳,其次为冷冻干燥、晾晒干燥,而乙醇提取的提取物生物活性優于水提取;作者亦分析了不同提取溶剂对多酚提取含量的影响,结果表明乙醇作为溶剂提取的多酚含量显著高于丙酮与乙酸乙酯,而甲醇的提取效果与乙醇没有显著性差异,考虑到安全因素,本研究采用乙醇作为提取溶剂。
本试验以6种松科植物松针为对象,采用超声辅助乙醇提取法,考察温度、时间、乙醇体积分数、液料比4个因素对松针多酚提取含量的影响,通过单因素试验结合响应面分析,确定了松针多酚的最佳提取条件为提取温度60 ℃、提取时间28 min、乙醇体积分数60%、料液比1∶25 (mg∶ml),在此条件下6种松科植物松针多酚提取含量为(19.97±0.09)~(53.41±0.21) mg/g;结果显示,6种松科植物松针中,除樟子松外,其他松针多酚提取量均较高,且提取的松针多酚都具有较高的抗氧化活性与酶活性抑制能力。6种松科植物松针多酚的抗氧化活性差异较大,而酶活性抑制能力差异较小。α-葡萄糖苷酶活性抑制剂对于降低餐后血糖,降低机体心血管并发症具有显著作用;α-淀粉酶活性抑制剂可以降低人体内血糖指数,抑制人体对葡萄糖的吸收,从而有效控制餐后血糖,调节血脂,而酪氨酸酶是调控机体合成黑色素的限速酶,与果蔬的氧化,人体内黑色素肿瘤以及色素障碍性疾病有显著关系,而酪氨酸酶活性抑制剂可以治疗如皮肤色素沉积、老年斑、雀斑等多种症状,具有明显的美白作用。目前常用的α-葡萄糖苷酶与α-淀粉酶活性抑制剂,如阿卡波糖,具有导致胃肠道功能紊乱、肠胀气、腹泻等副作用;酪氨酸酶活性抑制剂,如曲酸,具有致癌和引发皮炎等副作用,因此从天然植物中寻找抗氧化、降糖药物以及酪氨酸酶活性抑制剂具有巨大市场潜力。作为一种资源丰富的天然产物,松针获取简易,成本亦低,并且松针的药用历史悠久,体内外试验结果表明其有显著的药理作用,且安全性较高。目前以松针为原料开发的产品主要有面膜、糖果、酸奶、饮料、酒等日护品、食品及化妆品。本研究结果为利用松针资源进行天然抗氧化剂、降糖药物以及酪氨酸酶活性抑制剂的研发提供了理论依据。
参考文献:
[1] 余金橙,付梦凡,崔 楠, 等. 植物多酚缓解运动疲劳作用机制研究进展[J]. 食品工业科技, 2022,43(3): 472-478.
[2] IQBAL Y, PONNAMPALAM E N, COTTRELL J J, et al. Extraction and characterization of polyphenols from non-conventional edible plants and their antioxidant activities[J]. Food Res Int, 2022,157: 111205.
[3] KHANZADA B, AKHTAR N, OKLA M K, et al. Profiling of antifungal activities and in silico studies of natural polyphenols from some plants[J]. Molecules, 2021,26(23):7164-7178.
[4] 田富林,黄文晶,王 展,等. 植物多酚提取研究进展[J]. 食品与机械, 2020,36(9): 211-216.
[5] 姜 楠,王 蒙,韦迪哲,等. 植物多酚类物质研究进展[J]. 食品安全质量检测学报, 2016,7(2): 439-444.
[6] 李亚勇,张 平,李茂林,等. 华北落叶松不同部位的挥发物成分分析[J]. 山西农业科学, 2022,50(5): 682-689.
[7] 骆 娟,侯 静,杨舒婷,等. 日本落叶松凋落针叶总黄酮的提取工艺及抗氧化活性研究[J]. 四川大学学报(自然科学版), 2021,58(3): 188-194.
[8] KHATAMIAN N, SOLTANI M, SHADAN B, et al. Pinus morrisonicola needles essential oil nanoemulsions as a novel strong antioxidant and anticancer agent[J]. Inorganic and Nano-Metal Chemistry, 2022,52(2):253-261.
[9] 赵学丽,舒 钰,王 丹. 红松松针挥发油氨基酸组分及化合物成分[J]. 东北林业大学学报, 2019,47(6): 40-44.
[10]张国强,李 运,鲁艳梅,等. 超级微波消解-ICP-MS/AFS测定雪松松针中28种元素[J]. 药物分析杂志, 2021,41(6): 1046-1053.
[11]刘晓庚,陈梅梅. 我国松针的开发利用研究及进展[J]. 林产化工通讯, 2003,37(4): 29-34.
[12]张桂芳,张东杰,郭希娟,等. 三种松针活性成分含量及清除自由基能力的比较[J]. 天然产物研究与开发, 2016,28(7): 1066-1070.
[13]马承慧,王 群,刘 牧. 7种松科植物松针提取物的体外抗氧化活性比较[J]. 东北林业大学学报, 2016,44(6): 45-48.
[14]陈铁杨,胡文忠,侯梦阳,等. 超声辅助提取金花茶叶多酚的工艺优化及其抗氧化活性研究[J].食品研究与开发,2022,43(6):25-31.
[15]崔巧玉,沈雯娟,孙小璐,等. 郁金香总多酚提取工艺优化及其抗氧化活性研究[J]. 中成药, 2022,44(6): 1918-1922.
[16]李晓强,胡 坤,龚玉石,等. 不同产地、不同提取方法对余甘子多酚含量及抗氧化活性的影响[J]. 食品工业科技, 2023, 44(2):317-323.
[17]朱延胜,魏 明,钱森和,等. 紫山药多酚分离纯化及其对α-葡萄糖苷酶活性的抑制作用[J]. 食品与发酵工业, 2022,48(16):182-187.
[18]关 媛,王雪盈,孙媛媛,等. 鸡血藤提取物对α-淀粉酶和α-葡萄糖苷酶的抑制作用研究[J]. 食品与发酵工业, 2023,49(7):126-132.
[19]于聪聪,姚玉阳,耿雪营,等. 橡实不同极性萃取物对α-淀粉酶和α-葡萄糖苷酶抑制作用研究[J]. 天然产物研究与开发, 2022,34(11): 1838-1845.
[20]代嫚婷,宋 静,余 潇, 等. 海黄牡丹不同部位的成分分析、体外抗氧化能力及其α-葡萄糖苷酶、α-淀粉酶抑制能力[J]. 食品与发酵工业, 2023. https://doi.org/10.13995/j.cnki.11-1802/ts.033018.
[21]彭春彦,谢 星,李一华,等. 海带、坛紫菜和裙带菜游离和结合酚抗氧化和酶抑制活性比较[J]. 食品与发酵工业, 2023,49(4): 110-116.
[22]梁 蒙,王亚凤,谢桃结,等. 洋紫荆粉色花的化学成分及其酪氨酸酶抑制活性研究[J]. 林产化学与工业, 2022,42(4): 68-74.
[23]张桂芳,杜珊珊,史 蕊,等. 处理方法和提取溶剂对松针提取物抗氧化活性的影响[J]. 中国医院药学杂志, 2017,37(16): 1602-1606.
(责任编辑:石春林)

