pH对生物脱硫系统的性能及菌群结构的影响
贾体沛, 彭 轶, 孙事昊, 彭永臻
(1.北京工业大学环境与生命学部城镇污水深度处理与资源化利用技术国家工程实验室, 北京 100124;2.信开环境投资有限公司, 北京 101101; 3.北京信通碧水再生水有限公司, 北京 101149)
H2S是一种具有臭鸡蛋气味的有毒气体,可在多种工业过程中产生[1]。如沼气中的H2S质量浓度可从1 390到278 000 mg/m3不等[2]。生物处理被认为是处理恶臭气体的最合适选择,因其运行成本低,安全性高。常用的生物反应器有生物过滤池、生物洗涤池和生物滴滤池(bio-trickling filter, BTF)[3]。其中,BTF的操作参数(pH、温度、湿度等)易调控,且代谢产物易排出,近年来已成为一个研究热点。
生物反应器运行中经常遇到由生物量过度累积而引起的高压降(pressure drop, Δp)问题。高Δp不但会使得鼓风机消耗更多的能源,还会降低生物反应器的性能。传统的生物量控制方法包括高速水流冲洗过滤床,控制进气负荷以及碳素和其他营养元素的供给,以及化学清洗[4-6]。如,Deshusses等[6]曾使用次氯酸钠来去除生物质,此方法所需的化学试剂成本高,而且生物反应器在去除过多的生物质后需要相对较长的时间来恢复性能。因此,研发低成本且不会降低生物反应器性能的生物量控制策略对生物系统的长期稳定运行具有重要意义。
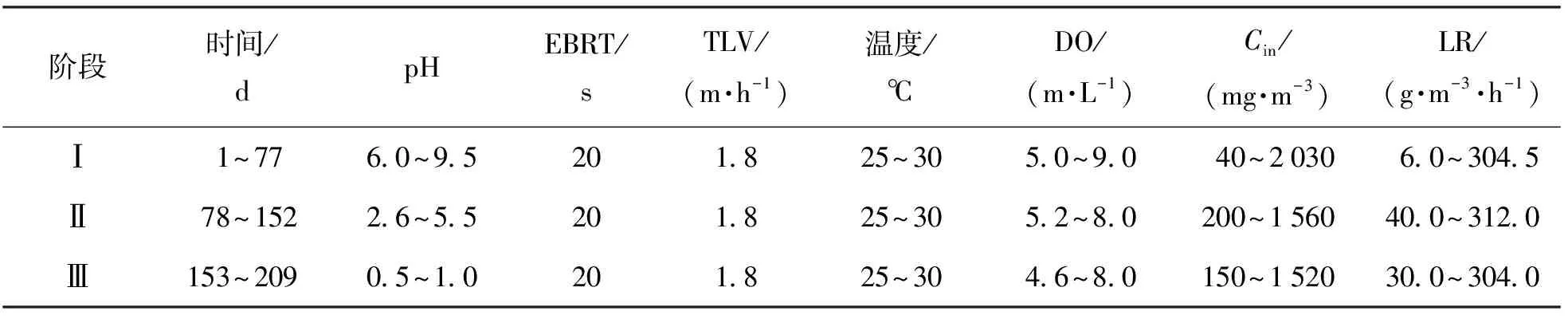
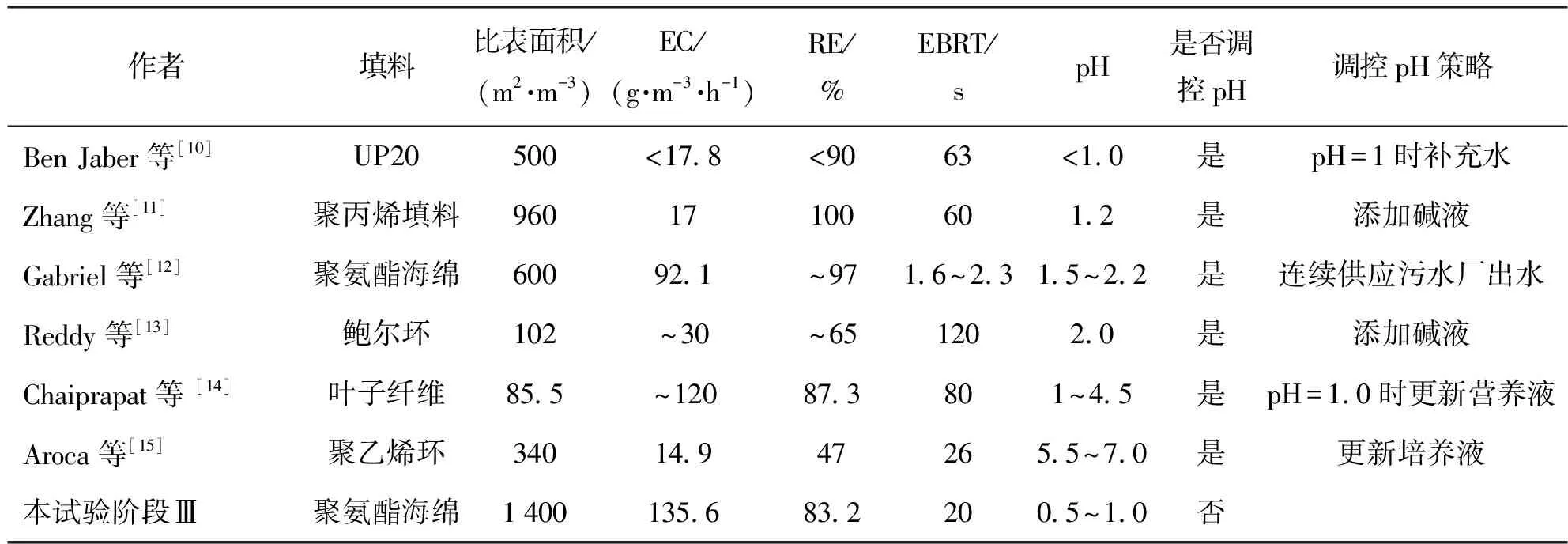
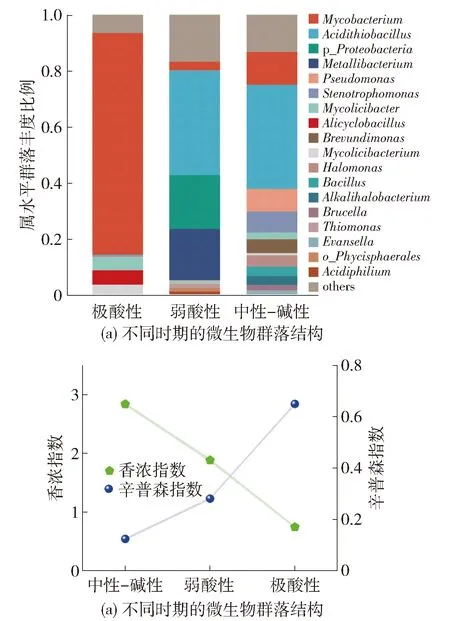
pH是生物反应器核心参数之一,因为它会改变微生物的群落结构。H2SO4是H2S生物氧化的最终产物,H2SO4的积累会降低生物系统内的pH,造成生物系统的酸化。许多去除H2S的研究都选择在酸性条件(pH<5)下进行[7-8]。Jia等[9]甚至在极端酸性条件(pH<1)下实现了对H2S的高效去除。由于H2S是一种酸性气体,低pH条件对H2S的气液传质产生较高的阻力,为了提高液相对H2S吸收能力,许多研究选择在中性偏碱性条件(6 本文目的是探究pH变化对脱硫生物反应器微生物群落结构的影响,分析在不同pH范围内,生物反应器脱硫性能、生物量增长、过滤床Δp的变化,对比不同pH范围运行的优缺点,并提出利用pH来控制脱硫系统中生物量增长的策略,为实际的工业应用提供有价值的信息和策略,推动脱硫技术的进一步发展和应用。 本试验采用的设备是一个圆柱形反应器(直径6 cm;高度64 cm),如图1所示。设备填充材料的是聚氨酯海绵(polyurethane foam, PUF)立方体(尺寸1 cm×1 cm×1 cm、孔隙率94%、比表面积1 400 m2/m3),填充高度为60 cm(过滤床体积1.7 L)。PUF材料具有高孔隙率、大比表面积、良好的亲水性和快速挂膜的特性,是理想的生物填料。通过向H2SO4溶液中逐滴加入Na2S溶液来生成H2S气体,再利用鼓风机将气体输送至BTF底部的进气口,然后气体通过过滤床,最后从BTF顶部的出气口排出。为了评估BTF系统对H2S的最大去除性能,使用H2S气瓶以增加BTF进气中的H2S质量浓度。H2S气瓶的流量由一个减压阀和电子流量控制器进行控制。气瓶中的H2S气体与化学法制取的H2S气体在缓冲瓶中混合后,一同进入BTF。气体流量计用于调节进入BTF的气体流量,以控制BTF的空床停留时间(empty bed retention time, EBRT)。矿物培养基作为循环液,由蠕动泵供给至过滤床顶部,然后流过过滤床,再次回到BTF底部的水箱。 试验所用的微生物接种源为取自北京市昌平区沙河污水处理厂生化池的活性污泥,该污水处理厂运行模式为厌氧/缺氧/好氧。填料的挂膜方法为:将上述活性污泥倒入装满PUF立方体的桶中,对桶曝气7 d以固定足够的生物质到PUF表面,然后将挂膜后的PUF立方体转移到BTF中。 矿物质培养基作为BTF系统的循环液,其主要成分为:2 g/L KH2PO4, 2 g/L K2HPO4, 0.4 g/L NH4Cl, 0.2 g/L MgCl2·6H2O, 0.01 g/L FeSO4·7H2O和1 mL/L S8型微量元素溶液。矿物培养基的初始碱度为37.7 mmol/L,每10 d更新一半培养基以排出微生物代谢产物。 试验持续了209 d,表1显示了每个阶段的详细操作参数。根据BTF系统培养基的pH范围,将试验过程分为3个阶段。阶段Ⅰ是中性偏碱性操作阶段,BTF在该时期启动并在pH为6.0~9.5条件下运行。阶段Ⅱ是弱酸性时期,此时矿物培养基的pH范围切换到2.6~5.5。在阶段Ⅰ和阶段Ⅱ,通过每12 h向矿物介质中加入2~4 mL NaOH溶液(4.5 mol/L)以调节pH范围。在阶段Ⅲ,停止添加任何碱性试剂,使培养基pH逐渐降低至极酸性范围(pH<1.0)。 表1 BTF系统在各阶段的运行参数 在本文中,H2S去除率(removal efficiency, RE),H2S进气负荷(loading rate, LR),H2S去除速率(elimination capacity, EC),EBRT,Δp,气体表观流速(superficial gas velocity,v),循环液滴滤速度(trickling liquid velocity, TLV)和耗氧速率(oxygen uptake rate, OUR)的公式如下: 式中:Cin为进气质量浓度,g/m3;Cout为出气质量浓度,g/m3;Qg为空气流量,m3/h;Ql为循环液流量,m3/h;VB为过滤床体积,m3;p0为填料床两端气压差,Pa;SA为过滤床横截面积,m2;H为填料床高度,m;OUR为耗氧速率,mg/(g·min);ρ(DO)为溶解氧的质量浓度,mg/L;T为时间,min;Vl为培养基体积,L。 采用气相色谱仪(7890B, 安捷伦, 美国)测定气体中H2S的质量浓度,气相色谱仪配备的检测器为增强版的火焰光度检测器,其检测下限为0.03 mg/m3。过滤床的Δp通过电子微压计(MP110,KIMO,法国)连接过滤床上部和底部的气孔测量得到,每个气体流速下测取3次气压差值,并取平均值作为最终值;BTF内的生物量(包括微生物及其代谢物以及无机颗粒物等)质量浓度通过剥离过滤床上、中、下部各2个PUF立方体上的生物质并将其过滤干燥后得到,并记作总固体(total solids, TS)质量浓度。循环液的pH、DO和温度通过WTW pH/Oxi 340i分析仪(WTW, 德国)检测得到。 在阶段Ⅰ,BTF系统在中性偏碱性条件下运行(6.0 图2 BTF在不同pH时期的长期运行效果Fig.2 Long-term operation performance of the BTF system in different phases 图3 不同时期的SOB的活性Fig.3 SOB activity in different periods 阶段Ⅱ是弱酸性运行阶段(pH在2.6~5.5),该时期循环液的DO的质量浓度保持在5.0~8.2 mg/L。 随着pH的降低,BTF系统的脱硫性能出现了一定程度的波动。在第78天至第91天之间,平均Cin保持在341.4 mg/m3,RE在92%~96%。这是由于以前适应碱性条件的SOB难以适应当前的酸性环境,导致其活性下降。在第92天到第125天,降低BTF的平均Cin至309.7 mg/m3,RE仍然在 90%~96%波动。第126天后,RE稳定在97%以上。酸性期的SOUR维持在1.25~1.27 mg/(g·min)(见图3),与碱性期相比,该时期SOB的活性明显下降。在该阶段获得的ECmax为142.8 g/(m3·h)(RE为66.6%)。传质阻力的增加和SOB的活性降低是造成弱酸性时期脱硫性能下降主要原因。 阶段Ⅲ为极酸性运行阶段。在不添加碱性试剂的情况下,循环液的pH逐渐下降到1.0以下。当pH下降到2.0以下时,RE减少到91.7%(Cin=218.8 mg/m3),此时,SOUR减少到1.16 mg/(g·min)(第156天)(见图3),这是由于强酸性环境对SOB活性的抑制。经过一段时间的适应,BTF系统的脱硫性能逐渐恢复。随着pH稳定在1.0以下,RE-H2S仍保持在98%以上。在第184天,SOUR上升至 1.35 mg/(g·min)(见图3),表明该系统已富含到高活性的嗜酸SOB。BTF在该阶段获得的ECmax为164.6 g/(m3·h)(RE为65.0%),并在RE为83.2%时,获得的EC为135.6 g/(m3·h)。极酸性时期的EC和SOB活性低于中性偏碱性时期,但明显高于弱酸性时期。表2列出了运行过程中不断调节pH的生物脱硫系统,这些系统被用作与本试验阶段Ⅲ中无须调节pH即可实现高效脱硫的方法进行比较,以突显本文的独特性和创新性。 表2 脱硫生物反应器性能和条件比较 表3 文献中报道的Δp与本工作中Δp比较 表4 生物脱硫系统在不同pH模式下运行优缺点 图4 过滤床内生物量和Δp变化Fig.4 Variation of biomass and Δp in the filter bed of the BTF 图5 各时期生物膜菌群结构及微生物多样性变化Fig.5 Structure of biofilm flora in each period and changes in microbial community diversity 在极酸性时期,主要的细菌属为Mycobacterium(79.2%)(见图5(a)),而前2个时期占据主导地位的Acidithiobacillus在极酸性时期的丰度缺低于0.1%。Mycobacterium在3个时期同时存在,表明它能适应非常宽的pH范围,但Mycobacterium在极酸性时期的高富集度,表明其对酸性条件的耐受能力最强。此外,在生物膜中还检测到Alicyclobacillus(5.14%)、Mycolicibacter(4.54%)和Mycoliciberium(3.55%)(见图5(a))。Alicyclobacillus是好氧、嗜酸的混养SOB[36-37]。Mycolicibacter是一种杆状的、兼性厌氧的、混合营养的微生物。它对低pH极为耐受,最佳生长温度为30~33 ℃[38]。Mycoliciberium是一种厌氧、快速生长的细菌[39],大多数物种是腐生性的,能够利用腐烂的有机物获得营养。极端的酸性条件起到了微生物过滤器的作用,不耐酸的微生物被淘汰了,而那些耐极端酸的微生物更容易被富集。高度同质化的微生物物种进一步减少了该时期生物膜中的微生物多样性(见图5(b))。 随着pH的下降,偏好中性至碱性环境的微生物会逐渐被更适应酸性环境的SOB替代。在碱性条件下丰富的反硝化菌(如Halomonas)以及异养菌(例如Brucella和Evansella)在此阶段被淘汰,从而导致生物多样性的减少。在此期间,如Stenotrophomonas等硫酸盐还原菌未被检测到,这是由于在弱酸性条件下生物膜中未形成厌氧环境所致。在酸性环境下,SOB的活性相对于在碱性条件下有所下降,同时H2S的气液传质阻力也增大。这些变化导致了SOB的耗氧量减少,有助于生物膜内氧气的有效传输,但不利于反硫化作用的进行。当pH进一步下降,生物膜中的微生物多样性进一步降低,不适应酸性环境的微生物被淘汰,而适应酸性环境的SOB-Mycobacterium取得了主导地位,微生物间的协同关系因此进一步简化。极酸性条件下的生物量不仅可以在较低水平上长期维持,同时可富集高丰度高活性的SOB,同物理或化学清洗生物膜的方法相比,本方法避免了冲洗后性能的恢复期,保障了脱硫系统的性能的稳定性,这为控制生物反应器内生物量提供了一种新方法。而且,这样的环境无须添加碱性试剂或频繁更新循环液来提高pH,从而节省了pH管理成本(包括用水量、化学试剂和基础设施的花费)并简化了操作步骤。在极酸性环境下实现高效H2S去除的策略包括使用大比表面积的填料,使得更多的H2S和O2分子能溶解到液相中,然后,在极酸性环境中经过长期驯化,逐步富集嗜酸型SOB的丰度。但是,这种方法的缺点是驯化出适应极酸性的微生物的过程需要较长时间,这不利于脱硫反应器的快速启动。此外,处理在极酸性操作过程中产生的酸性培养液是另一个待解决的问题,将其用于吸收碱性废气(如NH3)是一个潜在的应用。 1) BTF在中性偏碱性、弱酸性和极酸性条件下分别获得ECmax为246.5、142.8和164.6 g/(m3·h)。较低的H2S气液传质阻力及高活性的SOB导致BTF在中性偏碱性时期获得了最佳的脱硫性能,但同时消耗了大量的碱性试剂以维持pH,这增加了生物反应器的运行成本和操作步骤。 2) 在长期极酸性条件下,嗜酸性SOB-Mycobacterium(79.2%)逐渐占据主导地位,非耐酸的微生物被淘汰,这使得BTF维持了生物量的平衡(生物量质量浓度10~11 g/L),避免了微生物过度生长导致的BTF堵塞,节省了生物量和pH管理的成本,为控制脱硫系统内的生物量提供了新策略。 3) 通过富集高丰度的活性嗜酸SOB(Mycobacterium79.2%),可以使BTF在极酸性条件下获得高效的脱硫性能EC 164.6 g/(m3·h),从而减轻低pH对H2S去除的负面影响,扩大BTF运行的pH范围。1 材料与方法
1.1 试验装置与操作步骤
1.2 污泥接种与培养基
1.3 运行条件
1.4 计算和检测方法
2 结果与讨论
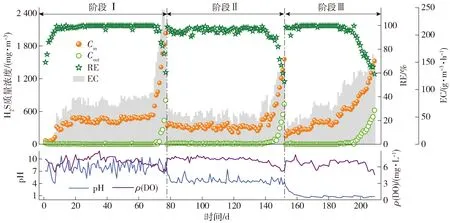
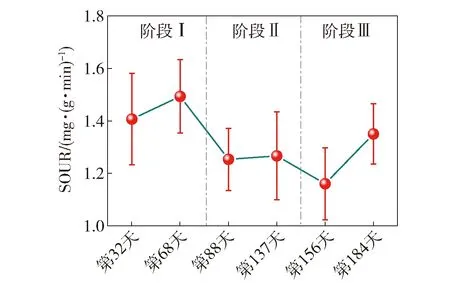
2.1 BTF系统在不同pH条件下的长期脱硫性能
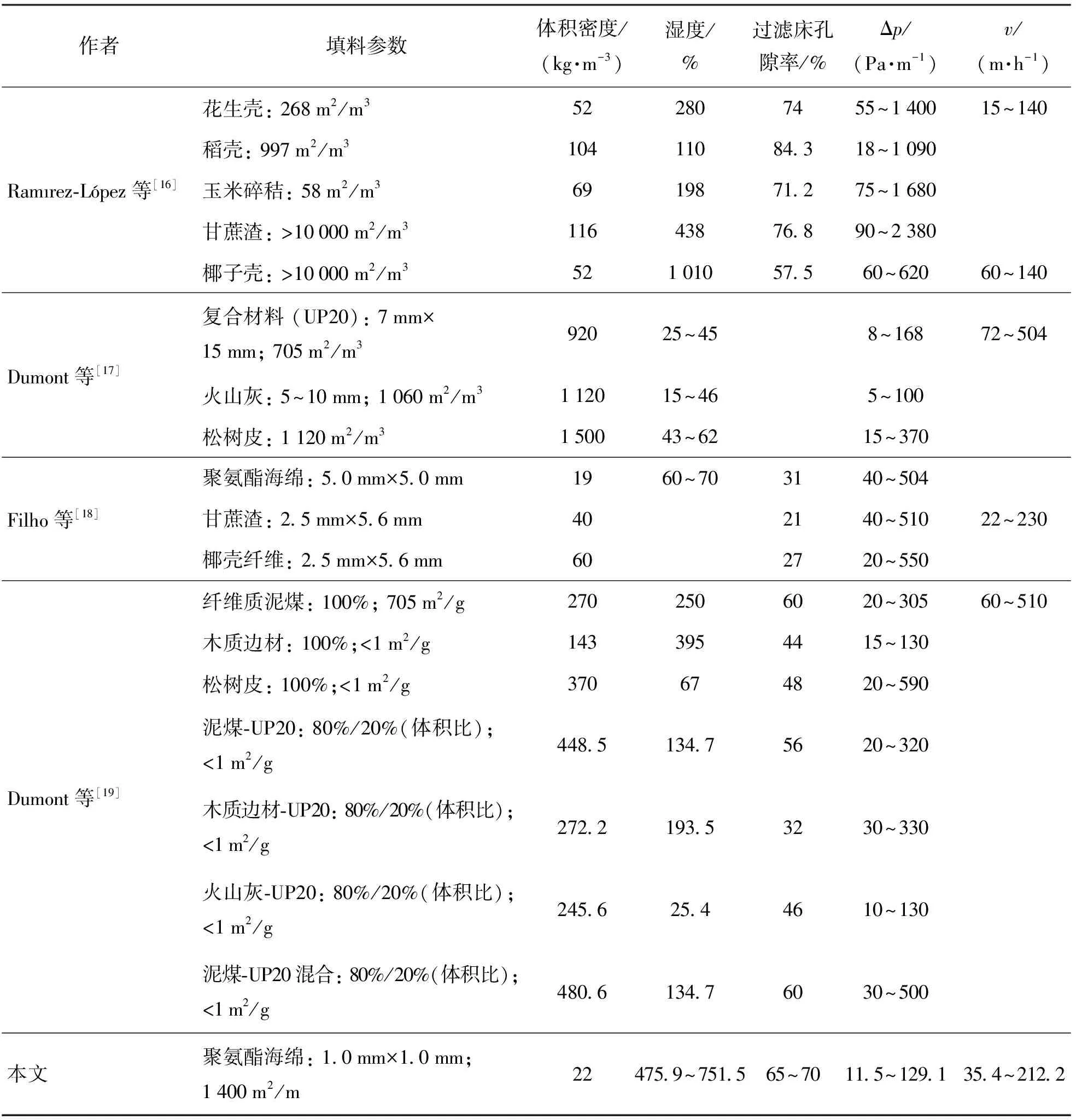
2.2 BTF系统内生物量质量浓度及压降的变化
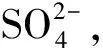

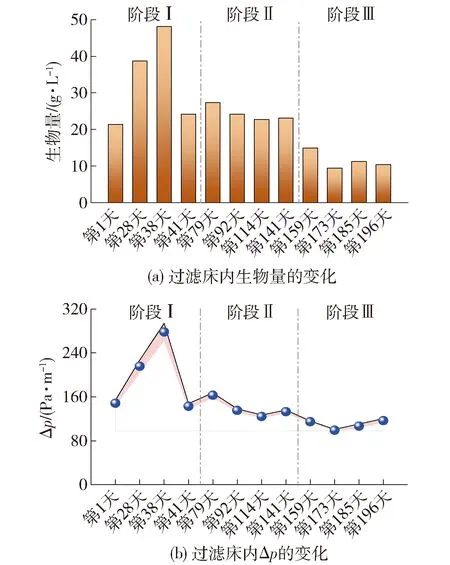
2.3 微生物群落结构和微生物多样性的变化
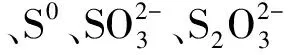
2.4 不同pH范围运行分析
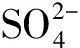
3 结论

