碳烟催化氧化热重分析及活化能计算★
郭丽红,杨喜平,白红娟,卢明霞,刘建平
(河南工业大学化学化工学院,河南 郑州 450001)
热分析是在程序控制温度条件下,测量物质的物理性质(质量、热焓、比热等)随温度变化的函数关系的技术,是科研表征中常见的手段,也是大学物理化学实验中的经典内容。许新华等[1]用改造后的DTA分析仪测定了KNO3-NaNO3二元熔盐体系的液固平衡相图,测定该熔盐组分在加热过程中经历固态晶相转变和固-液相转化。赵亚萍等[2]利用DTA 法测定步冷曲线,得到二元低共熔相变材料的固-液平衡相图。邹函君等[3]以煤为研究对象,分析煤快速热解的TG/DTA 曲线。
近年来,将热分析和动力学结合起来研究某些物理变化特别是化学反应的动力学是科学研究中的热门领域之一[4]。本实验在基础实验教学的基础上,将新颖的热分析动力学内容创新融合到实验教学体系中,根据热失重曲线对碳烟催化氧化过程进行表观动力学研究,计算反应的动力学参数(活化能和指前因子等)。实验设计与学科前沿相结合,有利于激发学生的科研热情,将所学理论知识融会贯通,提升学生的科研能力和创新能力。
1 实验背景
柴油机排放的碳烟颗粒被捕集在颗粒过滤器(Diesel Particulate Filters,DPFs)中,催化剂可使颗粒物在较低的温度下迅速起燃即可生成二氧化碳排出系统,减少对大气及人类健康造成的危害。反应方程式见式(1)。
本实验以LaFeO3钙钛矿氧化物催化剂,基于非等温热动力学方法探讨碳烟催化燃烧过程的活化能Ea、指前因子A 和反应机理函数f(α)这些重要的反应动力学参数,从而在模拟条件下系统分析碳烟颗粒的催化燃烧过程。
2 实验设计
2.1 催化剂的制备
依次等摩尔地称取La(NO3)3·6H2O、Fe(NO3)2·9H2O 溶于适量蒸馏水中,然后按照n(金属离子)∶n(柠檬酸)∶n(EDTA)=1∶2∶1 的比例称取柠檬酸和EDTA 加入上述溶液中,使其完全溶解。将溶液移至恒温加热磁力搅拌器中,在80 ℃下,剧烈搅拌蒸发至黄棕色凝胶状态。
将凝胶置于烘箱中干燥后,先在马弗炉中350 ℃焙烧4 h 以完全分解柠檬酸和EDTA,最后在700 ℃下煅烧4 h,得到催化剂样品LaFeO3。
2.2 碳烟燃烧实验
使用Degussa 公司生产的Printex-U 代替柴油车碳烟用于实验室研究[12]。热分析实验在日本日立STA7300 型热重-差热同步分析仪中进行的,条件如下:10%O2,N2平衡气,气体总流速100 mL/min,设置不同的升温速率使之程序升温到700 ℃。
2.3 热分析动力学理论基础
Friedman 等转化率法[5]避免选择具体的动力学模型,可用来研究复杂反应。对样品进行多个不同升温速率下的热重测试,得到的原始数据结合Arrhenius方程求解出不同转化程度下的活化能。
碳烟氧化是气-固-固三相反应,其动力学方程可以表示为式(1)~式(3):
式中:f(α)为反应机理函数,碳烟燃烧模型近似为一级反应动力学,因此式(1)可写为f(α)=1-α。Arrhenius方程[(式3)]中速率常数k 与温度密切相关,E 为活化能,A 为指前因子,T 为热力学温度,R 为气体常数。
在程序升温时,式(1)可以写为式(4)、式(5):
由此,可得到多相体系的常用动力学方程式式(6)、式(7):
式(7)表示在Ta(碳烟转化率a 对应的温度)时的Friedman 法公式。因此,在一定转化率a 下,Friedman等转化率方法以不同升温速率b 下作为因变量为因变量建立线性方程,斜率为,通过拟合的斜率和截距可以确定反应活化能等动力学参数。以转化率50%计算碳烟燃烧反应的活化能,可代表整个反应的平均反应活化能。
3 数据处理与结果
3.1 碳烟转化率的计算
实验导出原始数据为质量(m)随时间或温度的变化,需将其转化为转化率(α)随时间或温度的变化,计算公式如式(8)所示。
式中:m0为反应开始催化剂和碳烟的总质量;mt为反应过程中的催化剂和碳烟的总质量;me为反应结束剩余催化剂的质量。
在新高考模式下,更加注重学生的主体地位。而且地理学科是与生活紧密相关的,具有一定的实践性,为了将学习的主动权还给学生,使其能够运用地理理论知识解决实际问题,真正的提升自身地理能力,教师需要开展实践活动,尽可能多的为学生提供实践机会。与此同时,该活动的开还有利于激发学生的学习兴趣,使其真正喜欢上地理学科,进而积极主动的学习地理知识。
一般地,将α 为10%、50%、90%时对应的温度定义为T10、T50、T90,Tmax定义为碳烟最大燃烧速率对应的温度。上述特征温度越低,催化剂的活性越好。表1 中列出了催化剂在不同升温速率下催化碳烟燃烧活性。随着升温速率提高,碳烟内部因为温度不够、反应时间少而氧化缓慢,表现出热滞后现象,导致指标温度向高温方向偏移。文献[6]报道无催化剂时碳烟的T50在572 ℃,T90在612 ℃,Tmax在591 ℃。相较而言,加入催化剂后T50、T90、Tmax下降均超过100 ℃,说明加入催化剂大大加快了碳烟燃烧过程。

表1 催化剂的碳烟燃烧活性
3.2 活化能的计算
一般转化率α=50%下的活化能值Ea可近似看成碳烟氧化的平均活化能[5]。对不同升温速率条件下碳烟在催化剂上的热重原始数据进行处理,所得参数如表2 所示。
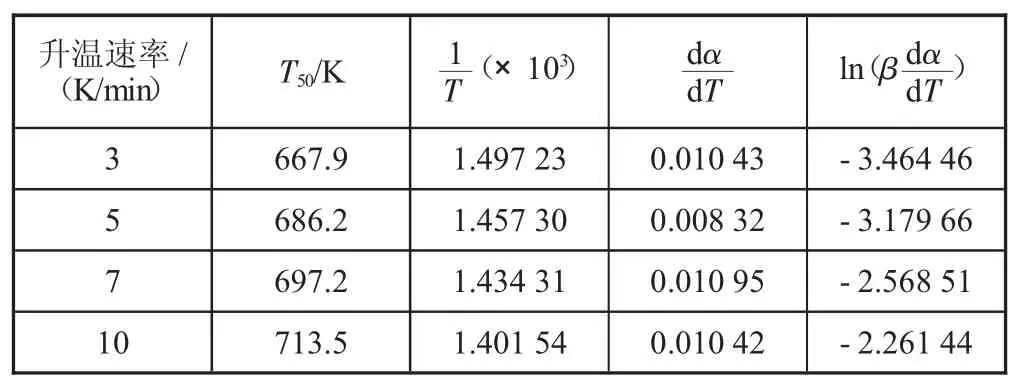
表2 不同升温速率下热重数据的处理
上述数据线性拟合结果:y=-13.29x+16.37。
求得:活化能Ea=110.5 kJ/mol,指前因子A=2.59×107s-1。
活化能Ea值越小,反应发生需要越过的能垒就越低,催化效果越好。纯碳烟发生非催化燃烧反应的Ea值在170~200 kJ/mol-1之间波动[6],本实验结果显示,在LaFeO3催化剂作用下的碳烟氧化的活化能为110.5 kJ/mol,明显降低了反应的活化能。
4 教学过程设计
以往热分析实验内容单一,缺乏系统性,本实验将其应用范围进一步拓展和深入,内容包括催化剂制备(LaFeO3钙钛矿)、碳烟氧化热重实验操作以及数据处理和动力学分析(活化能的计算)等,适合作为化学化工专业高年级综合实验项目。
本实验在课前设置预习题目要求学生以小组合作的方式预习教材和相关文献,并在课堂上由教师抽选小组代表进行汇报以了解学生的预习情况。问题设置样例如下:
1)溶胶凝胶法中柠檬酸的作用是什么?焙烧过程中依次发生的化学反应有哪些?
2)催化剂和碳烟的接触方式对碳烟燃烧活性有没有影响?
3)碳烟燃烧热重曲线中的失重阶段分为几个阶段?怎么将原始质量数据处理为转化率数据?
4)怎样设置热重仪器的操作参数,包括气流、升温速率等?
本实验操对催化剂的制备和热重仪器操作有较高要求:催化剂的制备过程包含前驱体合成、干燥、焙烧等步骤;热重实验的操作包括催化剂和碳烟的混合、装样、参数设置、实验数据的导出和处理等。以4~6 人小组为单位,要求学生对上述每一阶段进行拍照和数据记录。实验结束后,小组代表在课堂上进行汇报,以作为操作评价的依据。
课后要求学生以小组讨论形式思考回答以下问题:
1)碳烟燃烧常用的催化剂还有哪些类型?如何制备?
2)该实验的理论处理方法为Friedman 等转化率法,其他通过热重或差热分析曲线计算活化能的方法有哪些?
5 结语
本实验通过对碳烟催化燃烧过程的热重表征,反应动力学分析直观地体现出催化剂降低反应活化能的本质,有助于加深学生对催化过程化学本质的理解。经由实验训练可帮助学生掌握以下内容:碳烟消除方法和反应过程;热分析动力学(Friedman 等转化率法)的基本原理;热重表征仪器的原理和操作;Origin 处理复杂数据和绘制图形。总的来说,本实验以当下催化技术在环境治理过程中的应用为引导,介绍物理化学理论知识的实际应用场景,涉及材料、催化、仪器分析等多学科多专业的复合性内容,有助于激发学生科学探究的兴趣,培养学生解决具体问题的科学实践能力。

