植物源抗真菌肽原材料的筛选及桂皮抗菌肽提取工艺的优化
王虹霁,赵展展,李梦圆,张超文,王敬仪,韩玉竹,2
1. 西南大学 动物科学技术学院,重庆 荣昌 402460;2. 西南大学 医学院免疫学中心,重庆 荣昌 402460
粮食作物的霉菌污染以及由其引发的腐败变质, 为粮食的储存、 生产和销售带来了极大的困扰[1]. 据美国农业部估计, 世界上25%的粮食作物在生长或贮藏期间会受到霉菌污染, 造成巨额的经济损失[2]; 且霉变的粮食含有多种毒素, 对畜禽的养殖产生了巨大危害[3-4]. 目前市场上用于防霉的制剂主要为化学药剂, 常用的有丙酸及丙酸盐类、 甲酸、 乙酸及乙酸盐类等[5]. 近年来, 化学制剂在饲料加工及后续生产链中引发的安全问题日益受到食品加工等行业的关注, 特别是药物在畜产品中的残留和药物对人体的危害等问题, 由此引发了人们对更安全、 更健康的食品防霉剂应用的思考[6].
植物中含有许多具有活性的抗菌物质, 包括为我们所熟知的黄酮类、 有机酸类、 生物碱类、 甾体皂苷类等, 不同的抗菌物质对细菌、 真菌具有不同的抗菌效果和作用机制[7]. 目前对植物源抗菌物的研究主要集中在药用植物中, 对具体化学物质功能的研究主要集中在医药方面, 但应用还存在诸多限制[8]. 作为广泛存在于动植物体内的小肽类物质, 部分抗菌肽以稳定的特性展现出更好的杀菌效果[9, 10]. 相对于传统的抗生素而言, 植物源抗菌肽(AMPs)具有广谱、 高效的抗细菌、 抗真菌活性, 且不易产生耐药性. 此外, 抗菌肽使用时绿色无污染, 可广泛用于食物保存[11]、 植物病害防治[12-13]等方面, 具有广阔的应用前景. 桂皮指樟科植物的皮, 含有多种抗炎症、 抗肿瘤、 抗血栓以及抗菌的活性成分, 比如桂皮醛、 香豆素和异硫氰酸酯等[14]. 目前对于桂皮中挥发性物质的关注较多, 而桂皮中抗菌肽的研究还未有报道. 硫酸铵沉淀法可破坏蛋白质表面的疏水结构, 使蛋白质沉淀且不会破坏其活性, 该方法可从植物浸提液中有效提取抗菌肽, 因此, 此技术的优化对桂皮抗菌肽的提取得率和活性具有重要意义.
目前国内外关于植物源抗菌肽的研究主要集中在中药材方面[15-16], 其分布及抑菌效果差异分析研究较少. 本文将探究AMPs在53种价廉易得、 有潜在抑菌特性的植物材料中的分布情况, 以粮食和油料作物中常见腐败菌黑曲霉和黄曲霉为指示菌, 根据抗菌肽的抑菌圈大小, 对不同植物中提取的抗菌肽的抗菌效果和含量进行分析, 筛选出抑菌效果较好的植物源. 在前期实验的基础上, 对具有抗菌肽开发潜力的桂皮的抗菌肽提取工艺进行优化, 以期为进一步在食品安全中的应用提供数据借鉴. 研究植物源抗菌肽的分布和提取工艺, 可以扩大粮食作物生物防霉剂、 饲料安全添加剂的来源, 同时为AMPs的研究提供一定的实验方法及理论参考.
1 材料与方法
1.1 材料与试剂
硫酸铵, 重庆北碚化学试剂厂; PBS, PDA培养基, 上海博微生物科技有限公司; 黄曲霉和黑曲霉, 西南大学牧草微生物实验室.
经查阅资料, 梳理出了21个科共53种价廉易得、 耐储存、 可能会含有植物源抗菌肽的原材料(表1). 除了部分材料直接从西南大学牧草基地获得, 其余植物材料均购于京东商场.
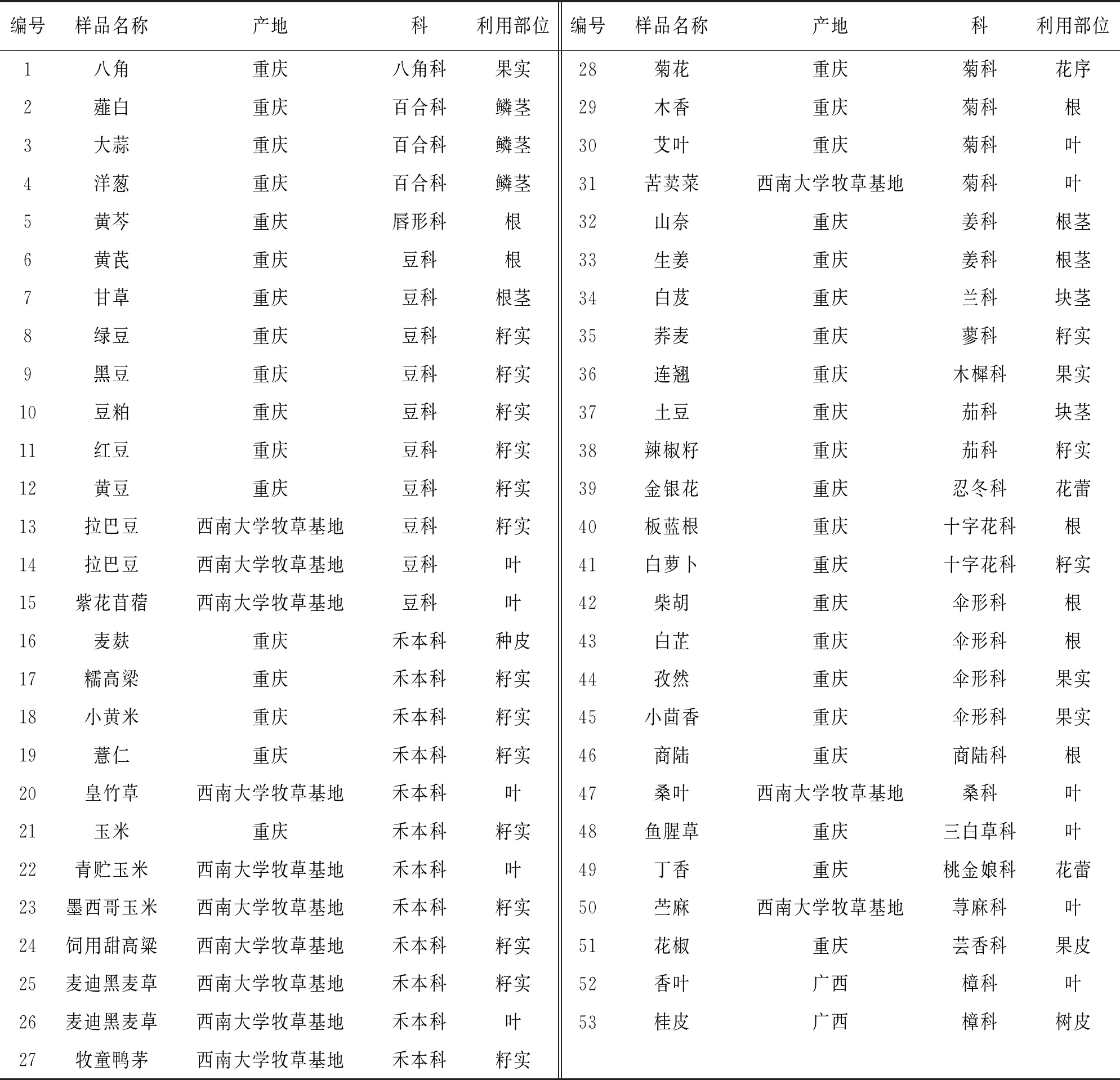
表1 植物材料
1.2 仪器和设备
漩涡振荡器, IKA广州仪科实验室技术有限公司; 定时恒温磁力搅拌器, 上海沪西分析仪器厂; THZ-C型空气恒温振动器, 江苏太仓市实验设备厂; LRH生化培养箱, 上海一恒科学仪器有限公司; 牛津杯, 北京先驱威峰技术开发公司; 冷冻干燥机, 松源华兴有限公司.
1.3 实验方法
1.3.1 抗菌肽的提取
将所选材料在65 ℃下烘干至恒质量后, 用半自动粉碎机粉碎后过20目筛, 并用储物袋保存. 采用硫酸铵沉淀法提取植物源抗菌物[17-18], 使用PBS缓冲液(pH值为7.6, 0.02 mol/L) 200 mL进行浸提. 加50 g磨碎的样品, 4 ℃中浸泡12 h, 搅拌匀浆, 纱布过滤后, 在4 ℃, 2 000 r/min离心20 min. 上清液中缓慢添加硫酸铵, 使其饱和度达到80%, 磁力搅拌30 min后于4 ℃静置4 h, 之后在4 ℃, 10 000 r/min离心20 min, 沉淀即为抗菌肽粗提物. 将沉淀冷冻干燥后, 放入干燥器备用. 使用时, 向每种粗提物中加25 mL无菌水, 混匀制成抗菌肽溶液, 经10 KDa超滤管超滤后, 供抑菌实验检测用.
1.3.2 优化提取工艺
按照筛选实验选择优化材料和指示菌, 分别从浸提液种类、 料液比、 浸提时间和硫酸铵饱和度等方面进行优化. 采用单因素实验法, 每个处理均设6个重复.
1.3.2.1 浸提液种类对抗菌粗提物的影响
浸提时分别使用Tris-HCl缓冲液(pH值为7.6, 0.02 mol/L), PBS缓冲液(pH值为7.6, 0.02 mol/L)、 EDTA缓冲液(10 mmol/L Na2HPO4, 15 mmol/L NaH2PO4, 100 mmol/L KCl, 1.5% EDTA), 丙酮以及无菌水. 3种盐溶液浸提性质较为温和, 丙酮具有良好溶剂效果且挥发性较强.
1.3.2.2 料液比对抗菌粗提物的影响
基于前一实验条件, 设置料液比分别为1∶3, 1∶5, 1∶7, 1∶9.
1.3.2.3 浸提时间对抗菌粗提物的影响
基于前一实验条件, 设置浸提时长分别为4 h, 8 h, 12 h, 16 h, 24 h, 36 h, 48 h.
1.3.2.4 硫酸铵饱和度对抗菌粗提物的影响
基于前一实验条件, 设置硫酸铵饱和度分别为50%, 60%, 70%, 80%, 90%.
1.3.2.5 响应面优化
经过单因素实验数据对比, 选取料液比、 浸提时间、 硫酸铵饱和度为自变量, 抑菌圈直径为响应值, 采用Box-Behnken设计方法, 设计3因素3水平的Box-Behnken中心组合实验(表2), 并对实验结果进行验证.
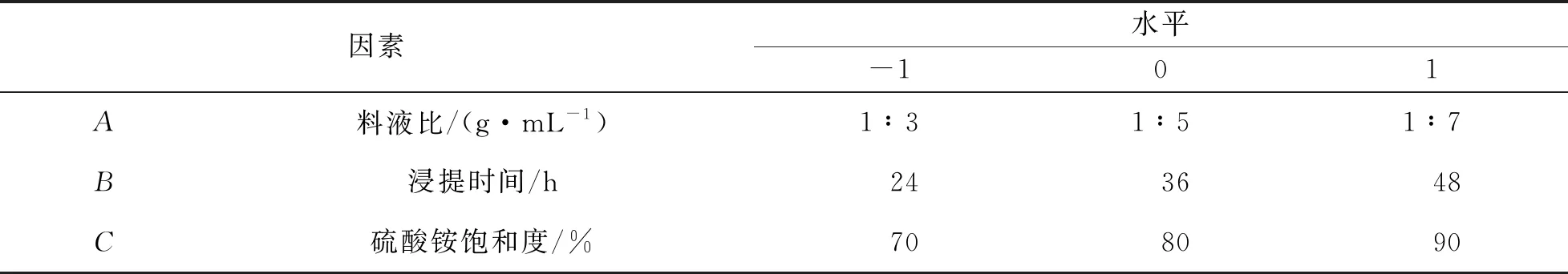
表2 响应面实验因素水平
1.3.3 分析方法
筛选实验和优化实验均采用牛津杯双层琼脂平板扩散抑菌圈法测定提取物的抑菌效果, 用游标卡尺测量抑菌圈直径. 筛选实验以黄曲霉和黑曲霉为指示菌, 优化实验以黄曲霉为指示菌. 将保存的纯种霉菌活化, 28 ℃培养7 d, 加入灭菌水后刮取孢子, 配制成浓度为1×106个/mL的孢子悬浮液. 吸取10 mL孢子悬浮液至装有冷却到45 ℃的200 mL PDA培养基的无菌瓶中, 充分混匀孢子液和培养基, 然后倒20 mL至培养皿(直径为90 mm)中, 制成含菌平板. 在灭菌的牛津杯里加入100 μL抗菌粗提物水解液, 做好标记, 密封好后在4 ℃的冰箱中浸润12 h, 以促使抗菌物有效浸入培养基内, 而后转置28 ℃恒温培养, 48 h后用游标卡尺测量抑菌圈直径, 设空白加无菌水为对照, 每个处理重复测6次, 结果取平均值.
2 结果与分析
2.1 植物源抗菌肽(AMPs)原材料的筛选
本实验对21个科共53种材料进行AMPs的提取, 并对其抑菌效果进行比较, 结果表明, 在53种实验材料中共有40种表现出抑菌活性, 占比为75.47%(表3). 不同植物之间, 籽实、 根、 根茎、 鳞茎及块茎含抗菌肽的比例为86.11%, 明显高于含抗菌肽比例为50%的花蕾、 花序、 叶片及茎叶. 相同植物不同部位之间, 如拉巴豆、 黑麦草、 玉米的籽实都表现出抑菌效果, 而茎叶无抑菌效果.
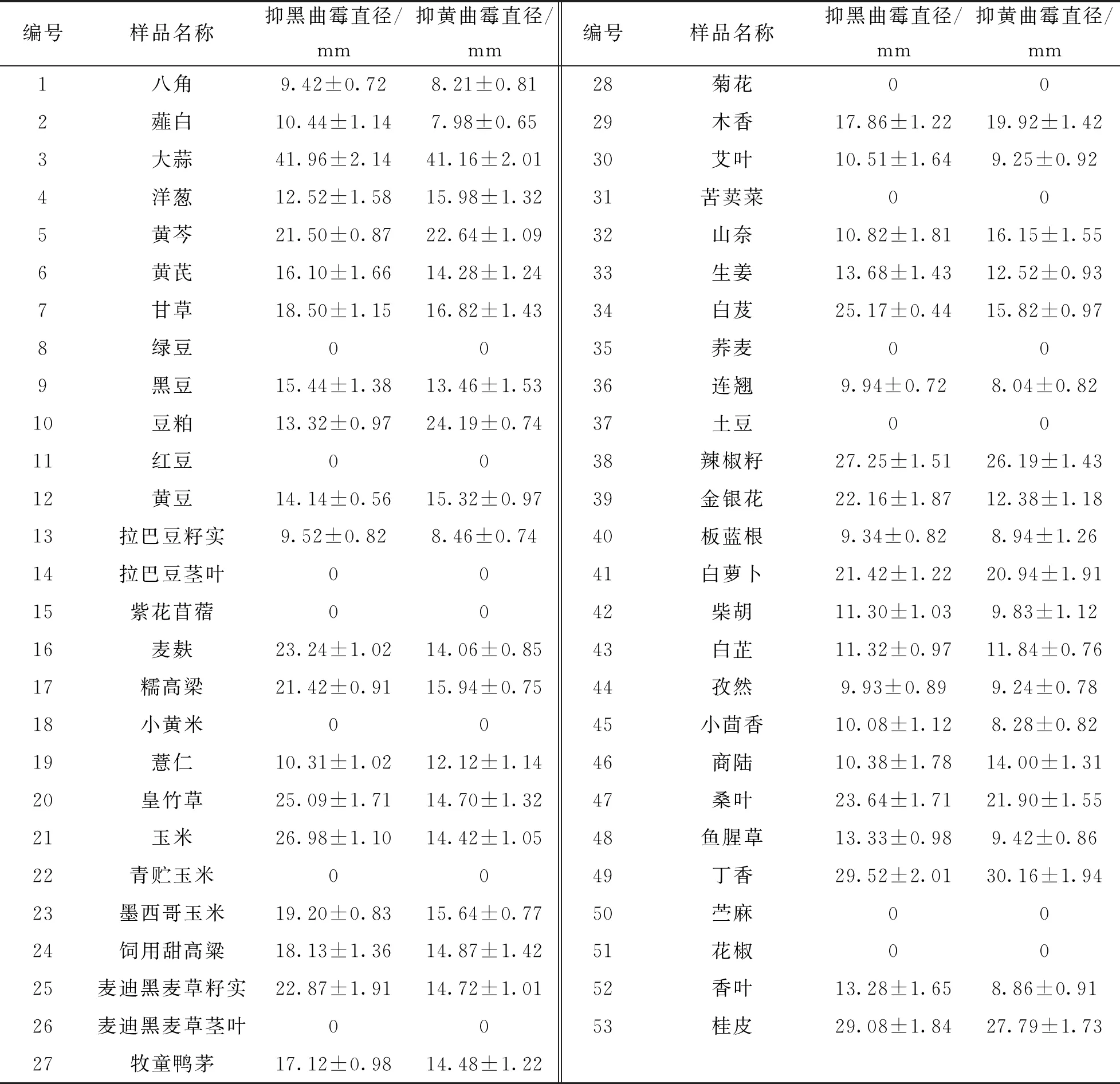
表3 53种植物源抗菌肽的抑菌圈大小
在40种有抗菌效果的材料中, 同时抑制黄曲霉和黑曲霉的抑菌圈直径达到15 mm以上的材料共有12种, 其中大蒜(3)、 辣椒籽(38)、 丁香(49)和桂皮(53)的抑菌效果尤为突出, 抑制黄曲霉和黑曲霉的直径均在25 mm以上, 大蒜对两种菌的抑菌圈直径均达到了41 mm, 其次为丁香、 桂皮、 辣椒籽. 只对黑曲霉的抑菌圈达到15 mm及其以上的材料共有9种, 只对黄曲霉的抑菌圈达到15 mm及其以上的材料共有4种.
结合抗菌肽研究现状, 同时考虑实验效果、 取材的方便性和价格等多种因素, 最终选择桂皮为材料, 对其抗菌肽的提取工艺进行优化.
2.2 浸提液种类对抗菌肽提取效果的影响
浸提液不仅影响抗菌肽提取的数量和效率, 而且关系到提取成本的高低, 对实验研究和批次生产都起着重要的作用. 由图1可知, 5种浸提液均能提出抗菌肽, 但浸提液丙酮和PBS的浸提物抑菌效果显著高于其余3种浸提液(p<0.05), PBS浸提的抑菌圈最大, 直径达到了27.41 mm. 无菌水的浸提物抑菌效果显著低于其余4种浸提液(p<0.05), 抑菌圈直径只有23.41 mm, 表明浸提液的种类对于浸提物抑菌效果的影响显著. 虽然PBS和丙酮的浸提物抑菌效果之间差异无统计学意义(p>0.05), 但与丙酮相比, PBS价格更低廉且无毒, 所以优化实验中选择PBS作为浸提液.
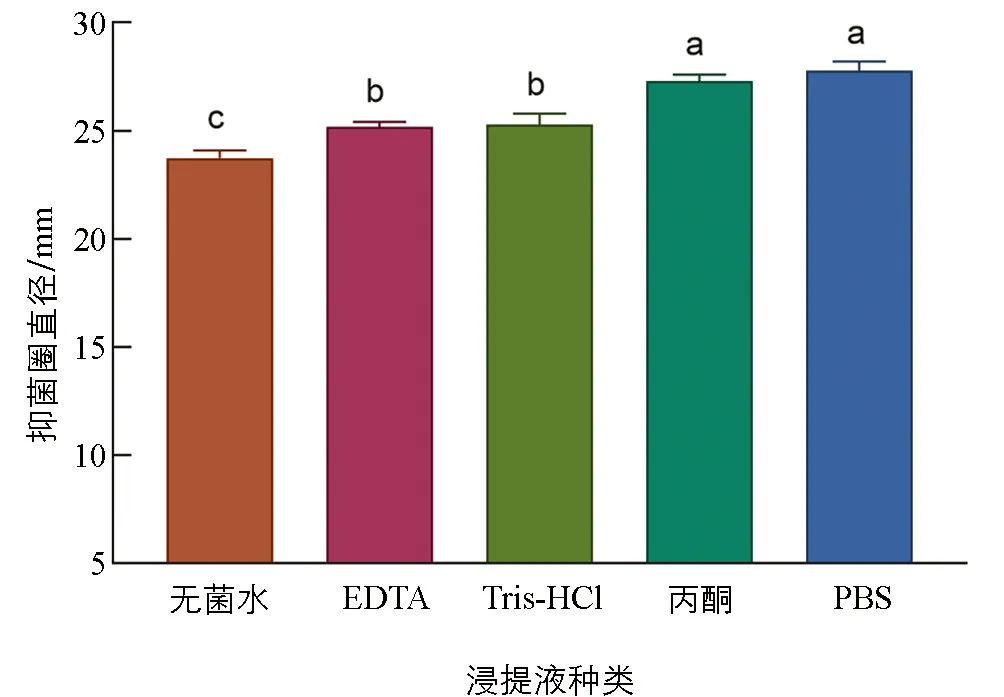
小写字母不同表示p<0.05, 差异有统计学意义.图1 不同浸提液对桂皮抗菌肽提取效果的影响
2.3 料液比对抗菌肽提取效果的影响
料液比会影响抗菌肽的提取效率和效果, 影响所获得的蛋白沉淀物的数量, 与整个实验的操作效率和复杂程度有关, 恰当的料液比可降低成本, 提高提取方法的可操作性. 由图2可知, 料液比为1∶5和1∶7的抑菌效果显著高于其余两组(p<0.05), 料液比为1∶3的抑菌效果最差, 料液比1∶5之后抑菌效果发生回落. 虽然料液比为1∶5和1∶7的抑菌效果之间差异无统计学意义(p>0.05), 但料液比为1∶5的抑菌效果更好, 因此后续优化实验选用料液比为1∶5.
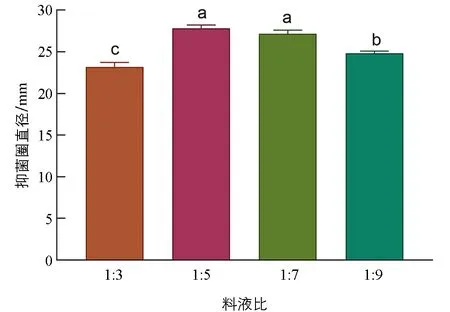
小写字母不同表示p<0.05, 差异有统计学意义.图2 不同料液比对桂皮抗菌肽提取效果的影响
2.4 浸提时间对抗菌肽提取效果的影响
合适的浸提时间才能保证抗菌肽从原材料中充分释放. 由图3可知, 浸提36 h和48 h的抑菌效果显著高于其余5个处理(p<0.05), 4 h, 8 h, 12 h, 16 h, 24 h的抑菌效果间差异无统计学意义(p>0.05). 浸提36 h和浸提48 h二者的抑菌效果差异无统计学意义(p>0.05), 为了提高浸提效率, 在后续优化实验中浸提时间选用36 h.
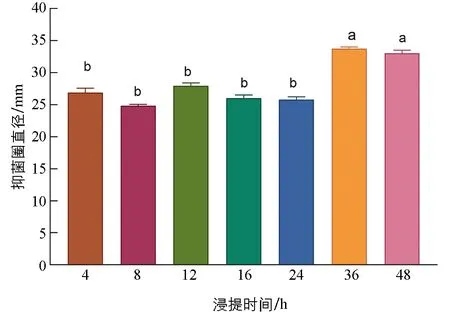
小写字母不同表示p<0.05, 差异有统计学意义.图3 不同浸提时间对桂皮抗菌肽提取效果的影响
2.5 硫酸铵饱和度对抗菌肽提取效果的影响
由图4可知, 不同饱和度的硫酸铵对桂皮抗菌肽的抑菌效果影响明显. 饱和度为80%和90%的抑菌效果显著高于其余3个处理(p<0.05), 饱和度为50%和60%之间差异无统计学意义(p>0.05), 效果低于其余3个处理. 饱和度为80%和90%之间的抑菌效果差异无统计学意义, 但考虑成本和降低物耗以及环境污染, 认为80%的硫酸铵饱和度更适合于植物源抗菌肽的提取.
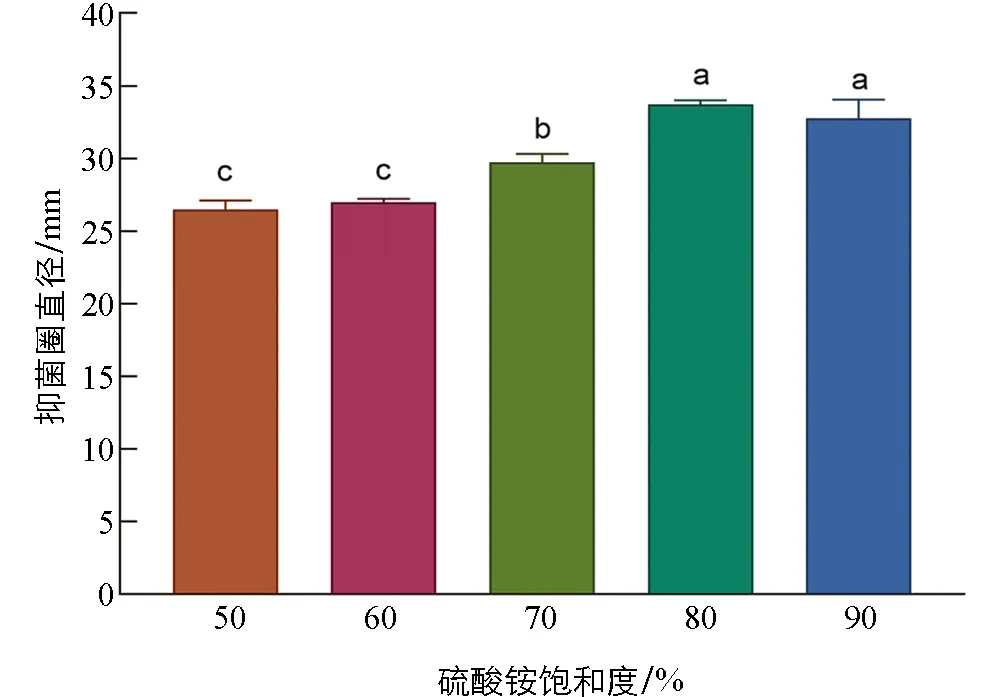
小写字母不同表示p<0.05, 差异有统计学意义.图4 不同饱和度对桂皮抗菌肽提取效果的影响
2.6 桂皮抗菌肽提取响应面优化分析
2.6.1 响应面回归模型建立及结果分析
响应面实验设计和结果如表4, 获得桂皮抗菌肽的抑菌圈直径(Y)对料液比(A)、 浸提时间(B)、 硫酸铵饱和度(C)的多元回归方程:
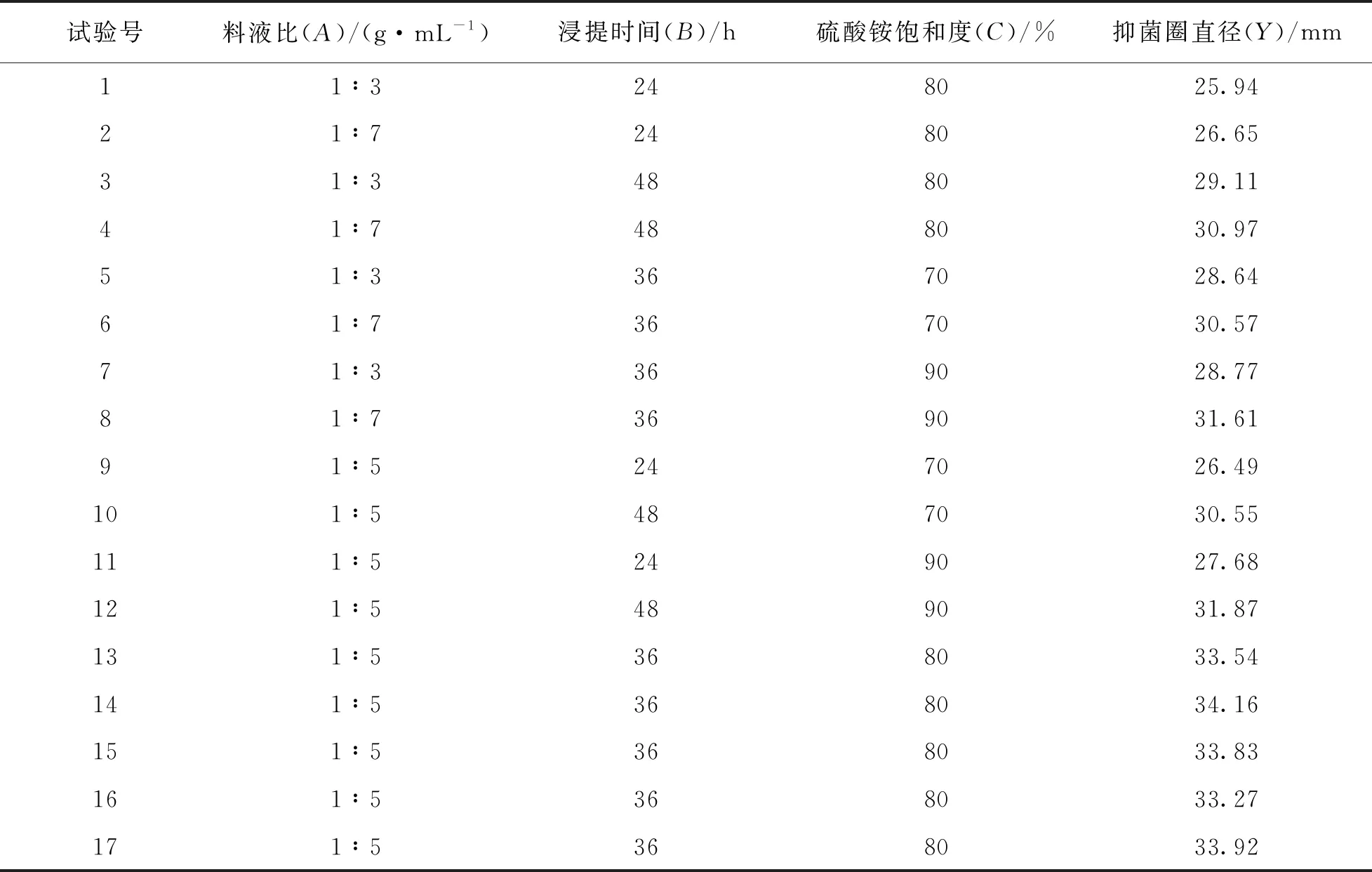
表4 中心组合实验设计及结果
Y=33.74+0.92A+1.97B+0.46C+0.29AB+0.23AC+0.032BC-2.41A2-3.16B2-1.43C2
通过Design Expert 8.0.6.1软件分析(图5), 桂皮抗菌肽最佳提取条件为料液比1∶5.11 g/mL, 浸提时间39.29 h, 硫酸铵饱和度81.74%, 在此条件下抗菌肽的抑菌圈直径为34.20 mm.
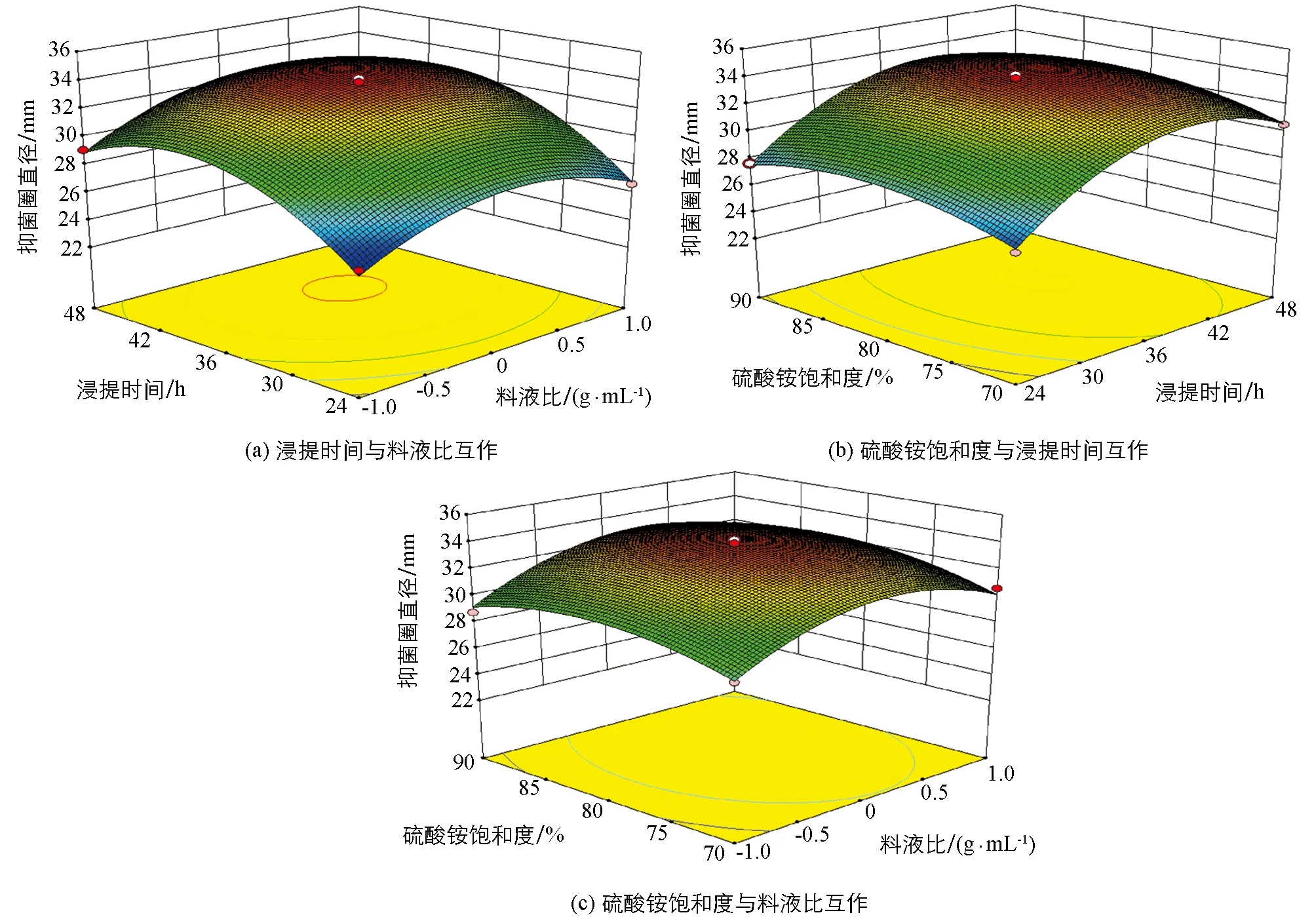
图5 各因素互作对桂皮抗菌肽抑菌圈直径的影响
2.6.2 回归模型验证
根据响应面的最优条件进行验证, 重复6次, 桂皮抗菌肽的抑菌圈直径平均值为33.74 mm, 与预测值拟合率为98.65%, 优化模型可靠. 优化后抗菌肽活性比优化前(27.79 mm)提高了21.41%, 表明此优化方案合理, 可提高桂皮抗菌肽的获得率.
3 讨论与结论
植物源抗菌肽被认为是一种有希望的、 绿色安全的生物防霉剂, 在食品、 医药、 畜牧方面有巨大的发展潜能. 本研究选择的53种实验材料中, 含有抗菌肽的植物占被测总数的75.47%, 而Srinivasan等[19]研究了50种药用植物, 其中有抗菌活性的植物占72%. 本研究优先选择了利用广泛、 具有消炎作用的植物材料, 这些植物材料可能含有抑制霉菌的抗菌肽, 因此比例接近. 相同植物材料之间, 种子和茎叶的抗菌肽含量不同, 例如麦迪黑麦草、 拉巴豆、 玉米种子中均能提取出抗菌肽, 而茎叶粗提物则无抗菌活性, 因此推测抗菌肽主要分布在籽实及根茎部位, 53种植物材料中籽实及根茎所含抗菌肽的比例高达86.11%也可以证明此结论. 根据抑菌圈的大小, 筛选出大蒜、 丁香、 桂皮、 辣椒籽对黑曲霉和黄曲霉抑菌效果最好. 此外黄芪、 甘草、 豆粕、 麦麸、 黑豆、 木香、 白芨、 金银花、 黄芩、 洋葱、 饲用甜高粱等多种植物提取的抗菌肽都有较好的抑制霉菌的作用. 目前除了辣椒籽、 黑豆等少数材料[17,20]研究过抗菌肽的抑菌活性, 其余材料的抑菌研究主要集中于黄酮类[21]、 有机酸[22]、 内生菌[23]等方面, 鲜有关于其抗菌肽的相关研究. 另外, 本研究还首次发现糯高粱、 皇竹草植物组织中含有抗菌物质——抗菌肽, 且对黄曲霉或黑曲霉有较好的抑菌效果.
桂皮是天竺桂、 阴香、 细叶香桂或川桂等树皮的通称, 桂皮中的活性物质——桂皮醛和桂皮醇也对多种细菌、 真菌有抑菌效果[14,24], 但目前还没有关于桂皮抗菌肽的报道. 本实验提取抗菌肽时, 首先对桂皮进行了烘干处理, 在此过程中可去除桂皮中的桂皮醛和桂皮醇等挥发性抑菌物质. PBS萃取和硫酸铵沉淀法是经典也是目前广泛采用的分离和提取抗菌肽的方法[25-26], 经10 KDa超滤管超滤后, 可去掉具有抗菌效果的酶类等蛋白, 得到小分子量的抗菌肽. 采用此法得到的桂皮抗菌肽对黑曲霉和黄曲霉均具有较好的抑菌效果, 抑菌圈直径分别为29.08 mm和27.79 mm, 经提取工艺优化后, 抑制黄曲霉的效果提升了21.41%, 达到33.74 mm, 结果可对下一步桂皮抗菌肽的结构解析、 抑菌机理、 开发应用提供数据参考.
综上, 植物源抗菌肽是一种绿色安全的生物资源, 广泛分布于植物籽实及根茎部位. 合理利用植物源抗真菌肽, 可减少粮食作物的霉菌污染. 对这些AMPs资源的挖掘, 可为扩大生物防霉剂和饲料添加剂来源提供思路.

