重度哮喘动物模型构建的研究进展
魏丹丹汪丽婷龙 洁陈艳焦王 宇杨永清徐玉东*
(1.上海中医药大学附属岳阳中西医结合医院,上海 201203;2.上海市针灸经络研究所,上海 200030)
支气管哮喘是一种以慢性气道炎症为主要病理特征的复杂、异质性疾病,临床表现为发作性咳嗽、气促、胸闷,以及伴有哮鸣音的呼气性呼吸困难。重度哮喘(severe asthma,SA)在确诊哮喘和控制合并症的基础上,需要使用大剂量吸入性皮质类固醇激素(corticosteroids,CS),并联合控制药物(如长效β2 受体激动剂、白三烯调节剂或茶碱),且/或过去1 年中有≥50%的时间需使用全身性CS 控制,或者采用以上治疗症状仍不可控。与轻中度哮喘患者相比,SA 患者诱导痰中嗜酸性粒细胞、中性粒细胞等炎症细胞数量升高更为明显,气道重塑病理变化更加显著[1]。SA 虽然只占全部哮喘人数的5%~10%,却是哮喘致残、致死的主要原因[2]。SA的发病机制和治疗靶点成为目前哮喘研究的热点之一。
建立一种稳定、可复制、便捷,并且能够重现人类SA 临床表型和主要病理特征的实验动物模型,对于研究SA 的发病机制、药物治疗和预防具有重要意义。本文以“重症哮喘/重度哮喘/难治性哮喘/激素抵抗型哮喘/激素不敏感型哮喘”为关键词,检索中国知网、万方、PubMed 等文献数据库收录的近十年来国内外已发表动物实验类研究,将从动物选择、模型制备方法、病理表型等方面对最近十年来SA 模型的构建方法与特点进行总结和分析,为基于SA 动物模型开展的相关基础研究提供参考依据。
1 重度哮喘模型常用实验动物
目前SA 模型常用实验动物既有小鼠、大鼠[3]、豚鼠[4]、兔等,也有研究使用大型动物马进行建模。对近十年的SA 动物模型文献中动物种属进行统计,数据显示小鼠使用率高达90%,说明小鼠是SA研究最常用的实验动物。小鼠容易诱发气道炎症、气道高反应性(airway hyperreactivity,AHR)、气道黏液高分泌等病理变化,因此更适合用于构建哮喘模型。其中,尤以BALB/c 品系小鼠最常使用,更容易诱发出明显的气道炎症和AHR,其造模成功率较高[5],其次为C57BL/6(包括C57BL/6J 和C57BL/6 N)、A/J 品系,其中A/J 小鼠易感哮喘,而且对致敏剂的反应也很强。
由于小鼠的生长发育较快,在4~6 周时身体各个器官已逐渐成熟,6~8 周即可达到性成熟,所以一般实验研究选择正值青壮年的6~8 周小鼠。根据实验目的不同也可选择不同周龄的小鼠,有研究者利用10~14 周龄小鼠构建SA 模型,探索SA 的慢性高炎症负荷对恐惧行为和大脑神经免疫通路的影响[6]。此外,有研究使用屋尘螨(house dust mite,HDM)诱导BALB/c 小鼠构建过敏性哮喘模型,发现雌性小鼠支气管肺泡灌洗液(bronchoalveolar lavage fluid,BALF)中嗜酸性粒细胞、中性粒细胞和巨噬细胞的数量以及血清HDM 特异性IgE 水平均显著高于雄性小鼠,但在C57BL/6NJ 小鼠BALF中,雄性小鼠嗜酸性粒细胞的积累高于雌性小鼠;不仅如此,不同性别、品系的小鼠哮喘模型肺细胞因子表达也存在差异,比如雌性BALB/c 小鼠相较于雄鼠更趋向于Th17 细胞免疫反应,IL-17A 表达水平更高,而C57BL/6NJ 雌性小鼠哮喘模型的肺中Th1 细胞因子变化更为明显[7]。
2 重度哮喘模型的制备方法
2.1 过敏原的选择
用于制备SA 动物模型的过敏原主要可分为以下几类:(1)环境过敏原:包括HDM、蟑螂提取物(cockroach, CRA)、二氧化氮(NO2)等;(2)病原体过敏原:包括转录腺病毒[8]、流感病毒H3N2[9]、衣原体、 流 感 嗜 血 杆 菌[10]、 呼 吸 道 合 胞 病 毒(respiratory syncytial virus,RSV)等;(3)化合物过敏原:包括卵清蛋白(ovalbumin,OVA)、三硝基苯(trinitro phenyl, TNP)[11]、 对 甲 苯 二 异 氰 酸 酯(toluene diisocyanate,TDI)[12]等。对近十年来SA模型文献进行统计,结果显示,约51%的研究选用OVA 作为造模的过敏原、约42%的研究选用HDM作为造模的过敏原。目前,最常用的过敏原是OVA和HDM,其中,OVA 是动物哮喘模型应用最广泛的经典过敏原。HDM 是哮喘患者中最易接触到的环境过敏原之一,临床哮喘患者对其过敏率高达85%,使用HDM 诱导SA 模型可以更好地模拟人类哮喘的发生过程。
2.1.1 单一过敏原造模
指只使用一种过敏原制备SA 动物模型的造模方法。有研究者认为白介素IL-13(interleukin,IL-13)主要介导哮喘炎症反应,使用含有小鼠IL-13 基因的腺病毒颗粒作为单一过敏原,发现能够诱导出具有气道炎症、AHR 和粘液分泌、中性粒细胞增多、类固醇激素抵抗(steroids-resistant)等特征的动物模型[8]。此外,化合物TDI 常用于制造泡沫塑料及橡胶、绝缘漆等,是职业哮喘发病常见过敏原。有研究者发现获得职业哮喘的患者通常对CS 治疗反应差,因此将TDI 作为单一过敏原进行小鼠致敏发现能够显著诱发产生Th2 和Th17 反应以及激素抵抗[12]。
2.1.2 复合过敏原造模
指使用两种及两种以上过敏原制备SA 动物模型的造模方法。复合过敏原多以OVA 和/或HDM联合其他过敏原,如OVA+NO2[13]、HDM+流感病毒H3N2[9]、OVA+衣原体、流感嗜血杆菌[10]、OVA+TNP[11]、OVA+HDM+CRA[14]等。有研究者通过OVA 联合衣原体、流感嗜血杆菌诱导小鼠发现,感染病菌能够抑制嗜酸性粒细胞,但不能抑制AHR,BALF 中性粒细胞有明显升高,使用CS 治疗后气道炎症和AHR 未改善,提示使用病菌复合过敏原可以诱导类固醇激素抵抗性哮喘(steroids-resistant asthma)模型[10]。除病菌以外,常用的OVA 和HDM也可以联合使用作为复合过敏原。有研究者使用OVA+CRA+HDM 多重过敏原对小鼠腹腔致敏及滴鼻激发,与使用单一过敏原相比,复合过敏原更易诱导小鼠产生激素抵抗[14]。
2.1.3 单一过敏原和复合过敏原的比较
使用单一过敏原造模的优点在于方法简单、造模时间短、成本低,但如IL-13 腺病毒、TDI 作为动物造模的过敏原并不常用;使用复合过敏原的优点在于造模成功率高,更易产生SA,而且复合过敏原能够更好的模拟临床复杂的环境-免疫的交互作用,但复合过敏原造模流程相对复杂、造模时间长、成本高。此外,对过敏原类型的选择也和实验研究目的密切相关,比如TDI 诱导的SA 模型,除了诱发Th2 细胞炎症反应以外,还能够产生显著的Th17 炎症反应,用于探索Th17 细胞在SA 发病中的作用与机制[12];OVA+HDM 等可以构建高Th2 型嗜酸粒细胞的SA 模型[14];HDM+LPS 被用于构建低Th2 型和高中性粒细胞的SA 模型[15]。
2.2 常见佐剂及其选择
2.2.1 常见佐剂
佐剂是一类能够改变免疫应答类型、发挥辅助作用的非特异性物质。目前,临床上使用最多的佐剂为铝佐剂,包括氢氧化铝(Al(OH)3)和磷酸铝等。研究表明,铝佐剂可以诱导机体产生强烈的体液免疫,还能够促进树突状细胞(dendritic cells,DCs)的募集和活化、释放细胞因子及其他介质诱发炎症反应[16],因此在SA 造模中常配合使用铝佐剂加强过敏原的致敏效果。
完全弗式佐剂(complete Freund’ s adjuvant,CFA)属于油乳类佐剂,可诱导体液免疫反应,增强机体细胞免疫应答能力。在SA 模型中CFA 常和HDM 配合使用诱导增强免疫反应。有研究应用HDM/CFA(1 μg/μL,100 μL)皮下注射致敏小鼠,14 d 后使用HDM(5 μg/μL,20 μL)激发,模型小鼠的肺部中性粒细胞显著增多并表现出激素抵抗等特征[17]。
脂多糖(lipopolysaccharide,LPS)属于阴离子脂质佐剂,是革兰氏阴性菌独特的病原相关分子模式,LPS 可持续释放到环境中并且显著污染室内灰尘,是哮喘严重程度的增强因素[18]。有研究者采用LPS 作为佐剂联合OVA 建立SA 模型,发现该模型气道炎症以中性粒细胞浸润为主[3]。有学者给予小鼠模型不同剂量LPS(1 μg 或10 μg),发现OVA联合高剂量的LPS 更易建立高中性粒细胞的SA 哮喘模型,该模型对CS 的治疗无效[19]。
环二鸟苷酸(cyclic diguanylate,c-di-GMP)属于核酸类佐剂,存在于多种导致SA 的感染细菌中,cdi-GMP 已被证明是一种有效的粘膜佐剂,可诱导Th1/Th17 反应并伴有低 Th2 反应[20]。有研究者使用HDM 和c-di-GMP 致敏小鼠,随后用HDM 和低剂量的c-di-GMP 激发,可以成功诱导出小鼠的AHR,且明显高于单独使用HDM 诱导的小鼠模型,此外该模型也表现出中性粒细胞显著增多[21]。
2.2.2 佐剂的选择
佐剂的使用可以提高免疫应答作用,但同时佐剂的使用离不开过敏原的属性,常见SA 造模多使用OVA+Al(OH)3、HDM+CFA 或HDM+LPS 等方式。铝佐剂和OVA 通常使用腹腔/皮下注射致敏的方式,在体内诱导CD4+T 细胞向Th2 细胞分化,可增强OVA 的免疫原性。LPS 同样为环境中的过敏原,多配合HDM 进行滴鼻或气管滴注的方式致敏,CFA 作为油乳类佐剂,常用腹腔/皮下注射的方式致敏,在滴鼻和腹腔两种方式的加持下,提高造模成功率。
2.3 致敏与激发方法
SA 模型在致敏和激发的持续时间、时间间隔、给药途径、给药剂量等虽存在一定差异,但也有以下5 个共同点:(1)动物多次致敏,两次致敏间隔通常为7~14 d;(2)过敏原激发多持续4~7 d,能够引起较强烈的AHR、气道炎症等特征;(3)给药方式通常为滴鼻、气管给药、雾化吸入、腹腔注射、皮下注射等。其中,腹腔注射多在致敏阶段使用,气管给药和滴鼻多在激发阶段使用;(4)过敏原剂量:致敏阶段使用低剂量,激发阶段使用高剂量;(5)多使用Al(OH)3、LPS 或CFA 作为佐剂,能够获得较为稳定、可重复的SA 动物模型。(具体的方法和内容详见表1)
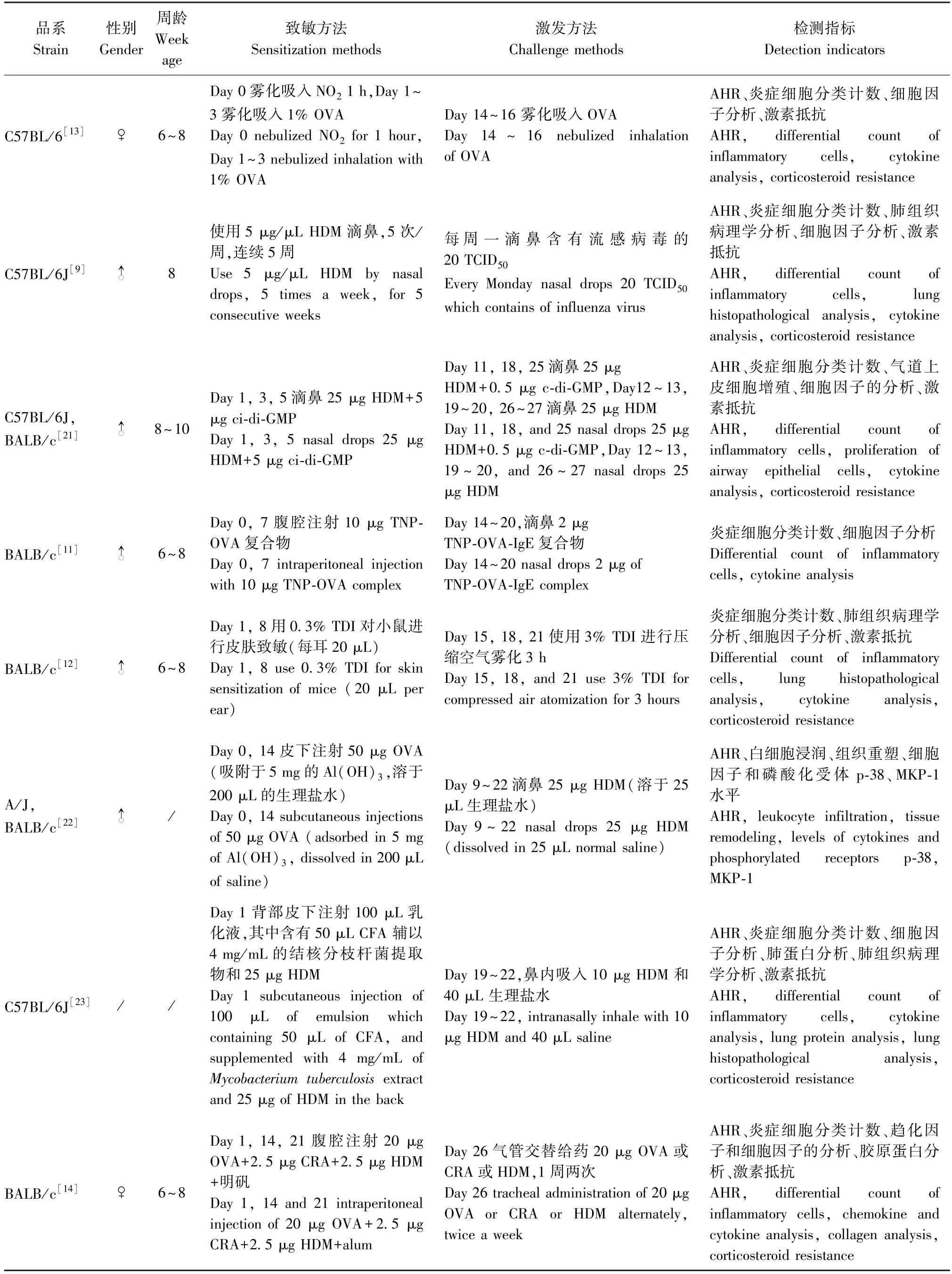
表1 重度哮喘模型的构建方法Table 1 Methods of establishing severe asthma models
3 重度哮喘动物模型的病理表型分析
3.1 气道炎症
SA 炎症反应可根据气道Th2 数量分为高Th2型和低Th2 型。高Th2 型SA 以嗜酸性粒细胞浸润为主,气道细胞炎症因子升高以Th2 分泌的细胞因子为主。IL-4 可诱导幼稚T 细胞向Th2 细胞分化、IL-5 促进骨髓中嗜酸性粒细胞的成熟并释放IL-13,使嗜酸粒细胞向气道迁移,通过作用于气道平滑肌细胞引起气道反应性[31]。有研究者使用复合过敏原制备SA 模型,与使用OVA 或HDM 等单一过敏原诱导的过敏性哮喘模型比较,OVA+HDM+CRA 多重过敏原诱导SA 模型小鼠的白细胞总数明显增多,其中嗜酸性粒细胞和巨噬细胞数量显著升高,肺部Th2 型细胞因子IL-4、IL-5 的表达水平是普通哮喘组的3 倍,IL-13 和Th1 型细胞因子IFN-γ、IL-12 表达水平也显著升高[14]。目前,针对高Th2 型SA 分泌高水平IgE、IL-5、IL-13 等炎症介质,已开发出相应的靶向药物用于临床治疗,而低Th2 型SA仍缺乏有效的生物标志物。
低Th2 型(或称为Th2/Th17 型、中性粒细胞型)SA 模型以肺中性粒细胞浸润为主要特征,通常表现为较重的气道炎症反应和气道重塑病理变化,且对激素治疗反应不敏感,气道细胞因子表达以Th1 细胞分泌的IFN-γ 和IL-12 以及Th17 细胞分泌的IL-17A 为主,其中IL-17A 被证明可以降低人气道上皮对CS 的敏感性[32]。采用HDM 和LPS 联合诱导低Th2 型SA 小鼠模型,其肺组织炎症细胞总数及巨噬细胞计数经地塞米松(dexamethasone,Dex)治疗后显著下降,而肺中淋巴细胞和中性粒细胞浸润及AHR 不能被有效抑制,在Dex 治疗后反而促进Th1 细胞因子IFN-γ、IL-12 以及Th17 细胞因子IL-17A 等的表达增加[15]。用高剂量LPS 联合三磷酸腺苷(adenosinetriphosphate,ATP)刺激过敏原装载后的DCs,并且将这些细胞通过鼻腔滴注的方式致敏小鼠,在过敏原激发后该模型表现出SA 的特征,气道中性粒细胞和Th17 细胞数量明显增多,IL-17A 分泌水平显著升高,与气道滴注低剂量LPS刺激的过敏原转载DCs 相比,该模型组的气道重塑病理变化显著增强。进一步研究发现,在中性粒细胞炎症基础上,IL-17A 对气道结构细胞(如成纤维细胞等)的作用加重了该模型的气道重塑水平[33]。也有研究表明低Th2 型SA 小鼠模型对于抗IL-17F的治疗有效,而对抗IL-17A 的治疗无效,提示IL-17F 在SA 炎症病理反应中发挥重要作用[12]。
3.2 气道高反应性
AHR 是哮喘的基本特征,能够直接或间接通过运动、冷空气、过度换气诱发,引起气道平滑肌收缩,从而导致气道变窄和气流受限。哮喘的AHR 主要有两种表现形式:其一表现为短暂的、可诱发的,通常发生在过敏原暴露后,在吸入CS 治疗或环境控制后可迅速缓解,这种短暂的AHR 对间接刺激更为明显,研究认为其与气道炎症病理密切相关;其二表现为持久性,多见于SA,在吸入CS 或环境控制后仍难以缓解,多继发于慢性气道炎症所导致的结构性气道变化[34]。
在哮喘患者中,气道敏感性、反应性和最大反应都明显增强。但是,与轻中度哮喘相比,SA 患者的气道敏感性更高。在相同的1 s 秒内用力呼气量(FEV1)的变化率下,引起SA 的气道最大反应的刺激物浓度低于轻中度哮喘患者[35]。同样,在SA 动物模型中,有学者发现患有牧场哮喘(pasture asthma, PA)的马匹具有重度AHR,与对照马匹相比,患有PA 的马匹吸入乙酰甲胆碱(methacholine,Mch)后,肺阻力的平均百分比变化明显更大,且诱发PA 马匹气道收缩反应的过敏原浓度更低,表明PA 马匹气道敏感性更强。同时低浓度Mch(<1 mg/mL)引起PA 的马匹肺阻力增加40%,而对照组在较高剂量(8 ~ 16 mg/mL)下肺阻力仍无明显变化[36]。
除了牧草马哮喘,有研究者通过OVA 特异性Th1 细胞过继转输,诱发Th1 细胞介导的SA 小鼠模型,与普通哮喘模型组相比,发现SA 组小鼠肺阻力升高更加明显,AHR 更显著增强[37]。不仅如此,有研究者使用HDM 和流感病毒H3N2 诱导SA 小鼠模型,分别在第4、8、10、15 天检测肺阻力,与仅使用HDM 诱导的普通哮喘组相比,流感病毒H3N2 诱导的SA 小鼠表现出较早、较高的气道阻力值,AHR 持续时间延长,且对低浓度的Mch 敏感性更高[9]。
3.3 气道重塑
由于哮喘气道炎症造成气道组织结构反复损伤刺激,最终引起的气道壁结构变化被称为气道重塑。其主要病理特征包括气道平滑肌细胞增殖肥大、上皮完整性丧失、上皮-间质转化、杯状细胞化生、粘液分泌过多、上皮下纤维化、网状基底膜增厚和血管生成等,均可导致不可逆转的肺功能丧失[38]。SA 患者与轻中度哮喘患者比较,气道重塑更为明显,主要表现为支气管壁增厚,支气管内径变窄,支气管壁面积百分比增大,导致有效通气面积减小气道阻力显著增大,构成阻塞性通气障碍[39]。
利用OVA+CRA+HDM 多重过敏原诱导小鼠SA 模型,发现小鼠气道上皮杯状细胞内黏液分泌降低,而细胞外的黏液栓塞明显增强,同时平滑肌层厚度和肺组织纤维化程度高于轻中度哮喘模型[14]。在OVA 诱导的哮喘小鼠模型过敏原激发阶段(第5~55 天),使小鼠反复暴露于低剂量的流感嗜血杆菌(1×107CFU,每周1 次,共8 次),能够使小鼠气道Th2 细胞主导的嗜酸粒细胞炎症表型,转变为Th17 细胞主导的中性粒细胞炎症表型,同时导致哮喘模型气道黏液分泌增加和气道重塑加重,主要表现为上皮下和血管周围空间的胶原蛋白沉积和肌肉层增厚,α-平滑肌肌动蛋白和几种主要胶原蛋白增加[40]。此外,Th17 相关细胞因子IL-17A 和IL-22在中性粒细胞型SA 中发挥了重要作用,并参与气道重塑。IL-17A 在SA 哮喘患者痰液中增加,诱导上皮细胞、内皮细胞和成纤维细胞表达“促纤维化”细胞因子,并在体外研究中激发人气道平滑肌细胞迁移,IL-22 可促进肌成纤维细胞分化、上皮-间质转化以及体外平滑肌的增殖、迁移,在慢性SA 小鼠模型中,气道重塑以上皮下纤维化、粘液过度生成、平滑肌细胞增生和肥大、高表达IL-17A 和IL-22 为主要特征[41]。由此看来,SA 哮喘小鼠模型气道细胞纤维化高、细胞过度增殖迁移、粘液分泌加重,气道重塑与中性粒细胞型炎症密切相关。
由于小鼠的气道壁是一种较薄的组织结构,因此小鼠哮喘模型中气道重塑的研究较少涉及气道平滑肌的变化,主要聚焦于气道上皮下纤维化。而大鼠哮喘模型在过敏原致敏和反复激发后,通常能够表现出气道平滑肌增生肥厚等组织病理学变化,这些气道重塑变化与大鼠模型的AHR 程度密切相关[42]。但是,有研究指出大鼠类固醇抵抗组与皮质类固醇激素敏感哮喘组相比,两者在杯状细胞增生、上皮下胶原厚度和气道平滑肌重塑方面无显著差异[3]。因此,SA 动物模型中气道重塑的研究存在一定生理性局限,其在SA 疾病中的病理表型差异性以及诊断价值,仍有待阐明。
3.4 激素抵抗
临床上,SA 患者尽管接受了高剂量的激素治疗,但仍会出现难以控制的哮喘症状,被称为激素抵抗性哮喘。有证据表明糖皮质激素受体(glucocorticoid receptor,GR)异常、核组蛋白去乙酰化酶2(histone deacetylase 2,HDAC2)活性降低等可导致激素抵抗的发生和发展[43]。此外,非编码RNA、细胞自噬等因素在激素抵抗中的作用也是近年研究的热点。
通过OVA 和衣原体病毒、流感嗜血杆菌、流感病毒H1N1、 RSV 合并感染BALB/c 小鼠诱导SSIAAD ( severe steroid-insensitive allergic airway disease)新型小鼠模型,小鼠肺部miRNA-21 表达水平增加,而miR-21 靶磷酸酶和张力蛋白同系物(PTEN)的表达减少,并且与AKT 磷酸化水平增加和HDAC2 水平降低有关,通过抑制miR-21 或PI3K,小鼠对CS 治疗的敏感性恢复[44]。反复接触过敏原也可导致小鼠对CS 不敏感,与单次LPS 激发相比,A/J 小鼠经3 d 的LPS(0.1 mg/mL,每只40 μL,每天两次)鼻内激发,HDAC2 和核因子E2 相关因子2(Nrf2)水平显著降低,AKT 磷酸化水平增加,丙酸氟替卡松对其气道炎症的抑制作用明显减弱[45]。总之,激素抵抗是SA 的重要病理特征,制备新型SA 模型能够更深入地研究其发病机制,并开发新的治疗药物。
3.5 其他
除气道炎症、AHR、气道重塑和激素抵抗等病理表型外,SA 动物模型也表现出不同的分子表型,如NOD 样受体蛋白3(NOD-like receptor protein 3,NLRP3)、外泌体、miRNA、唾液结合免疫球蛋白样凝集素9(sialic acid-binding immunoglobulin-like lectin-9,Siglec-9)等特征性分子,这些分子可能成为SA 的特征性诊断标记物或治疗靶点。
NLRP3 炎性小体是一种存在于细胞浆中的多蛋白复合物,由凋亡相关斑点样蛋片(ACS)、半胱氨酸蛋白酶-1(Caspase-1)以及NOD 样受体蛋白组成,它是一种重要的炎症介质,参与多种炎症反应核免疫调节过程[46]。使用衣原体、流感嗜血杆菌以及OVA 诱导SA 小鼠模型,表现为气道中性粒细胞、NLRP3、IL-1β 表达增高,靶向NLRP3 的治疗可以减少IL-1β 的产生,降低SA 模型中性粒细胞炎症和AHR[10]。临床证据也表明,SA 患者肺组织、诱导痰中NLRP3 和IL-1β 的表达增多,这可能与中性粒细胞比例增加以及哮喘控制不佳有关[47]。此外,有研究显示参与 SA 发病机制的所有类型的细胞都会产生和分泌外泌体,外泌体含有蛋白质、核酸、脂质、细胞因子和生长因子以及共刺激分子,因此可以调节 SA 中的免疫炎症反应[48]。miRNA 是一种内源性非编码小RNA,它在转录后水平调节细胞功能,参与调节哮喘等肺疾病,其中miR-9 可调节 GR信号和AHR,miR-21 能够抑制 Th1 相关细胞因子的表达。哮喘小鼠敲除miR-21 表现为嗜酸粒细胞炎症减少,Th1 型细胞因子增加[49]。因此,miR-9 和miR-21 可以作为SA 模型的辅助检测指标。此外,Siglec-9 是特异性表达于中性粒细胞的抑制性唾液酸聚糖受体,当Siglec-9 与特异性配体或抗体结合,可诱导中性粒细胞凋亡或自噬,有助于促进中性粒细胞炎症消退,是治疗SA 中性粒细胞增多的潜在靶标[50]。
4 总结与展望
目前,SA 动物模型的制备在动物品系、过敏原种类、致敏和造模方法等方面存在诸多差异,通过总结近十年的SA 模型造模方案,发现动物选择多以BALB/c 小鼠为主。致敏原可分为环境过敏原、病原体过敏原、化合物过敏原三大类,根据过敏原使用形式的不同,还可分为单一过敏原和复合过敏原,多配合佐剂来增强模型动物的免疫应答反应。动物接受过敏原致敏次数通常不少于2 次,并通过多次反复的过敏原激发进行诱导,过敏原的给药方式多选用皮下或腹腔注射、气管滴入或雾化吸入等。
在SA 动物模型病理表型方面,以高Th2 型或低Th2 型区分表型,伴有气道炎症、气道重塑、AHR加重,细胞因子显著增高、激素抵抗等特征。SA 动物模型可表现出较早、较高的气道阻力值,气道敏感性更高,且AHR 持续时间延长,气道重塑病理变化加重。
此外,SA 动物模型的研究仍存在许多问题。(1)临床SA 患者对异体蛋白过敏引发哮喘的较少,而动物造模时选用OVA 腹腔或皮下注射致敏具有明显的局限性,使用病毒感染、环境中提取过敏原更符合临床;(2)在研究激素抵抗时多选用Dex 腹腔注射,而临床较少使用Dex 治疗,多使用吸入性氢化可的松或甲泼尼龙;(3)目前SA 动物模型的表型较为简单,还不能充分模拟SA 患者的复杂临床表型,选用合适的过敏原(多重联合过敏原等)、佐剂以及致敏和激发方案,同时利用基因编辑等方法可能有助于构建具有特定临床表型的SA 模型;(4)在SA 动物模型中通过传统的气道炎症、AHR、气道重塑、激素抵抗等指标进行评估以外,可以结合NLRP3 炎性小体、外泌体和特定miRNA 等进行SA病理表型分析。
综上所述,今后还需针对SA 临床表型进一步优化动物模型的构建方法,建立能够更好地模拟人类SA 病理变化的实验动物模型,进而加深对SA 发病机制的研究,发现新的干预靶点,并最终开发出新的SA 预防和治疗药物。

