氧化石墨烯包封的酵母细胞对镉离子的吸附作用
刘 园 刘素素 李璋龙 陈嘉程 宋海红 喻长远 刘佳蕙 王诗卉*
(1.北京化工大学 生命科学与技术学院, 北京 100029;2.北京大学 化学与分子工程学院 分析测试中心, 北京 100871)
引 言
镉是一种强毒性的有色稀有重金属,作为一种重要的工业原料,被广泛应用于各个领域。 但是由于各种原因,相当数量的镉被排放到环境中,造成环境污染,并危害人类健康[1]。 镉在人体内不易被排出降解,会对人体的各个系统造成损害。 流行病学数据表明,镉的暴露与前列腺癌、结肠癌和肝细胞癌等密不可分[2],并且镉能够穿过血脑屏障,在大脑中积累,导致神经毒性[3]。 因此,去除环境中的镉对于环境保护和人类健康具有十分重要的意义。 目前,镉的去除方法主要有物理法[4]、化学法[5]和生物修复法[6]。 物理法和化学法虽然能够在短期内降低环境中的镉离子浓度,但是工作量过大,投资费用较高,并且一些试剂投入到环境中可能造成二次污染。 生物修复法利用生物的生命代谢活动来降低环境中重金属离子的浓度,使被污染的环境能够部分或完全恢复到原始状态[7]。 与传统的物理化学等处理方法相比,生物修复法具有处理效果好、运行费用低、操作简单、二次污染少等优点[8]。 微生物修复法是生物修复法中重要的组成部分,该方法通过微生物吸附环境中的重金属离子来处理环境中的镉污染[9-10],经过筛选或改造的微生物吸附剂对金属离子具有很强的吸附作用。
酿酒酵母是一种常见的兼性厌氧性真菌,是当前被广泛研究和表征的一种真核生物,也是大量生物学研究的基础之一[11-12]。 酵母细胞(Yeast)具有特殊的菌丝体结构,是一种良好的重金属离子吸附剂[13-15],不仅吸附量较大,而且吸附后便于分离。
石墨烯是一种新型的碳材料,其氧化物——氧化石墨烯(graphene oxide,GO)具有比表面积大、尺寸小、导电性和生物相容性优异等特点[16-17],GO已被证明是水处理中具有良好发展前景的吸附剂[18]。 研究表明,将GO 包裹在Hela 细胞上,GO 不会改变Hela 细胞的活力、活性氧和膜完整性[19],并且GO 可以保护细胞免受有机溶剂(二甲基亚砜、丙酮、甘油和乙醇)的伤害,减少Hela 细胞凋亡[20]。He 等[21]将GO 包封到Yeast 表面,与包封前相比,GO 包封可以使Yeast 更好地适应环境,同时Yeast的储存时间也有所延长。 这为GO 包封在细胞表面对镉离子进行吸附提供了可能。
在细胞水平上的金属含量测定对于Cd2+吸附能力的研究具有重要意义,灵敏度极高的分析方法可以精确到单个细胞,然而,目前单细胞中的金属含量测定仍然是一个巨大的挑战。 电感耦合等离子体-质谱法(inductively coupled plasma-mass spectrometry, ICP-MS)是目前最先进、灵敏度最高的超微量元素分析手段之一[22],该方法以独特的接口技术将电感耦合等离子体(ICP)的高温电离特性与四极杆质量分析器(MS)的快速灵敏扫描的优点相结合,形成一种可用于分析元素、同位素、单颗粒和单细胞的技术[23]。 但是,在测定细胞内金属含量时,采用这种方法无法获得单个细胞的相关数据。 单细胞ICP-MS(single-cell ICP-MS, SC-ICP-MS)技术使用专门的单细胞进样系统与ICP-MS 在线联用,可以高效、准确地对单个细胞中金属离子进行定量分析。 目前,SC-ICP-MS 技术已应用于金属组学[24]、药物开发[25]、细胞计数[26]、癌细胞系[27]以及其他细胞生物学领域,在单细胞水平上的定量研究中发挥着重要作用[28]。
本课题组前期采用逐层(LBL)技术在聚电解质聚苯乙烯磺酸钠盐(PSS)和聚谷氨酸(PGA)的辅助下,将GO 成功包封在酵母细胞表面。 所制备的Yeast@GO 相比Yeast 具有更长的存活时间和更高的活性,并可提高Yeast 对pH 值和盐胁迫的抵抗力,延长Yeast 的储存时间[21]。 Yeast 是一种良好的重金属吸附剂,GO 同样是一种有前途的水处理吸附剂,为了探究GO 包封对Yeast 吸附Cd2+的影响,本研究采用LBL 技术将GO 包封在Yeast 表面,比较了包封前后Yeast 在正常环境和Cd2+环境下的生长情况,并采用SC -ICP -MS 技术研究了单个Yeast@GO细胞对Cd2+的吸附作用。
1 实验部分
1.1 实验原料和仪器
1.1.1 实验原料
酵母细胞浸取液,Oxoid 公司;YPD 培养基和磷酸盐缓冲溶液(PBS),Solarbio 公司;PGA(平均相对分子质量>7 × 105)、PSS(平均相对分子质量约106)和片状GO,上海源叶生物技术有限公司;戊二醛、叔丁醇、无水乙醇,分析纯,北京奥博星生物科技有限公司;五水氯化镉(纯度98%),Macklin 公司。
1.1.2 实验仪器
恒温培养摇床(BHWY-100C 型),宁波赛福仪器服务有限公司;扫描电子显微镜(SEM) (S -3400N 型),Hitachi 公司;光学显微镜(XD20 型),宇博舜宇仪器有限公司;离心机(Heraeus pico 17 型),Thermo Fisher 公司;超净工作台(SW-CJ-1D 型),苏州净化设备有限公司;酶标仪(K3 Plus 型),Biotrand 公司;动态光散射仪(Nano-ZS90 型),Malvern公司;电感耦合等离子体-质谱仪(NexlON 350X型),PerkinElmer 公司。
1.2 Yeast@GO 细胞的制备
取-20 ℃冰箱保藏的酵母细胞浸取液,接种环灭菌后沾取少量酵母细胞浸取液在平板上划线。 平板长出活力较高的单菌落后,挑取一个单菌落到液体YPD 培养基中,设置恒温培养摇床的条件为30 ℃、180 r/min,将无菌离心管稍微拧松瓶盖后放入培养摇床中活化。 将活化后的酵母细胞以4 000 r/min 离心4 min,去除残留的YPD 培养基,用PBS 清洗2 次,将细胞浓度调整到108个/mL。 分别配制GO、PGA 和PSS 溶液各5 mg/mL,将酵母细胞与PGA 溶液以0.3∶1的体积比混合,于涡旋振荡仪上振荡混合3 min,离心去除上清,然后加入PBS 清洗2 次,将PGA 包封在Yeast 表面。 按照上述操作依次在酵母细胞表面包封PSS、PGA、GO、PGA、PSS,得到GO 包封的酵母细胞(Yeast@GO),其结构为6层壳结构,如图1 所示,由内向外依次为3 层聚电解质、GO、2 层聚电解质。
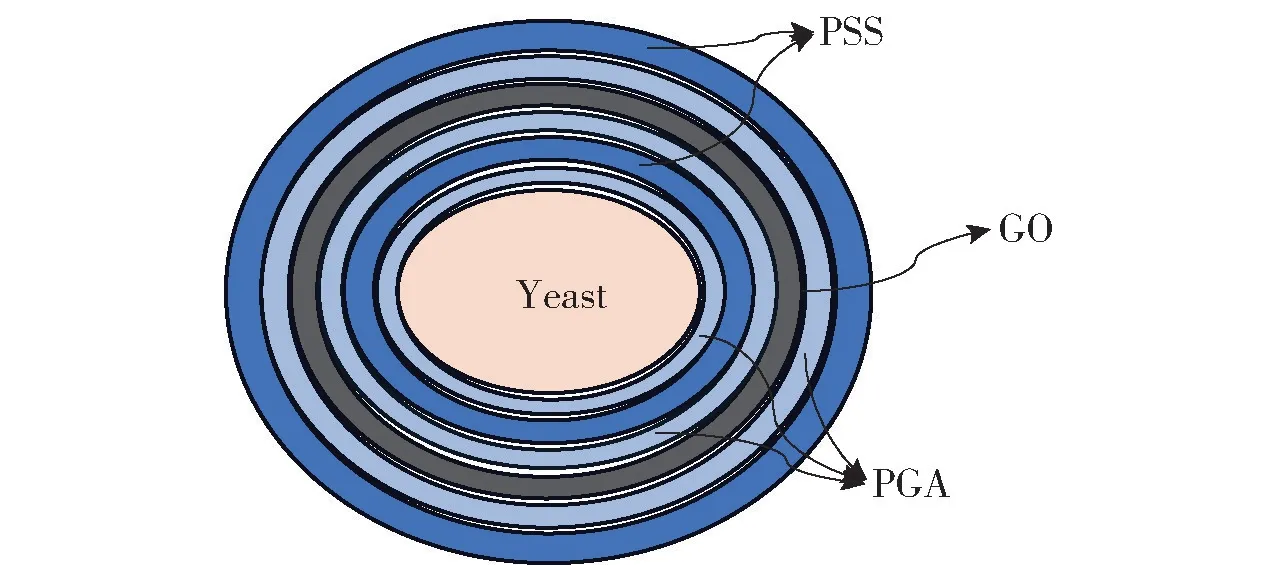
图1 Yeast 分层包被示意图Fig.1 Schematic illustration of the layered coating of the yeast cells
1.3 Yeast@GO 细胞的表征
每次包封后取少量酵母细胞于光学显微镜下观察其形态,放大倍数为10 倍;采用动态光散射仪测定其Zeta 电位。
取100 μL 的Yeast@GO 细胞悬液于3.5 mL 的新鲜液体YPD 培养基中,加入400 μmol/L 的Cd2+溶液400 μL 处理12 h,得到Cd2+处理的Yeast@GO细胞悬液。 分别将Yeast、Yeast@GO 和Cd2+处理的Yeast@GO 细胞悬液离心,加入2.5%戊二醛固定细胞,将固定好的细胞以3 000 r/min 离心10 min,弃去上清液,用PBS 清洗3 次。 将酵母细胞过滤在微孔滤膜上,取出滤膜对折两次并用曲别针夹好。 使用不同浓度的乙醇脱水,每次10 min。 采用叔丁醇与无水乙醇的混合溶液(二者体积比为1 ∶1)置换3次,每次30 min。 经叔丁醇结晶后,将制好的样品放入冷冻机中冷冻以去除叔丁醇。 将待测样品用牙签小心地涂在样品垫上,喷金后通过扫描电子显微镜观察样品的微观形貌。
1.4 Yeast 和Yeast@GO 细胞生长曲线的测定
分别取活化的Yeast 和制备的Yeast@GO 细胞400 μL 于试管内,加入4 mL YPD 液体培养基,设置3 组平行,于摇床培养箱内培养,在不同时间取100 μL 酵母细胞置于96 孔板内,使用酶标仪在600 nm 波长下测定其光密度(OD600)。 以培养时间为横坐标,OD600为纵坐标绘制酵母细胞的生长曲线。
1.5 在不同浓度Cd2+环境中Yeast 和Yeast@GO细胞活性的测定
分别取100 μL 的Yeast 和Yeast@GO 细胞悬液于3.5 mL 新鲜的液体YPD 培养基中,加入不同浓度的Cd2+溶液400 μL,使得Cd2+的终浓度为100、200、400、800、1 000 μmol/L,对照组中加入400 μL去离子水代替Cd2+溶液。 于摇床培养箱中培养,在不同时间取样,测定OD值。 另取500 μL PBS 作为空白组,测定其OD值。 按照式(1)计算培养24 h后的细胞活力A,然后根据细胞活力计算抑制率R(式(2))。
式中:ODA为空白组的光密度值,ODB为对照组的光密度值,ODC为实验组的光密度值。
1.6 酵母细胞对Cd2+的吸附能力测定
1.6.1 供试样品的制备
分别取100 μL 的Yeast 和Yeast@GO 细胞悬液于3.5 mL 新鲜的液体YPD 培养基中,加入不同浓度的Cd2+溶液400 μL,使得Cd2+的终浓度为100、200、400、800、1 000 μmol/L。 将细胞培养24 h,离心去除培养基,用超纯水清洗3 次以去除未吸附的Cd2+,将细胞制成浓度为104个/mL 的细胞悬液。每个样品中加入2 mL 浓硝酸溶液,消化至200 μL后定容至5 mL,得到供试样品。
1.6.2 单个酵母细胞中Cd2+含量测定
使用ICP-MS 检测单个酵母细胞中Cd2+含量。测试前在准备间打开水机,点火,等待20 min,待仪器稳定后进行调谐,设置ICP -MS 的各项参数(表1),然后测定供试样品,根据仪器导出的数据进行绘图分析。
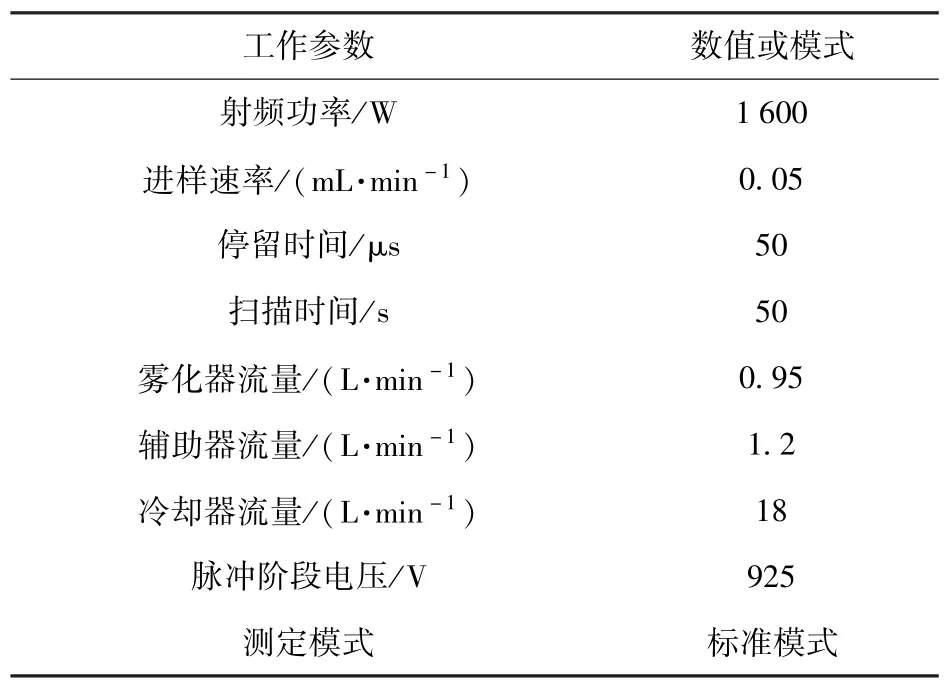
表1 ICP-MS 的工作参数Table 1 Operating parameters of ICP-MS
2 结果与讨论
2.1 Yeast@GO 细胞的表征结果
为了验证Yeast@GO 细胞是否制备成功,在每次包封不同的材料后,取少量样品在光学显微镜下观察细胞形态,结果如图2 所示。 由图2(a) ~(d)可以看出,在逐层包封前3 层聚电解质PGA/PSS/PGA 后,Yeast 的形态并无明显变化,呈现出较为分散、无明显聚集的状态。 由图2(e)可以看出,在包封GO 后Yeast 出现明显的聚集状态,GO 包封在细胞表面后,细胞会出现聚集或者堆叠在一起形成多层细胞状态,这与文献[19 -21]的报道结果一致。由图2(f)和(g)可以看出,继续包封聚电解质PGA/PSS 后,Yeast 的聚集状态消失,细胞又呈现出较为分散的状态。

图2 Yeast 细胞分层包被的光学显微镜图像Fig.2 Optical microscope images of the layered coating of the yeast cells
分别对Yeast、Yeast@GO 和Cd2+处理的Yeast@GO 进行SEM 表征,结果如图3 所示。 可以看出,Yeast 的表面较为平滑圆润,GO 包封后Yeast 的表面变得粗糙,说明聚电解质及GO 成功包封在Yeast 表面。 经Cd2+处理后Yeast@ GO 的表面出现不同程度的损伤,说明Cd2+破坏了酵母细胞表面的包封壳。

图3 Yeast、Yeast@GO 和Cd2+处理的Yeast@GO 的SEM 图像Fig.3 SEM images of Yeast, Yeast@GO and Cd2+-treated Yeast@GO
在每次包封不同的材料后,取少量酵母细胞稀释一定倍数,测量其Zeta 电位,结果如表2 所示。酵母细胞壁含有多种带负电的物质,因此酵母细胞本身带负电,其电位为-11.8 mV。 由于PGA 为正电解质,PSS 为负电解质,包封不同的聚电解质后,酵母细胞的Zeta 电位会出现如表2 所示的波动,说明每层聚电解质均成功包封在酵母细胞表面。

表2 Yeast 细胞分层包封后Zeta 电位的变化Table 2 Changes in the Zeta potential of the yeast cells after layered coating
2.2 Yeast 与Yeast@GO 细胞的生长曲线
为了探究GO 包封是否会影响Yeast 的正常生长,测定了Yeast 和Yeast@GO 细胞的生长曲线,结果如图4 所示。 可以看出,Yeast@GO 与Yeast 的生长曲线相似,均呈S 型生长。 Yeast 的延滞期为12 h,在28 h 左右达到稳定期;Yeast@GO 的延滞期为8 h,在24 h 左右达到稳定期,表明GO 包封对Yeast 的生长没有产生不利影响,Yeast@GO 具有自主裂解性,可以突破6 层包封层进行正常的生长繁殖。 GO 包封将Yeast 细胞的延滞期缩短了1/3,可以使其更快地适应环境,迅速增殖,说明GO 包封对Yeast 的生长是有利的,这为GO 包封的酵母细胞对镉离子进行有效吸附提供了可能。
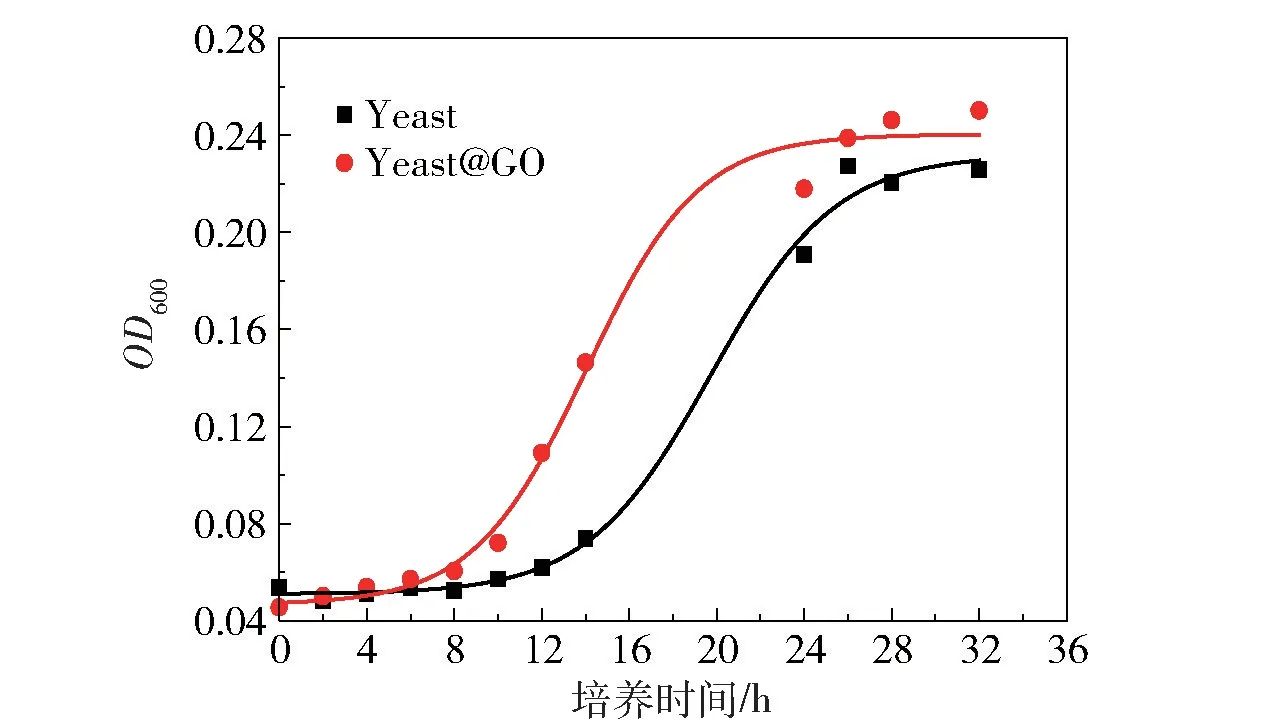
图4 Yeast 和Yeast@GO 细胞的生长曲线Fig.4 Growth curves of Yeast and Yeast@GO cells
2.3 Cd2+浓度对Yeast 及Yeast@GO 细胞活性的影响
考虑到Cd2+对酵母细胞具有一定的杀伤作用,本文研究了Cd2+浓度对Yeast 和Yeast@GO 细胞活性的影响,结果如图5 所示。 可以看出,Yeast 和Yeast@GO 细胞的OD600随培养时间的增加而增大,较低浓度的Cd2+(100 μmol/L)对两种细胞生长的影响较小;当加入高浓度的Cd2+(800、1 000 μmol/L)时,Yeast 和Yeast@ GO 细胞的生长均受到很大抑制。培养24 h 后,当Cd2+浓度为100 μmol/L 时,Yeast和Yeast@GO 细胞的生长抑制率分别为12.01%和16.95%;当Cd2+浓度为800 μmol/L 时,Yeast 和Yeast@GO 细胞的生长抑制率分别达到68.60%和71.60%。 以上结果表明不同浓度的Cd2+对Yeast和Yeast@GO 细胞生长具有不同程度的抑制作用,低浓度Cd2+的抑制作用较小,高浓度Cd2+的抑制作用较大,抑制作用呈现浓度依赖性,GO 包封并不能保护Yeast 免受Cd2+的影响。

图5 Cd2+浓度对Yeast 和Yeast@GO 细胞活性的影响Fig.5 Effect of Cd2+concentration on activity of Yeast and Yeast@GO cells
2.4 Yeast@GO 细胞对Cd2+的吸附能力
将Yeast 和Yeast@GO 细胞在不同浓度的Cd2+中吸附24 h,采用SC-ICP-MS 技术测定单个细胞中Cd2+的含量,结果如图6(a) ~(j)所示,图中曲线为拟合出的检测信号随单个细胞中Cd2+含量变化的曲线。 在不同浓度的Cd2+处理下,单个Yeast和Yeast@GO 细胞中Cd2+的检测信号均呈现出符合高斯分布的信号峰,峰值的位置(横坐标)表示单个细胞中所含Cd2+的质量。 图6 (k) 为根据图6(a) ~(j)得到的不同Cd2+浓度下单个细胞中Cd2+的含量。 可以看出,随着Cd2+处理浓度的升高,单个Yeast 和Yeast@GO 细胞中Cd2+含量逐渐增大,细胞吸附的Cd2+逐渐增多。 虽然Cd2+的浓度越高,对Yeast 和Yeast@ GO 细胞的抑制作用越大,但是细胞可以吸附更多的Cd2+,这与文献[29]的报道结果一致。 酵母细胞对Cd2+的吸附过程存在快速吸附阶段和慢速吸附阶段,酵母细胞对Cd2+的吸附量主要取决于快速吸附阶段[29-30],这个阶段仅持续十几分钟,此时Cd2+对酵母细胞的抑制作用并不明显,因此可以认为酵母细胞对Cd2+的吸附不会受到影响。 由图6(k)还可以看出,在相同的Cd2+浓度下Yeast@ GO 比Yeast 能够吸附更多的Cd2+。 在前文的结果中可知,GO 的包封能够促进Yeast 的生长,同时GO 是一种很好的水处理剂,因此Yeast@GO 对Cd2+的吸附量较多可能与GO 促进Yeast 生长以及GO 本身的吸附作用有关。
3 结论
(1)采用LBL 技术将GO 和聚电解质包封在Yeast 细胞的表面,GO 的包封并未对Yeast 的生长产生不利影响,同时将Yeast 细胞的延滞期缩短了1/3。
(2)不同浓度的Cd2+对Yeast 和Yeast@GO 细胞的生长具有不同程度的抑制作用,并且抑制作用呈现浓度依赖性。
(3)采用SC-ICP-MS 技术对单个酵母细胞中Cd2+含量进行检测,结果表明,随着Cd2+处理浓度的升高,单个Yeast 和Yeast@GO 细胞吸附的Cd2+增多;与Yeast 细胞相比,在Cd2+浓度相同的情况下Yeast@GO 细胞能够吸附更多的Cd2+。
本研究将Yeast 和GO 两种良好的重金属吸附剂结合在一起,这为合成新型、高效的Cd2+吸附剂提供了参考。 在后续的工作中,还将开展吸附动力学、吸附的影响因素、吸附剂的重复使用性以及吸附机理等方面的研究。

