团簇MnPS3 催化析氢活性密度泛函研究
原 琳 方志刚 刘立娥 魏代霞 宋静丽
(辽宁科技大学 化学工程学院, 鞍山 114051)
引 言
随着化石燃料的不断开采和日趋枯竭,能源危机和环境污染日益严重,因此促进绿色能源发展、加快构建低碳环保且安全高效的能源体系成为时代之需。 氢能具有零污染、燃烧性能好等优良特质,被视为21 世纪最具发展潜力的绿色能源之一[1]。 相比化石燃料制氢,光催化分解水制氢[2]和电解水制氢[3]具有可持续且低污染的特点,光催化法和电催化法利用丰富的太阳能和水资源进行制氢,制氢过程中不会产生温室气体,因此它们有望在解决能源和环境问题方面发挥关键作用。
水分解过程可以分为两个反应:析氧反应(OER)[4]和析氢反应(HER)[5]。 其中,析氢反应通过Volmer、Heyrovsky 和Tafel 反应机制进行,成为可替代化石燃料燃烧制氢的一种产氢方式。 然而这种反应往往存在动力学反应较慢的问题,从而降低了制氢效率,因此需要高活性、高效率的催化剂促进反应。 Pt 基催化剂被认为是最有效的析氢催化剂[6],但稀缺性及高成本限制了其广泛应用,因此开发高效且价格低廉的催化剂是相关领域的研究热点之一。 过渡金属磷硫族化合物具有较高的化学多样性与结构复杂性[7],可以在宽pH 及宽波长范围内实现催化制氢[8],因此其逐渐进入研究者的视野。MnPS3作为一种无毒的p 型直接带隙半导体材料[9],对可见光具有良好的吸收能力,然而MnPS3的光电子-空穴复合率较高,表现出较低的光催化制氢活性。 Chen 等[10]研究表明,当MnPS3与具有很强的空穴氧化能力的Cs4W11O35半导体材料复合时,其光催化制氢活性显著提高。 Mayorga-Martinez等[11]研究了过渡金属磷硫族化合物的电催化性能,结果表明虽然MnPS3较同族化合物具有更高的氧化还原(ORR)活性,但其析氢反应活性仍较低。 而Brotons-Alcázar 等[12]研究证明,MnPS3的析氢活性在剥离时会有所提高,并且使用聚醚酰亚胺作为封端剂可大大提高MnPS3的电催化性能。 目前,对MnPS3体系的研究主要集中在宏观实验方面,而缺少从微观角度分析MnPS3催化析氢活性的研究。 团簇作为局域结构模型,可以从微观角度有效反映过渡金属磷硫族化合物的性质。 本文利用密度泛函理论,从前线轨道图、轨道能级差及热力学参数等方面对团簇MnPS3各优化构型的催化析氢活性进行了分析,以期为MnPS3在催化制氢领域的研究提供一定的理论参考。
1 计算方法与析氢反应机制
1.1 团簇模型的构建与计算优化
根据拓扑学原理[13-14],设计出团簇MnPS3的初始构型。 运用密度泛函理论[15-16],使用def2-tzvp基组[17]和B3LYP 泛函[18],利用量子化学软件Gaussian 09 分别在单、三重态下对所设计的团簇MnPS3初始构型进行全参数优化计算,优化收敛条件为最大作用力小于0.000 45,均方根作用力小于0.000 30,最大位移小于0.001 80,均方根位移小于0.001 20。 排除相同的构型和含虚频的不稳定构型,最终得到9 种优化构型。 利用Gauss View06 软件获取前线轨道图,采用Gaussian 09 提取各优化构型的前线轨道能量等相关数据,对各构型的催化析氢活性进行综合分析。 以上所有数据处理均在HPZ440 计算机上完成。
(1)碱性条件
第一步 氢原子吸附Volmer 反应:M+e-+H2O→M-Hads+OH-
第二步 氢气解吸(可能存在以下两种反应途径)
Heyrovsky 反应:M -Hads+e-+H2O→M +H2+OH-
Tafel 反应:2M-Hads→2M+H2
(2)酸性条件
第一步 氢原子吸附
Volmer 反应:M+e-+H3O+→M-Hads+H2O
第二步 氢气解吸
Heyrovsky 反应:M-Hads+e-+H3O+→M+H2+H2O
Tafel 反应:2M-Hads→2M+H2
其中,M 表示团簇MnPS3,Hads表示吸附在团簇MnPS3上的氢原子。
2 结果与讨论
1.2 析氢反应机制
本文以团簇MnPS3为计算模拟对象,其催化析氢反应机制主要分为氢原子吸附和氢气解吸两步[19-20]。
2.1 团簇MnPS3的优化构型
经过计算优化共得到9 种团簇MnPS3的优化构型,其中6 种为单重态构型,3 种为三重态构型。 利用Gaussian 09 提取各构型的校正能(EZPE),将校正能最低的1(3)构型的能量设为0 kJ/mol,以此作为基准计算其他构型的相对能量。 按照相对能量的高低对优化构型进行排序,结果如图1 所示。 其中,上角标括号内的数字表示重态,构型后括号内的数字表示构型的相对能量。

图1 团簇MnPS3的优化构型Fig.1 Optimized configurations of the MnPS3 cluster
2.2 团簇MnPS3的热力学稳定性分析
催化剂的稳定性是评价催化剂性能的重要指标之一,能量可反映构型的稳定性。 构型的校正能EZPE越小,构型越稳定;结合能(EBE)可反映各原子间结合的紧密程度,结合能越大,构型越稳定;吉布斯自由能变(ΔG)可用来判断反应是否能够自发进行,当ΔG<0 时,反应能够自发进行,并且ΔG越小,反应越容易自发进行。 表1 列举了团簇MnPS3各优化构型及单个原子的能量参数。 其中,各构型以及单个原子Mn、P、S 的校正能EZPE和吉布斯自由能G均由Gaussian 09 程序运行得到,EBE和ΔG的计算公式为:

表1 团簇MnPS3各优化构型及单个原子的能量参数Table 1 Energy parameters of the optimized configurations and single atoms of the MnPS3 cluster
由表1 可知,随着团簇MnPS3各构型的EZPE逐渐增大,EBE逐渐减小,而ΔG逐渐增大,说明EZPE越大,各原子间结合的紧密程度越小,反应越难自发进行,构型的热力学稳定性逐渐降低。 通过综合分析各构型的能量参数,得到团簇MnPS3各构型热力学稳定性的大小顺序为:1(3)>2(3)>1(1)>2(1)>3(3)>3(1)>4(1)>5(1)>6(1)。 构型1(3)的校正能最低,说明构型1(3)的热力学稳定性最好;构型1(3)的结合能最大,吉布斯自由能变最小,说明构型1(3)各原子间结合的紧密程度最大,最易自发形成。
2.3 团簇MnPS3的氢原子吸附性能分析
2.3.1 前线轨道图
根据前线轨道理论[21],HOMO 表示已被电子占据的能量最高的分子轨道,LUMO 表示未被电子占据的能量最低的分子轨道,二者统称为前线轨道。 在析氢反应机制的第一步反应中,电子由团簇MnPS3的HOMO 轨道跃迁至水分子的LUMO 轨道。 图2 为团簇MnPS3的HOMO 图与水分子的LUMO 图,三重态构型含有自旋向上的α 电子和自旋向下的β 电子两种成单电子,因此将其分开作图。 图中不同颜色的区域面积表示电子在HOMO和LUMO 轨道出现时其波函数形成的离域空间,离域空间越大,电子出现的概率越大。 其中,白色区域表示正相位的轨道波函数,黑色区域表示负相位的轨道波函数。 不同颜色的区域面积的大小表示其得失电子能力的大小,区域面积越大,得失电子能力越强。

图2 团簇MnPS3各优化构型的HOMO 图与水分子的LUMO 图Fig.2 HOMO diagrams of the optimized configurations of the MnPS3 cluster and the LUMO diagram of the water molecule
由水分子的LUMO 轨道图可以看出,水分子周围多为负相位的轨道波函数,仅在氧原子周围存在小部分正相位。 当构型的HOMO 轨道周围同样为负相位的轨道波函数时,该构型易与水分子的LUMO轨道发生同号重叠,电子在轨道间大量转移,反应活性较强,有利于MnPS3-Hads的生成。
由单重态构型的前线轨道图可以看出,每个构型周围分布的白色区域面积和黑色区域面积相差不大,说明这些构型的正负相位的轨道波函数相当。 不同的是,构型1(1)、5(1)和6(1)的白色区域与黑色区域相对独立,没有过多的嵌套和缠绕,可见这些构型的HOMO 轨道与水分子的LUMO 轨道之间没有过多异号相位的遮挡,容易发生同号重叠而进行电子转移。 而构型2(1)、3(1)和4(1)的黑色区域面积与白色区域面积虽然相近,但二者相互嵌套在一起,这些构型的HOMO 轨道与水分子的LUMO 轨道之间不易进行电子转移,在反应过程中不利于氢原子的吸附,因此这些构型在氢吸附时的催化活性较差。
由三重态构型的前线轨道图可以看出,三重态构型周围分布的白色区域面积与黑色区域面积相差不大。 除构型1(3)β 电子的HOMO 轨道外,其他构型无论是α 电子还是β 电子的HOMO 轨道,其正、负相位的离域空间高度对称,几乎完全一致,且相互独立,说明这些构型作为催化剂时,无论反应物的正相位较大还是负相位较大,这些构型均可与之结合而促进反应。 各构型α 电子与β 电子的HOMO 轨道负相位的离域空间面积相差很小,在发生氢吸附时,理论上α 电子与β 电子对催化的贡献程度相当。 进一步观察发现,构型3(3)α-HOMO 轨道具有较大的负相位,可见该轨道周围电子出现的概率密度较大,并且负相位的离域空间多联结在一起且分布在外侧,这样的空间分布十分有利于与水分子的LUMO 轨道进行同号重叠,说明构型3(3)的α 电子在氢原子的吸附过程中具有较强的催化能力。
2.3.2 轨道能级差
团簇MnPS3的HOMO 轨道与水分子的LUMO轨道之间的能量差称为能级差(ΔE=ELUMO-EHOMO),可以用来判断电子从HOMO 轨道跃迁到LUMO 轨道的难易程度,能级差越小,电子跃迁所需的能量越低,越有利于氢原子吸附。 表2 为团簇MnPS3的HOMO 轨道与水分子的LUMO 轨道之间的能级差。 可以看出,在氢吸附过程中,轨道间的能级差范围为546.76 ~708.14 kJ/mol,各构型的催化能力存在明显差异。 由文献[19]可知,当HOMO 轨道与LUMO 轨道间的能级差小于579 kJ/mol 时,更有利于反应物之间进行反应。 由表2 可知,各构型的HOMO 轨道与水分子的LUMO 轨道之间的能级差大小顺序为:2(1)>1(3)>1(1)>4(1)>6(1)>3(1)>5(1)>3(3)>579 kJ/mol >2(3)。 其中,构型2(3)的轨道能级差最小(546.76 kJ/mol),并且只有构型2(3)的轨道能级差小于579 kJ/mol,由此可见其电子在轨道间跃迁所需的能量最低,具有最强的氢吸附能力,有利于中间产物MnPS3-Hads的形成;构型3(3)同样具有较小的轨道能级差,其氢吸附能力仅次于构型2(3)。 而构型2(1)的轨道能级差最大(708.14 kJ/mol),催化能力最弱。 进一步观察发现,催化活性最好的两种构型均为三重态构型,总体来看,三重态构型吸附氢原子的能力强于单重态构型。 结合2.3.1 节的分析可知,构型3(3)在氢吸附过程中具有最佳的催化活性。
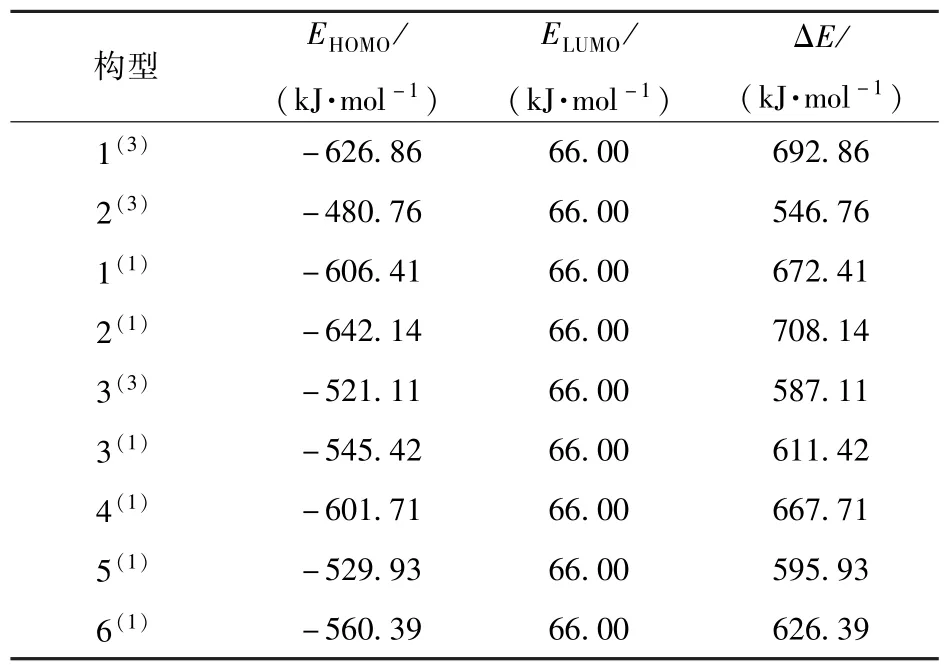
表2 团簇MnPS3的HOMO 轨道与水分子的LUMO轨道之间的能级差Table 2 Energy level difference between the HOMO orbital of the MnPS3 cluster and the LUMO orbital of the water molecule
2.4 团簇MnPS3的氢气解吸性能分析
2.4.1 MnPS3-Hads的结构图
由析氢的第一步反应得到MnPS3-Hads,利用与运行团簇MnPS3相同的计算基组,经过Gaussian 09软件处理,发现与团簇MnPS3对应的MnPS3-Hads结构均可稳定存在,其结构如图3 所示。 可以看出,H原子在各构型中均吸附在S 原子上,说明S 原子是H 原子的主要吸附位点。

图3 MnPS3-Hads的结构图Fig.3 Structure diagrams of MnPS3-Hads
2.4.2 MnPS3-Hads结构的键级
键级又称键序,在分子轨道法中可以表示相邻两个原子的成键强度。 键级愈大,键愈稳定,愈不易断裂。 表3 为MnPS3-Hads结构中氢原子与相邻原子的键级。 可以看出,各构型的键级均大于0.300,键级范围为0.316 ~0.328,键级波动不大,可见各MnPS3-Hads结构的稳固性差异较小。 在构型5(1)-Hads中氢原子与相邻原子的键级最大(0.328),所成的键最稳定,最不易断裂,因而不利于氢气解吸。

表3 MnPS3-Hads结构中氢原子与相邻原子的键级Table 3 Bond order between the hydrogen atom and the adjacent atom in MnPS3-Hads
2.4.3 MnPS3-Hads与水分子之间的轨道能级差
在Heyrovsky 反应过程中,电子由MnPS3-Hads的HOMO 轨道跃迁至水分子的LUMO 轨道,从而产生氢气。 轨道能级差越大,电子跃迁所需的能量越多,电子越不易发生转移,越不利于氢气生成。 表4为MnPS3-Hads的HOMO 轨道与水分子的LUMO 轨道之间的能级差。 由表4 数据可知,能级差的范围为1 622.76 ~1 731.91 kJ/mol,较团簇MnPS3各优化构型的轨道能级差(546.76 ~708.14 kJ/mol)有明显升高。 在氢气解吸过程中,MnPS3-Hads结构的能级差大小顺序为:1(1)-Hads>2(1)-Hads>1(3)-Hads>3(1)-Hads=2(3)-Hads>4(1)-Hads>5(1)-Hads>3(3)-Hads>6(1)-Hads。 6(1)-Hads结构具有最小的能级差(1 622.76 kJ/mol),远大于579 kJ/mol,说明在第二步反应的氢气解吸过程中,MnPS3-Hads结构中HOMO 轨道的电子跃迁到水分子的LUMO 轨道需要大量能量,需要对反应系统提供额外能量以使其顺利进行。由此可见,在Heyrovsky 反应中MnPS3-Hads结构不易解吸氢气,团簇MnPS3通过该反应完成解吸过程较为困难。

表4 MnPS3-Hads的HOMO 轨道与水分子的LUMO轨道之间的能级差Table 4 Energy level difference between the HOMO orbital of MnPS3-Hads and the LUMO orbital of the water molecule
2.4.4MnPS3-Hads结构的校正能与结合能
在Tafel 反应中,两分子的MnPS3-Hads断键生成氢气,因此有必要分析MnPS3-Hads结构的稳定性及原子间结合的紧密程度。 MnPS3-Hads的校正能越高、结合能越低,结构的稳定性越差,越有利于氢气解吸。 表5 为MnPS3-Hads结构的校正能与结合能,由结果可知,MnPS3-Hads结构的校正能均略高于吸附氢原子前团簇MnPS3构型的校正能,可见吸附氢原子后MnPS3-Hads结构的稳定性有所下降,较有利于氢气解吸。 MnPS3-Hads各结构的结合能大小顺序为:2(3)-Hads>3(1)-Hads>1(3)-Hads>2(1)-Hads>4(1)-Hads>1(1)-Hads>5(1)-Hads>6(1)-Hads>3(3)-Hads,构型2(3)-Hads具有最高的结合能,原子间结合的紧密程度大,不利于氢原子脱离产生氢气。 结合2.4.3 节中MnPS3-Hads结构的能级差值大小顺序综合分析可知,3(3)-Hads和6(1)-Hads结构在氢气解吸过程中更易生成氢气。 由2.3.2 节可知,构型3(3)在氢吸附过程中具有最优的催化活性。 上述结果表明构型3(3)是团簇MnPS3催化析氢效果最好的构型,最适合将其作为局域结构来构建作为催化材料的过渡金属磷硫化物MnPS3。

表5 MnPS3-Hads结构的校正能与结合能Table 5 Correction energy and binding energy of the MnPS3-Hads structure
3 结论
为了从微观层面探究团簇MnPS3的催化析氢活性并确定催化析氢性能最优的构型,本文利用前线轨道图、轨道能级差等数据对吸附和解吸两个反应过程进行了较为全面的分析,得到以下结论。
(1)构型3(3)α-HOMO 轨道周围电子出现的概率密度较大,并且正、负相位的离域空间相互独立,易与水分子的LUMO 轨道发生同号重叠,因此构型3(3)的α 电子在氢原子的吸附过程中具有较强的催化活性。
(2)MnPS3-Hads结构的HOMO 轨道与水分子的LUMO 轨道之间的能级差较大,不利于氢气生成,总体上MnPS3各构型在Heyrovsky 反应中的催化活性较低;对能级差及结合能的分析结果表明,3(3)-Hads和6(1)-Hads结构的氢原子较易脱离并产出氢气,是团簇MnPS3各构型中较有利于解吸氢气的中间体。
综上所述,三重态构型3(3)在吸附氢原子及解吸氢气的过程中均表现较好,是团簇MnPS3最优的催化析氢构型,有望在清洁能源的制备中发挥作用。

