捕集离子迁移谱技术及应用进展
张根伟 杨杰 杨其穆 徐一仟 蒋丹丹 王卫国 陈创*1,
1(国民核生化灾害防护国家重点实验室, 北京 102205)2(中国科学院大连化学物理研究所, 仪器分析化学研究室, 大连 116023)
离子迁移谱(Ion mobility spectrometry,IMS)是基于电场E作用下离子在中性气体中迁移速度vd的差异实现不同离子的分离与检测[1]。离子迁移速度vd与电场强度E的比值为离子迁移率K=vd/E,由气体数密度N、离子电荷量q、离子质量m以及离子碰撞截面(Collisional cross section,CCS)等参数共同决定[2],如公式(1)。这与质谱(Mass spectrometry,MS)依据质荷比(m/z)差异实现离子分离与检测不同,也使得IMS可在较宽的气压范围(1~760 Torr,1 Torr ≈133.322 Pa)内工作。
IMS可在ms 量级完成离子分析周期,并可与电离效率较高的大气压化学电离源联用,检出限可低至pptv(10–9)量级[3]。基于此,IMS 被广泛用于痕量炸药、毒品、化学战剂及工业危化品的现场快速检测[4-5]。近年来,得益于IMS 与MS 分离的正交性以及离子迁移率K与离子结构信息的直接相关性,IMS也被广泛用作MS 的前级分离手段,并在生物样品分析中发挥了重要作用[6-7]。一方面,IMS 非常适合与色谱和质谱等技术串级联用,构筑多维分离体系[8-9],实现复杂基质样品中分析物的高选择性检测;另一方面,IMS 通过离子迁移率K能够解析离子构象信息,从而区分蛋白质、脂质、聚糖以及药物等大分子的异构体[10-11]。
根据分离方式的差异,IMS可分为迁移时间离子迁移谱(Drift tube IMS,DTIMS)[12]、行波离子迁移谱(Travelling wave IMS,TWIMS)[13]、高场不对称波形离子迁移谱(Field asymmetric IMS,FAIMS)[14]和捕集离子迁移谱(Trapped IMS,TIMS)[15]等多种类型。不同种类的离子迁移谱-质谱联用(Ion mobility-mass spectrometry,IM-MS)技术在解决复杂样品分析过程中所面临的难题方面都发挥了各自独特的优势,其对比结果见表1[16-29]。

表1 与质谱(MS)联用的典型离子迁移谱技术对比Table 1 Comparison of typical ion mobility techniques coupling with mass spectrometry (MS)
TIMS 是近年新出现的一种具有超高分辨能力的IMS技术,可在长度约为5 cm 的离子分析通道内实现分辨力R>300(R=K/ΔK或R=CCS/ΔCCS),并且具有离子富集存储功能[6]。TIMS 最早由Park 于2008 年报道[30],随后出现了并行富集/分析[31]、串级分离[32]、门控选通[33]和选择性富集[34]等多种TIMS结构和操控方法。基于这些技术,Bruker 公司从2016 年起相继推出多款商品化TIMS-MS 仪器,促进了TIMS 在生物、环境、能源和医药等领域的应用[28,35-37]。
本文对TIMS技术及其应用的最新进展进行了评述,介绍了TIMS工作原理及离子迁移率K标定策略,分析了TIMS工作参数对其分辨能力的影响以及优缺点等,讨论了不同结构和操作方式的TIMS 与MS联用在生物样品分析中的应用及存在的问题,最后,对TIMS 未来的发展趋势进行了展望。
1 捕集离子迁移谱
1.1 仪器结构及工作原理
TIMS 与DTIMS 均利用直流电场驱动离子在中性气体中迁移以实现不同离子的分离,离子穿越中性气体的距离越长,其分辨能力越高[38]。其中,DTIMS 内部充满近似静止的气体,电场驱动离子从迁移区的一端迁移至另一端。与之相反,TIMS 利用直流电场驱使离子在高速气流中保持位置静止,实现离子在中性气体中超长等效距离迁移。这种方式使得TIMS可在小尺寸离子分析通道内实现超高分辨。TIMS的工作气压为1~5 Torr,同时需要射频约束离子径向运动[38]。
基于印刷电路板工艺的TIMS[15,39]主要包括离子偏转电极、前级漏斗、离子分析通道和后级漏斗(图1A)[31]。其中,离子偏转电极、前级漏斗和离子分析通道置于气压为P1的腔室中,后级漏斗置于气压为P2的腔室中。调控P1>P2,可于离子分析通道内形成层流状和高速流速(Vg>100 m/s),高效载运离子前行[40]。离子分析通道内还设置有方向与气流相反、强度随轴线位置变化的直流电场梯度(Electric field gradient,EFG)[41]。如图1B 所示,EFG 轮廓包括上升区、平台区和下降区[31]。在高速气流与EFG的对向作用下,进入TIMS 离子分析通道的离子先后经历离子富集、离子存储和离子洗脱3 个阶段,完成离子分离,并向检测极传输。基于该结构和工作方式的TIMS 也被称为顺序分析TIMS[31,38]。

图1 捕集离子迁移谱结构图示意图(A)及工作时序(B)[31]Fig.1 Schematic diagram (A) and working sequence (B) of TIMS[31]
离子富集阶段(10~100 ms), 离子传输毛细管输出的离子经前级漏斗连续传输至TIMS 离子分析通道内。当电场驱动离子的迁移速度与气流速度达到平衡时,即Vg=KE,离子停止运动。由于离子分析通道内气体流速Vg恒定,在EFG 上升区的作用下,迁移率K不同的离子会静止在离子分析通道轴线的不同位置上,实现连续捕获富集和预分离。
离子存储阶段(2~5 ms),离子传输毛细管输出的离子被偏转并湮灭在离子偏转电极上,无法进入TIMS 离子分析通道。离子分析通道内迁移率K不同的离子团被压缩至各自的平衡位置,轴向分布变窄。迁移率K越小,离子平衡位置越靠近EFG 平台区。EFG 平台区的电场强度Emax决定了TIMS可分析离子的最小迁移率Kmin,即Kmin=Vg/Emax。
离子洗脱阶段(100~200 ms), 离子偏转电极阻止离子经前级漏斗进入TIMS 离子分析通道。EFG 平台区的电场强度按预设的电场扫描速度β从Emax缓慢降低至不同的洗脱电场Eelute,离子分析通道内的离子按照迁移率K从小到大的顺序依次失去受力平衡,被洗脱进入后级离子检测极,得到信号强度对应离子洗脱时间的谱图。其中,离子洗脱时间telute由Emax、β和K共同决定,如公式(2)所示。
1.2 离子迁移率K标定
理论上,TIMS可以直接计算目标离子迁移率K,如公式(2)所示。实际应用中,EFG 平台区的Emax和气体速度Vg均难以直接测量[42]。另外,TIMS 与MS 联用时,实验得到的离子出峰时间tTIMS包括离子洗脱时间telute、离子穿过EFG 平台区的时间tp、离子穿过EFG 下降区的时间tf和离子在MS 中传输的时间tms,即tTIMS=telute+tp+tf+tms,其中,tp和tf与离子迁移率K非线性相关,这也导致K和CCS 值无法直接计算求得[42]。因此,TIMS 通常需要采用与目标物结构相近的迁移率标准物标定以获得准确的K及CCS 值[43]。
由离子洗脱条件可得1/K=Eelute/Vg。Eelute是与时间有关的线性函数,1/K可进一步表示为公式(3)或其它等效形式[43-44]。其中,tTIMS为离子出峰时间,a和b为常数。利用迁移率标准物获得a和b的标定值,即可计算TIMS谱图中未知离子峰的迁移率K。
文献[45-47]报道显示,TIMS获得的K或CCS 值与DTIMS 结果具有高度一致性。Schroeder 等[45]使用TIMS获得脂肪酸和酚酸的K值与DTIMS 相比仅差0.7%和2.1%。Chai 等[46]测量了GRGDS 与SDGRG质子化肽的CCS 值,与DTIMS 相比偏差小于2%。Ridgeway 等[47]检测Ubiquitin 时获得了11 个离子峰的K值,与DTIMS 相比偏差小于1%。此外,Bleiholder 等[48]使用TIMS测得的Avidin 三体离子的CCS 值与DTIMS 的结果吻合。
1.3 分辨能力的影响因素
基于理论分析模型和数值计算模型[40-42],TIMS 的分辨能力RTIMS近似表示为:
其中,q为离子电荷量,kB为玻尔兹曼常数,T为中性气体温度,tp为洗脱过程中离子穿过EFG 平台区的时间,Vg·tp表示离子穿越EFG 平台区时在高速气流中的有效迁移距离。TIMS 中离子有效迁移距离可以达到上百厘米,远大于离子分析通道的长度(~5 cm), 这是TIMS 能获得超高分辨的主要原因。公式(4)与DTIMS 扩散极限分辨能力相同[49],再次印证了TIMS 与DTIMS 基本原理相同。TIMS 离子分析通道的物理尺寸小,更易在其上施加高强度直流电场,既能避免高电压引起的放电风险,还能有效提高RTIMS。
对公式(4)中的Eelute和tp进行等效替换[41],可进一步得到由工作参数决定的RTIMS表达式(5)。
其中,Lp为EFG 平台区长度,β为洗脱电场扫描速度。明显地,RTIMS随Vg呈现线性升高,但是提高Vg,需要同步提高EFG 平台区的Emax以保证迁移率最小离子仍能被捕集[40],即Vg=Kmin·Emax;降低β,可以延长离子穿过EFG 平台区的时间tp,增加离子有效迁移距离Vg·tp。文献[41]报道了这些参数对RTIMS的影响。
改变β值是调整RTIMS最常用的方法。Park 等[47]将β值设为2691 V/(ms)时,分析m/z1822 单价离子的分辨能力仅为228;Fernandez-Lima 等[50]将β值设为579 V/(ms)时,检测多溴联苯醚代谢物单价离子的分辨能力在320~400 之间。但是,降低β值会延长TIMS 分析时间,导致离子谱峰展宽增大以及K值较大离子的信噪比降低[41]。针对该问题,可在TIMS 前端设置离子漏斗对离子进行预存储,提高离子利用效率[31];或者采用非线性洗脱电场[51]仅对目标离子进行高分辨扫描,缩短分析时间。
2 捕集离子迁移谱-质谱联用技术及应用
TIMS既具有超高分辨能力,还可作为离子存储单元独立使用,具有很高的操作灵活性,适合与MS 或其它离子筛选、存储和解离装置进行串级联用。TIMS 结构简单、体积小、操作电压低,不会影响MS整机的体积和性能。飞行时间质谱仪(Time of flight-mass spectrometer,TOF-MS)的单谱分析时间可以低至100 μs,适合与峰宽为ms 级的TIMS 构建TIMS-MS 体系。图2 为已报道的4 种TIMS-MS 仪器结构[52],包括与TOF-MS 联用的顺序分析TIMS(图2A)、并行富集/分析TIMS(图2B)和串级分析TIMS(图2C),以及与傅里叶变换离子回旋共振质谱(Fourier transform ion cyclotron resonance-mass spectrometry,FTICR-MS)联用的门控TIMS(图2D)。上述技术通常采用大气压离子源,TIMS 位于MS 的第一级真空腔内。另外,在质谱仪质量分析器的前级都配有用于离子筛选的四极分析器(Q)和用于离子碎裂、调控及存储的离子碰撞池(CC),可拓展仪器的功能。

图2 TIMS-MS 仪器的四种结构:(A~C)与飞行时间质谱(TOF-MS)联用的顺序分析TIMS、并行富集/分析TIMS和串级分析TIMS;(D)与傅里叶变换离子回旋共振质谱(FTICR-MS)联用的门控TIMS[52]Fig.2 Four existing TIMS-MS instrument configurations:(A–C)Sequetial TIMS,parallel accumulation/analysis TIMS and tandem TIMS coupling to time of flight-mass spectrometry (TOF-MS); (D) Gated TIMS coupling to Fourier transform ion cyclotron resonance-mass spectrometry (FTICR-MS)[52]
2.1 顺序分析捕集离子迁移谱
顺序分析TIMS(图1A)是最早的TIMS 结构,与TOF-MS 联用构建了TIMS-MS 样机(图2A),推动了TIMS 的性能研究并拓展了其应用范围。顺序分析TIMS 的分辨能力、分析速度以及迁移率K的扫描范围可以灵活调节,使其在异构体分离、多组分复杂样品分析和分子结构解析等多类应用中发挥重要作用。
顺序分析TIMS用于同分/同重异构体分离主要得益于其超高分辨能力。使用顺序分析TIMS 分离羟基多溴联苯醚(OH-PBDE)的异构体代谢物,能够区分CCS差异仅为0.6 Å2的3-OH-BDE-47 和5-OHBDE-47,RTIMS达~400[50]。TIMS 检测小肽、脂质和蛋白等分析物时[44,47,53],RTIMS通常为200~300。这已远高于DTIMS和FAIMS等其它IMS 分离手段,是深入探究多价态生物分子的结构变化的有力工具。例如,在分辨能力~70 的DTIMS 中,P 物质的三价离子SPA和SPB均为包络峰,无法确定其中的异构体数量[54];在RTIMS~250 的TIMS 中,可以看到SPA至少含有4 种异构体、SPB至少含有2 种异构体[53]。同样,在研究Ubiquitin 等生物分子时也可发现,TIMS 的分辨能力更高,相比DTIMS可以解析出更多的目标物的天然结构[55]。
基于顺序分析TIMS 的超高分辨能力,在CCS 的基础上为单一m/z的离子提供了新的分离维度,与MS 联用时可以提高质谱峰的峰容量,也解决了MS 中m/z相同的分析物离子无法分离的问题。例如,在电喷雾电离源中得到的聚酰胺离子具有链长分散度高、价态分布宽以及存在同重直链/环链结构等特性,并且每种链长-电荷组合离子的浓度极低。直接MS 分析仅能实现15 聚体以下的测序,但TIMS-MS可将聚酰胺离子的检测范围扩大至100 聚体,并实现同重多环结构聚合体的分离,提供聚合缺陷信息[38]。除可以提高峰容量之外,TIMS 的高离子传输效率也有利于实现复杂样品中超痕量目标组分的检测。例如,分辨能力超过150 的TIMS 与MS 结合可以对泥土中ppbv(10–9)量级的16 种多环芳烃进行准确分离和检测[56]。
顺序分析TIMS 能准确测量离子CCS,其分离分析条件相对温和,结合分子模拟技术可对蛋白质的天然结构进行研究[47,53]。另外,TIMS 能够长时间(秒级)存储离子,还可以研究离子的稳定性和反应活性[57-58]。例如,Schenk 等[57]在研究脱辅基肌红蛋白的动力学中间体时,通过改变TIMS 离子存储时间,发现了铁基原卟啉能够稳定肌红蛋白A、G 和H 螺旋之间的交互作用,而铁基原卟啉丢失会使脱辅基肌红蛋白快速展开。
尽管顺序分析TIMS 具有尺寸小和控制电路简单等优势,但其占空比(离子富集时间与分析周期的比值)通常仅为~50%。不仅使离子的利用率低至~50%,还无法有效缩短TIMS 的分析周期。如果在TIMS 前端设置一个与TIMS 并行工作的离子捕集阱,即可实现占空比~100%,并显著降低TIMS 分析周期,增加单位时间内谱图的采集量。
2.2 并行富集/分析捕集离子迁移谱
在顺序分析TIMS 前端添加一个离子捕集阱,可得到图3 所示的双级阱TIMS[31]。其中,通过延长顺序分析TIMS 的离子分析通道即可得到离子捕集阱,形成并行工作的离子存储区和离子分析区,因此,又称为并行富集/分析TIMS[31]。基于该技术,Bruker 公司于2016 年推出了商品化timsTOFTM仪器。

图3 基于双级阱的并行富集/分析TIMS 的结构图示(A)及工作时序(B)[31]Fig.3 Schematic (A) and working sequence (B) of dual-trap based parallel accumulation/analysis TIMS[31]
并行富集/分析TIMS 的离子富集时间可达100 ms 量级,同时离子存储效率可达80%以上,而洗脱离子峰的半峰宽通常小于1 ms。这相当于将一个恒定连续的弱离子信号压缩成为一个短时间离子脉冲信号,有望将强度提升百倍。Park 等[31]将并行富集/分析TIMS 与MS 联用获得的离子信号与顺序分析TIMS 与MS 联用获得的离子信号进行了对比。在~100%占空比下,并行富集/分析TIMS 经过~47 ms 离子富集时间后,检测m/z1222 离子得到的信号强度约是顺序分析TIMS 信号强度的80 倍。基于并行富集/分析TIMS,还出现了并行富集顺序碎裂(Parallel accumulation-serial fragmentation,PASEF)[59]和非数据依赖并行富集顺序碎裂(diaPASEF)[60-61]等分析方法。上述方法通常与LC-TIMS-MS 结合,用于分析复杂组学样品。结合保留时间、迁移率K、前体离子和碎片离子等信息,可在~60 min 的单次分析中识别上百种未知物。
并行富集/分析TIMS和PASEF 分析方法还可与基质辅助激光解吸电离(Matrix-assisted laser desorption ionization,MALDI)联用,用于生物组织成像分析。Spraggins 等[62]研发出首台MALDI timsTOF-MS 样机,并对小鼠肾脏组织进行成像分析,其空间分辨率达10 μm、分子成像通量可达20 pixels/s。Bruker 公司随后推出了该仪器的商品化版本timsTOF flexTM。相比传统MALDI 成像仪器,该仪器的优势首先在于其实现了迁移率K与m/z的二维分离,显著提高了峰容量。Djambazova 等[63]分析脂类异构体时发现,增加TIMS 分离可将系统峰容量提升2.5 倍以上。另外,在MALDI 与TIMS 联用中,增加第二束激光进行MALDI后电离可进一步提升脂类[64]、小分子和糖类[65]的检测灵敏度。
2.3 串级分析捕集离子迁移谱
将两个顺序分析TIMS 前后设置,并利用离子传输接口实现离子在二者之间的传输,可获得如图4 所示的串级TIMS[32]。其中,前级TIMS-1 与后级TIMS-2 之间的离子传输接口由栅极1、栅极2 和离子偏转电极2 构成。TIMS-1 入口(P1)和出口(P2)以及TIMS-2 入口(P3)和出口(P4)的气压可以独立调节,控制离子在传输接口内按照正向或者逆向方式传输[48]。

图4 串级TIMS 的结构图示[32]Fig.4 Schematic diagram of tandem TIMS[32]
TIMS-1 和TIMS-2 彼此独立,可同时传输/存储离子,也可实现类似双级阱TIMS 的并行富集/分析离子功能,还可实现串级TIMS 的分析功能[52]。离子传输接口的存在,还为串级分析模式增添了更多功能[66]。操控栅极1、栅极2 以及离子偏转电极2 上的电压可在传输接口处实现离子门控筛选、碰撞诱导解离(Collision induced dissociation,CID)和碰撞诱导展开(Collision induced unfolding,CIU)等;此外,向传输接口内引入激光,也能实现大分子的紫外光解离分析[67]。串级TIMS 能够结合不同的操作模式针对需求进行离子操控。最常用的还是利用TIMS-1 筛选具有特定迁移率K的离子,送入传输接口内进行CIU 或CID,然后再送入TIMS-2 进行二次分离。
自上而下的蛋白测序在蛋白结构鉴定、氨基酸序列确定和翻译后修饰位点定位等方面具有巨大的应用前景,通常需要从复杂混合物中分离出多个靶标蛋白分子进行个体分析。串级TIMS 基于迁移率K筛选的CIU 和CID 功能可以满足该需求。Liu 等[32]报道了CCS 为~1300 Å2的Ubiquitin 离子[M+7H]7+被筛选和CIU 产生未折叠异构体的过程(图5A)。串级TIMS 使用相对较低的激发电势就能对完整蛋白离子进行CIU 分析。例如,控制栅极2 和离子偏转极板2 之间的电势差为50 V 就足够使Ubiquitin 离子[M + 7H]7+激发形成CCS 为~1880 和~1950 Å2的两种未折叠异构体离子。Liu 等[32]进一步展示了Ubiquitin 离子[M+8H]8+被筛选和CID 产生碎片化离子的过程(图5B)。当栅极2 和离子偏转极板2 之间的电势差超过190 V 后,Ubiquitin 离子[M+8H]8+开始解离,产生序列覆盖率极高的碎片离子。利用这些an、bn以及yn型碎片离子,即可对母体蛋白分子测序。

图5 (A)Ubiquitin+7 价离子在串级TIMS 中被筛选和碰撞诱导展开(CIU)过程[32];(B)Ubiquitin+8价离子在串级TIMS 中被筛选和碰撞诱导解离(CIU)过程[32]Fig.5 (A) Mobility selection of Ubiquitin +7 ions and their subsequent collision induced unfolding (CIU) at activation potential bias between 0 to 50 V in tandem TIMS[32]; (B) Fragment ion mass spectra resulting from mobility-selection of Ubiquitin +8 ions and their subsequent collision induced dissociation (CID) at activation potential bias between 0 to 260 V in tandem TIMS[32]
2.4 门控捕集离子迁移谱
相比TOF-MS 约105级的质量分辨能力,FTICR-MS可为TIMS-MS提供101~106的质量分辨能力,大大提升了TIMS-MS 分析原油和环境样品等超复杂样品的能力。FTICR-MS获得一张质谱图所需时间在1 s 以上,远大于TIMS 离子谱峰的时间宽度(0.2~1 ms)。为了克服该局限,先后出现了选择性富集[68]和交叠采样选择性富集[69]等方法,实现了TIMS 与FTICR-MS 联用。这些方法都需要对TIMS 分析通道的控制电路进行特殊改造,一方面,无法在其上直接使用并行富集/分析、非线性梯度电场存储等新技术;另一方面,也造成了TIMS-FTICR-MS 与TIMS-TOF-MS实验结果比对性较差。为解决这些问题,出现了门控TIMS(图6)[38]。门控TIMS 的离子分析通道及分析电场的EFG 特征与顺序分析TIMS完全一致。
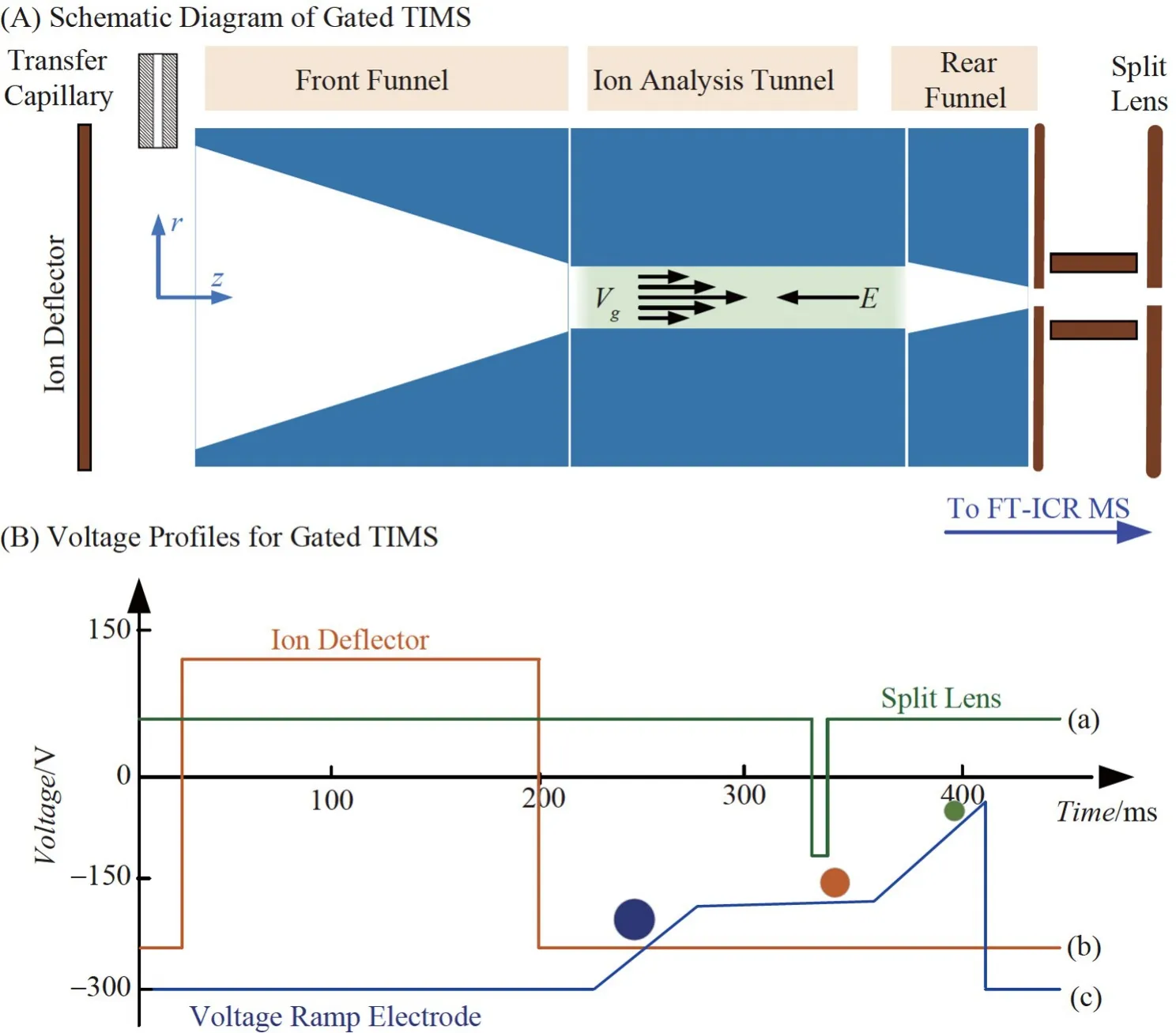
图6 门控TIMS 的结构图(A)及控制电压随时间变化的特征曲线(B)[38]Fig.6 Schematic diagram of gated TIMS (A) and its controlling voltage versus time profiles (B)[38]
门控TIMS 与FTICR-MS 四极分析器之间设置剖开透镜(Split lens),对TIMS洗脱出的目标迁移率K离子选通传输(图6B(a)),FTICR-MS 离子碰撞池(CC)作为存储单元对选通传输的离子进行存储。其中,门控TIMS 采用非线性扫描方式[51]仅对具有目标迁移率K的离子进行缓慢洗脱分析(图6B(c)),可利用较短的TIMS扫描总时间使具有目标迁移率K的离子获得最佳分辨能力,同时保持占空比>50%。门控TIMS 与FTICR-MS 联用系统采用质量数分析与离子累积存储并行的工作方式,在一次FTICR 分析过程中,能够向CC 中至少注入60 次具有目标迁移率K的离子,有利于分析低浓度目标物。通过渐进式改变目标迁移率K的扫描范围,并将所有FTICR-MS谱图结合起来,最终可以获得与TIMS-TOF-MS类似但质量分辨率更高的K-m/z二维谱图。
Fernandez-Lima 等[70]使用门控TIMS 与FTICR-MS 联用样机检测萨旺尼河黄腐酸标准品(SRFA),并与TIMS-TOF-MS 的结果进行比对。由于SRFA 样品过于复杂,当m/z>400 时,TOF-MS 的分辨能力很难识别相邻离子峰,依靠质量分辨仅可识别4950 个目标物,低于TIMS-FTICR-MS可识别目标物(7760 个)。进一步增加TIMS 构象分离后,TIMS-TOF-MS可识别目标物的数量略微提升至7600,而TIMS-FTICR-MS可识别目标物总数则高达22350。Afonso 等[71]将TIMS-FTICR-MS用于原油沥青烯中石油卟啉的分析,在分子水平上对石油卟啉异构体的结构进行了阐释。
3 结论与展望
TIMS 作为一种超高分辨IMS技术,具有结构紧凑、离子传输效率高以及操作灵活等优点,适合与MS 联用构建TIMS-MS 体系,极大地提升了MS谱峰峰容量。自TIMS技术首次提出后,该技术发展迅速,由最初的顺序分析TIMS 结构发展至并行富集/分析TIMS、串级分析TIMS 以及门控TIMS。TIMS 与MS结合可根据需求进行离子操控,不同结构的TIMS-TOF-MS已广泛应用于多肽分析、异构体分离、药物同重组份分析和染色体组蛋白分析等领域;TIMS 与FTICR-MS 联用为超复杂样品(如SRFA)分析提供了新的技术基础;基于双级阱TIMS 的PASEF 技术提升了鸟枪法蛋白组学的分析能力;串级TIMS 也为TIMS-MS 带来了包括自上而下蛋白分析在内的更多应用潜能。此外,将TIMS 与LC-MS 联用也可借助TIMS 分离LC 无法分离的单一m/z离子,实现保留时间、m/z、强度及CCS 的四维分析。
然而,TIMS存在离子存储容量有限、分辨能力与检测灵敏度相矛盾以及样品分析通量低等问题,仍需要进一步改进。另外,TIMS-MS技术相比单一MS 分析仍存在离子损失问题,并且仪器结构及应用潜能也待进一步开发。尽管如此,在未来,TIMS-MS 的应用依然有望快速扩展。

