土壤中木质素降解菌株的筛选及产酶条件优化
王进军 韦慧仙 鲍飞 于昊
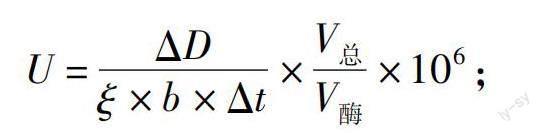
摘要:筛选能高效降解农业废弃物中的主要成分——木质素的菌剂,探究其产酶特性并优化产酶条件。采用涂布平板法分离纯化得到68株菌种,采用PDA-愈创木酚培养基显色试验、PDA-苯胺蓝脱色试验、PDA-氯化锰显色试验进行初筛,测定Lac、Lip、Mnp活性复筛。通过内转录间隔区(ITS)测序法鉴定目标菌株。基于单因素试验和响应面法对菌株产酶能力(培养时间、温度、溶解氧及培养基条件等)进行研究和优化。结果表明,分离的68株菌种经筛选MJ1菌株为目标菌株,分子生态学鉴定其为蓝状菌属真菌Talaromyces siamensis。单因素试验得出菌株的最佳产Lac、Mnp时间为6 d,产Lip时间为10 d,最佳产酶培养温度为30 ℃,摇床转速为120 r/min,接菌量为2%,pH值为5。响应面优化后确定最佳产酶条件为培养温度30.11 ℃,接菌量1.66%,pH值5.22,此最优条件下Lac、Lip、Mnp 3种酶的活性分别为110.41、118.33、218.4 U。提示菌株MJ1在优化后的产酶条件下制得的菌剂能够促进农业废弃物的高效降解,为生物法大规模降解木质素提供参考,也为后续其他相关研究奠定基础。
关键词:木质素;产酶条件;酶活;响应面优化;单因素试验
中图分类号:S182文献标志码:A
文章编号:1002-1302(2023)16-0210-12
收稿日期:2022-10-27
基金项目:国家自然基金面上项目(编号:81873877);教育部留学回国人员科研启动基金(编号:20151098);扬州大学高层次人才科研启动基金;扬州大学“青蓝工程”项目。
作者简介:王进军(1979—),男,江苏海安人,博士,副教授,研究方向为环境微生物学。E-mail:wangjinjun@yzu.edu.cn。
木质素是自然界最丰富的生物资源,同时其也是农业废弃物如秸秆等的主要成分[1-3]。在我国农业生产中,秸秆数量年产量大,2015年秸秆年产量超10.4 亿t,综合利用潜力达8.76 亿t[4-5]。木质素作为其主要成分未能得到充分利用,且大大阻碍了农业废弃物的有效降解[2,6]。处理农业废弃物的方式多种多样,据现有文献显示,与常见的物理化学降解法相比,在处理农业废弃物时采用微生物法具有绿色、清洁和安全的特点,保护环境的同时又提高了废弃物的利用效率[3,7]。在实际生产中也优先选用微生物和木质素降解酶共同作用于饲草,其中青贮是较为理想的加工方式[5,8]。木质素具有复杂而稳定的结构,多与半纤维素以共价键的形式紧密结合,可牢固地黏附在植物的细胞壁上,起到支撑和保护作用,因此其难以被降解利用[9-10]。微生物降解木质素是一种通过多种酶共同参与协同作用的非特异性氧化过程,在参与氧化过程中木质素降解酶先进行自由基链式反应,生成高活性的中介物质,使木质素被氧化为较高的活性自由基,最终形成醌基、醇基等衍生物,又或者产生CO2,从而实现木质素的生物降解[11-12]。参与降解木质素最主要的降解酶为漆酶(Lac)、木质素过氧化物酶(Lip)和锰过氧化物酶(Mnp),其功能各不相同[13-16]。
本研究选择从秸秆还田的土壤中取样,经过初筛与复筛共选出9株菌株,多于目前大多数学者的4~7株菌株,筛选出的目的菌株更多,储备大量能够高效降解木质素的菌种资源。最终鉴别出蓝状菌属真菌Talaromyces siamensis MJ1菌株,并對该株菌的产酶能力进行探究,后续基于响应面法优化高效木质素降解菌产酶能力,为高效木质素降解菌的产酶发酵提供思路,为生物法大规模降解木质素提供参考。
1 材料与方法
1.1 试验材料
1.1.1 样品来源
土壤样品采集自扬州大学农学院水稻秸秆还田和小麦秸秆还田混合土壤的表层土(0~5 cm)。
1.1.2 试验时间与地点
时间:2021年11月至2022年7月;地点:江苏省扬州市扬州大学环境科学与工程学院学行楼微生物实验室。
1.1.3 培养基
木质素分离筛选培养基:木质素4.000 g,硝酸铵0.266 g,硫酸镁0.100 g,磷酸二氢钾2.000 g,磷酸氢二钠0.040 g,琼脂4.000 g,蒸馏水 200 mL,pH值为7.5~8.0。
PDA培养基:马铃薯浸粉5.0 g,葡萄糖20.0 g,氯霉素0.1g,琼脂20.0 g,蒸馏水1 000 mL,pH值为7.5~8.0。
PDA-愈创木酚培养基:马铃薯浸粉10.0 g,葡萄糖40.0 g,氯霉素0.2 g,愈创木酚0.8 mL,磷酸二氢钾6.0 g,硫酸镁3.0 g,琼脂40.0 g,蒸馏水 2 000 mL,pH值为7.5~8.0。
PDA-苯胺蓝培养基:马铃薯浸粉10.0 g,葡萄糖40.0 g,氯霉素0.2 g,苯胺蓝0.8 g,磷酸二氢钾6.0 g,硫酸镁3.0 g,琼脂40.0 g,蒸馏水2 000 mL,pH值为7.5~8.0。
PDA-氯化锰培养基:马铃薯浸粉10.0 g,葡萄糖40.0 g,氯霉素0.2 g,MnCl2·4H2O20.3 g,磷酸二氢钾6.0 g,硫酸镁3.0 g,琼脂40.0 g,蒸馏水 2 000 mL,pH值为7.5~8.0。
液体产酶发酵培养基:葡萄糖20.00 g,硫酸镁0.50 g,硫酸铜0.05 g,硫酸锰0.05 g,pH值为 7.5~8.0。
上述培養基均经过高温高压灭菌(121 ℃、0.1 MPa)20 min后使用。
1.1.4 主要试剂和仪器
葡萄糖、琼脂粉、硝酸铵、磷酸二氢钾、磷酸氢二钠、硫酸镁、四水合氯化锰、硫酸铜、硫酸铵、硫酸锰、酒石酸、酒石酸钠、琥珀酸、琥珀酸钠、冰醋酸等试剂均为国产分析纯;木质素、苯胺蓝、愈创木酚 、藜芦醇、2,2′-联氮-双-3-乙基苯并噻唑啉-6-磺酸(ABTS),均购自合肥博美生物科技有限责任公司。
1.2 木质素降解菌株的分离和筛选
1.2.1 菌株的分离和初筛
称取10 g土样放入含100 mL无菌水的锥形瓶中,置于摇床,30 ℃、150 r/min 恒温振荡30 min,静置15~20 min,吸取上清液依次从10-1稀释至10-7,分别取各浓度稀释液500 μL涂布至木质素分离筛选培养基中,30 ℃培养7~9 d,挑选出生长较好且菌丝形态各异的菌株至PDA培养基上,不断划线分离直至得到单菌落。采用点种法将单菌落分别接种至PDA-愈创木酚培养基、PDA-苯胺蓝培养基、PDA-氯化锰培养基上,30 ℃培养7~9 d,观察是否产生红棕色氧化圈、脱色圈、褐棕色显色圈,并记录它们的直径大小,依次验证是否具有产Lac、Lip、Mnp的能力,筛选出直径大的菌株保存备用。
1.2.2 菌株的复筛
将上述筛选出来的菌株接种至液体产酶发酵培养基中,28 ℃、150 r/min恒温振荡发酵11 d,测定发酵液的酶活性。
1.3 粗酶液的制备
取发酵液2 mL,4 ℃、8 000 r/min离心10 min,所得上清液即为粗酶液。
1.4 酶活性测定
Lac活性测定采用ABTS法,Lac活性单位定义:每1 min氧化1 μmol ABTS所需的酶量为1个酶活性单位(U);Lip活性测定采用藜芦醇法,Lip活性定义:每1 min氧化1 μmol藜芦醇所需的酶量为1个酶活性单位(U);Mnp活性测定:采用MnSO4法,Mnp活性定义:每1 min将1 μmol Mn2+转化为Mn3+所需的酶量为1个酶活性单位(U)。
计算公式:
式中:U表示酶活性;ΔD表示吸光度;ξ表示摩尔消光系数,M·cm;b表示比色皿厚度,cm;Δt表示反应时间,min;V总表示反应体系体积,mL;V酶表示加入酶的体积,mL。
已知420 nm处ABTS摩尔消光系数ξ420=3.6×104L/(mol·cm),340 nm处藜芦醇摩尔消光系数ξ340=6.5×103L/(mol·cm);240 nm处Mn3+摩尔消光系数ξ240=6.5×103L/(mol·cm)。
1.5 菌株鉴定
提取菌株MJ1的DNA,然后对菌株内源转录间隔区(ITS)序列进行PCR扩增,将所得产物送至生工生物工程(上海)股份有限公司进行测序,于NCBI数据库将测序结果进行Blast比对,选取同源性较高的基因序列通过MEGA 7.0软件构建系统发育树,并根据系统发育树进行对比分析。
1.6 菌株MJ1产酶条件的单因素试验
1.6.1 最佳培养时间
将种子液以1%接菌量接入到产酶培养基,设置摇床转速为150 r/min,温度为28 ℃,产酶培养基初始pH值为7.0。对于Lac活性,设置培养时间5、6、7、8、9 d;对于Lip活性,设置培养时间9、10、11、12、13 d;对于Mnp活性,设置培养时间5、6、7、8、9、10 d。3次平行重复,确定最佳培养时间。
1.6.2 最佳培养温度
将种子液以1%接菌量接入到产酶培养基,设置摇床转速为150 r/min,分别培养测定Lac、Lip、Mnp活性,产酶培养基初始pH值为7.0。设置培养温度为20、25、30、35、40 ℃。3次平行重复,确定最佳培养温度。
1.6.3 最佳摇床转速
将种子液以1%接菌量接入到产酶培养基,温度28 ℃,分别培养、测定Lac、Lip、Mnp活性,产酶培养基初始pH值为7.0。设置摇床转速为90、120、150、180、210 r/min。3次平行重复,确定最佳摇床转速。
1.6.4 最佳接菌量
设置摇床转速为150 r/min,温度为28 ℃,分别培养、测定Lac、Lip、Mnp活性,产酶培养基初始pH值为7.0。设置种子液接菌量为1.0%、2.0%、4.0%、8.0%、12.0%。3次平行重复,确定最佳接菌量。
1.6.5 最佳初始pH值
将种子液以1%接菌量接入至产酶培养基,温度为28 ℃,摇床转速为 150 r/min,分别培养测定Lac、Lip、Mnp活性。设置产酶培养基的初始pH值为4、5、6、7、8。3次平行重复,确定最佳初始pH值。
1.7 菌株MJ1产酶条件的响应面试验
在单因素试验的基础上,选取对Lac、Lip、Mnp活性影响显著的3个因素,通过Box-Behnken设计3因素3水平试验对菌株MJ1的产酶能力进行响应面优化,确定最佳产酶条件并验证。
2 结果与分析
2.1 木质素降解菌株的分离和筛选
2.1.1 菌株的分离和初筛
分离出68株木质素降解菌株的生长情况详见表1:共29株菌株生長良好,并且长出菌丝,选取备用留做初筛。
PDA-愈创木酚平板显色反应见图1,显色结果见表2,共14株菌株出现氧化圈时间早且出现的氧化圈直径大,表明它们产Lac的能力较强,选取备用留作进一步初筛。
PDA-苯胺蓝平板脱色反应见图2,脱色结果见表3,共11株菌株出现脱色圈时间早且出现的脱色圈直径大,表明它们产Lip、Mnp的能力较强,选取备用留作进一步初筛。
PDA-氯化锰平板显色反应见图3,显色结果见表4,共9株菌株出现显色圈时间早且出现的氧化圈直径大,表明它们产Mnp的能力较强,选取备用留作后续试验菌株。
2.1.2 菌株的复筛
于培养3、7、11 d后测定菌株的Lac、Lip、Mnp酶活结果,由图4~图6可知,菌株MJ1的Lac最大活性显著高于其他菌株,最大值为62.49 U;菌株MJ1的Lip最大活性显著高于其他菌株,最大值为79.22 U;由图6可知,菌株MJ1的MnP最大活性显著高于其他菌株,最大值为 153.63 U。因此,选取菌株MJ1作为后续研究的目的菌株。
2.2 菌株鉴定
将测序结果通过NCBI数据库进行Blast比对,选取与目的菌株相似性高的菌株,通过MEGA 7.0软件构建系统发育树,由图7可知,菌株MJ1和蓝状菌属(Talaromyces)真菌在系统发育树中处于同一支,经比对,菌株MJ1与Talaromyces siamensis A3S2-40(KJ767055)菌株的同源性达99%,因此,菌株MJ1与蓝状菌属的亲缘关系最近,初步鉴定MJ1为蓝状菌属真菌Talaromyces siamensis MJ1。
2.3 菌株MJ1产酶条件的单因素试验结果
由图8可知,不同培养时间对菌株的Lac、Lip、Mnp活性有极大影响,且影响趋势均先上升后下降。 Lac活性培养至6 d时达最大值,为74.86 U;Lip活性培养至10 d时达最大值,为86.53 U;Mnp活性培养至6 d时达最大值,为164.29 U。因此,后续分别在6、10、6 d测定Lac、Lip、Mnp的活性。
由图9可知,不同培养温度对菌株的Lac、Lip、Mnp活性影响很大,温度范围在25~35 ℃之间时,3种酶的活性均较大,在30 ℃时,3种酶的活性均达最佳,分别为83.00、94.49、185.13 U。因此,选取25~35 ℃进行后续的响应面试验。
由图10可知,不同摇床转速对菌株的Lac、Lip、Mnp活性影响很大,当摇床转速为120 r/min时,3种酶的活性达最佳,分别为83.17、97.94、180.22 U。因此,后续试验的摇床转速统一设定为120 r/min。
由图11可知,不同接菌量对菌株的Lac、Lip、Mnp活性影响很大,接菌量范围在1%~4%之间时,3种酶的活性均较大,接菌量为2%时,3种酶的活性均达顶峰,分别为95.15、104.85、194.40 U。因此,选取1%~4%接菌量作为后续的响应面试验范围。
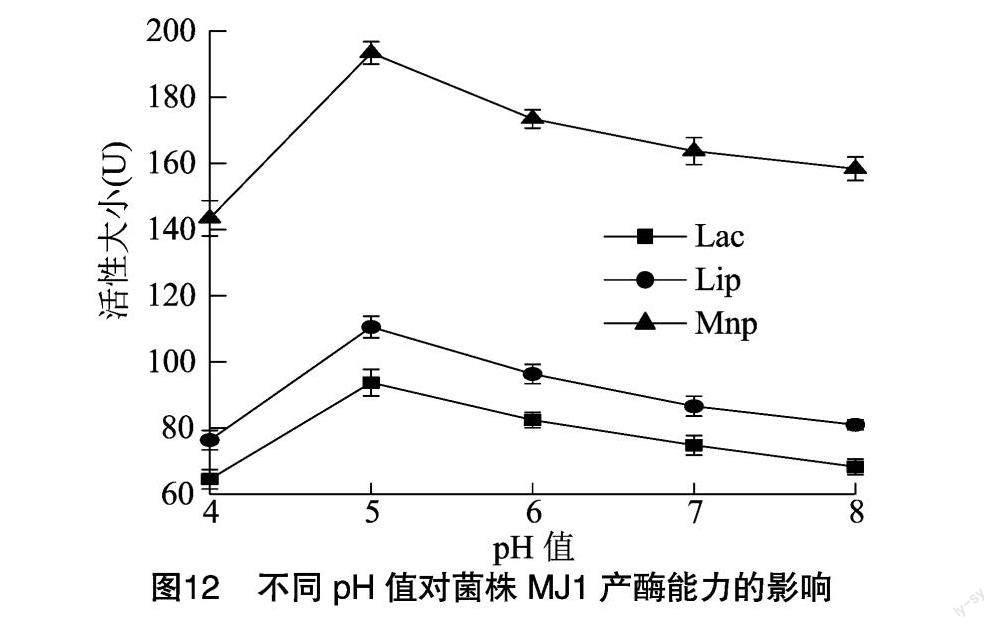
由图12可知,产酶培养基的初始pH值不同,Lac、Lip、Mnp的活性也不同,pH值范围在4~6之间时,3种酶的活性均较大,pH值为5时,3种酶的活性均达最佳,分别为93.71、110.53、193.34 U。因此,产酶培养基初始pH值选取4~6进行后续的响应面试验。
2.4 菌株MJ1产酶条件的响应面试验结果与分析
2.4.1 模型的建立及显著性检验
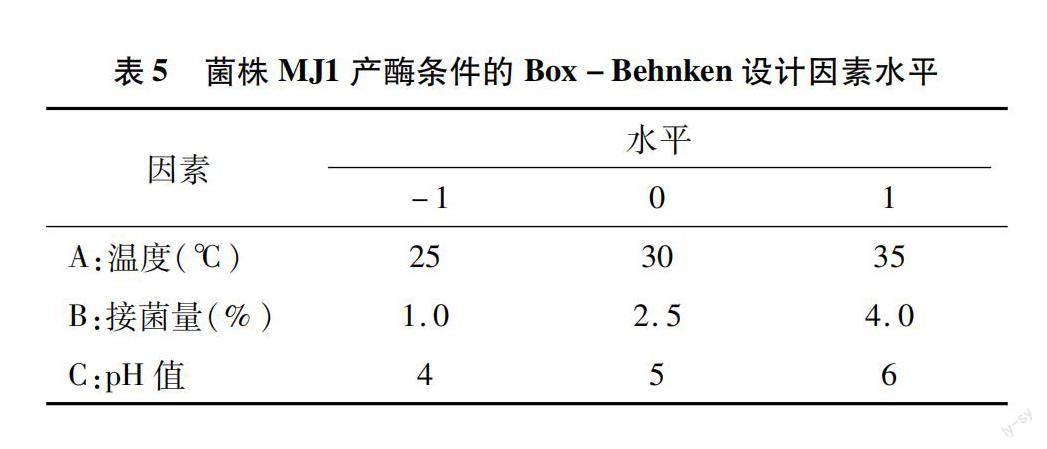
根据单因素试验结果,由表5、表6可知,选取对MJ1的Lac、Lip、Mnp活性影响较大的3个因素:温度(25、30、35 ℃)、接菌量(1.0%、2.5%、4.0%)、产酶培养基的初始pH值(4、5、6)进行Box-Behnken试验,分别以Lac、Lip、Mnp活性大小为响应值,进行响应面优化试验,Box-Behnken试验因素及水平设置见表5,试验结果见表6。
利用Design Expert(Version 8.0.6)进行多元拟合,得到回归方程。其中,Lac活性回归方程为Y=104.73+0.66A-2.00B+8.46C+0.57AB+3.16AC-0.89BC-26.42A2-1.84B2-17.96C2;Lip活性回归方程为Y=118.79+0.47A-1.94B+5.08C+0.82AB+3.02AC-1.07BC-20.68A2-2.84B2-15.87C2;Mnp活性回归方程为Y=118.79+0.47A-1.94B+5.08C+0.82AB+3.02AC-1.07BC-20.68A2-2.84B2-15.87C2。
对上述方程进行方差和显著性分析,由表7~表9可知,Lac、Lip、Mnp活性对应模型的P值<0.000 1,表明影响极显著;失拟项P>0.05,不显著,表明模型可靠性较高;模型决定系数R2>0.9,模型矫正系数R2adj>0.9,R2adj与模型判定系数R2pred两者的差<0.2,表明模型与试验情况拟合度高;信噪比(S/N)>4,从另一个角度表明模型可靠,利用该模型方程预测菌株MJ1的最佳产酶条件。方差分析结果表明,各因素对Lac活性的影响表现为因素C>因素B>因素A,即pH值>接菌量>培养温度。一次项A、B、C对结果影响极显著(P<0.01), 交互项AC对结果影响极显著(P<0.01),BC对结果影响显著(P<0.05),二次项A2、B2、C2对结果影响极显著(P<0.01);各因素对Lip活性的影响表现为因素C>因素B>因素A,即pH值>接菌量>培养温度。一次项B、C对结果影响极显著(P<0.01),交互项AC对结果影响极显著(P<0.01),BC对结果影响显著(P<0.05),二次项A2、B2、C2对结果影响极显著(P<0.01);各因素对Mnp活性的影响表现为因素C>因素B>因素A,即pH值>接菌量>培养温度。一次项B、C对结果影响极显著(P<0.01),交互项AC、BC对结果影响极显著(P<0.01),二次项A2、C2对结果影响极显著(P<0.01)。
2.4.2 响应面分析
由培养温度、接菌量、pH值3个因素间的交互作用对Lac、Lip、Mnp活性大小影响的响应面曲线及等高线(图13~图21)可知,接菌量和培养温度交互作用对Lac、Lip、Mnp活性影响等高线呈闭合的椭圆形,表明交互作用对Lac、Lip、Mnp活性影响显著,固定pH值,Lac、Lip、Mnp活性随着接菌量和培养温度的升高呈先上升再下降的趋势,温度范围为 29~31 ℃,接菌量范围为 2.2%~2.8%时,3种酶活性达最大值;培养温度和pH值交互作用对Lac、Lip、Mnp活性影响等高线趋近于圆形,表明交互作用对Lac、Lip、Mnp活性影响不显著,固定接菌量,Lac、Lip、Mnp活性随着温度和pH值的升高呈先上升再下降的趋势,温度范围为29~31 ℃,pH值范围为4.5~5.5时,3种酶活性达最大值;接菌量和pH值交互作用对Lac、Lip、Mnp活性影响等高线呈闭合的椭圆形,表明交互作用对Lac、Lip、Mnp活性影响显著,固定温度,Lac、Lip、Mnp活性随着接菌量和pH值的升高同样呈先上升再下降的趋势,接菌量范围为2.2%~2.8%,pH值范围为4.5~5.5时,3种酶活性达最大值。
利用软件DesignExpert(Version 8.0.6)求解响应值Y1、Y2、Y3所对应的3种模型,得出产Lac、Lip、Mnp 3种酶同时达最优的条件为:温度30.11 ℃、接菌量1.66%、pH值为5.22,此时,Lac、Lip、Mnp 3种酶活性分别为109.39、119.47、227.75 U。为验证响应面优化的可靠性,采用上述条件进行试验,因考虑试验中现实操作情况,将优化条件修正为:温度30.1 ℃、接菌量1.66%、pH值为5.2,得到Lac、Lip、Mnp 3 种酶活性分别为110.41、118.33、218.40 U,和模型预测的结果相差较小,因此,采用Box-Behnken响应面优化法对菌株MJ1的产酶能力进行优化具有可行性,具有一定的实际应用价值。
3 讨论与结论
在秸秆还田的表层土壤中,能降解木质素的微生物分布广泛,因此研究从秸秆还田的试验田中采集样品。筛选能够降解木质素的微生物方法多种多样,本研究的筛选方法基于其他学者的研究,并结合自身试验环境特点而制定。试验中制备以木质素为唯一碳源的培养基,分离、初筛出具有木质素降解能力的菌株共68株,通过显色试验及褪色试验复筛出具有较强木质素降解能力的菌株共9株。王福玲等通過配置富集培养基、显色试验进行分离和初筛,测定酶活性大小进行复筛[17-18];韩月颖等则是直接通过显色培养基进行分离和初筛,测定酶活性大小进行复筛[19-20]。本研究相较于以上研究的优势在于筛选出的目的菌株更多,可供后续研究选择的菌株更多,研究内容涵盖面广泛。微生物降解木质素能力的强弱一般通过分泌木质素水解酶的能力来决定,木质素水解酶系主要由Lac、Lip、Mnp组成。根据分泌3种水解酶能力的大小进一步从9株菌株中筛选出木质素降解能力最强的菌株,并通过生物学鉴定为蓝状菌属真菌,命名为Talaromyces siamensis MJ1。李雅琳等从园林绿化废弃物中筛得的菌株经鉴定为栓菌属真菌[21];刘剑等从腐烂的竹材中筛得的菌株经鉴定为杂色云芝[22];尹静等从腐质土中筛得的菌株经鉴定为粉红黏帚霉[23],这些均表明自然界可降解木质素的真菌种类繁多,从不同样品中筛得的菌株种类各异,不同种类的菌株分泌3种水解酶的能力也大相径庭[24]。
不同环境下菌株分泌木质素水解酶的能力有所差异,本研究通过单因素试验得到:菌株的最佳产Lac、Mnp时间为6 d,最佳产Lip时间为10 d,MJ1菌株最佳产酶培养温度为30 ℃,摇床转速为 120 r/min,最适接菌量为2%,最适pH值为5时,菌株的3种水解酶活性达最大值,各种条件下培养的菌株3种水解酶中Mnp活性均显著高于另外2种酶的活性。姜明国等筛选出来的菌株通过试验得出最佳产Lac时间为15 d,最佳产Lip的时间为 9 d,而Mnp活性一直很低,每天几乎无变化,3种水解酶中Lac活性显著高于另外2种酶的活性[25];从李新鑫等对其筛选的菌株通过产酶性质研究得出Lac活性在15 d达峰值,Mnp活性在23 d达峰值,而整个产酶周期中,Lip活性一直很低,每天几乎无变化,Lac活性在3种水解酶中要显著高于另外2种水解酶的活性[18];王茂成等的目的菌株Lac、Lip、Mnp最大活性均出现在9 d,整体上Lac活性均显著高于Lip、Mnp的活性,目的菌株的最适培养温度为20 ℃和30 ℃[26]。结合多人试验研究推测不同的产酶培养基、生长环境、目的菌株的筛选条件等均会对木质素降解菌最佳产水解酶时间产生很大影响,不同目的菌株分泌各个木质素水解酶的能力不同,产Lac能力强的菌株,降解木质素时木质素降解酶系中Lac相应地会参与更多,产Mnp能力更强的菌株,降解时Mnp相应地就会参与更多。此外,不同的木质素降解菌株在不同培养条件下产酶能力会有很大的不同,因此需要为这些菌株创造对应的良好培养条件。
通过响应面优化后MJ1菌株的最适培养温度为30.11 ℃,最适接菌量为1.66%,最适pH值为5.22,通过回归方程预测最优条件下的最佳酶活性大小与实际试验得出的结果相差较小,表明优化结果可靠,且3种水解酶活性具有显著提升。李灵灵等通过响应面优化法,使菌株对木质素的降解率从24.1%提高到了32.8%[27];韩月颖等也通过响应面优化法使菌株的产Lac、Lip、Mnp能力得到显著提高[19];泊翠翠通过响应面优化法使Lac活性提高0.54倍,Mnp活性提高0.3倍[28]。这些研究表明通过响应面优化法可极大地使菌株的产酶能力得到提高,从而能够更快地降解木质素。优化过程及结果对菌株降解木质素的实际应用具有指导意义,也对功能菌的具体应用提供参考。
综上所述,本研究筛选出的MJ1菌株产酶效果显著,能高效降解木质素,为农业废弃物秸秆等的资源化利用提供了试验依据。
参考文献:
[1]Wang H L,Pu Y Q,Ragauskas A,et al. From lignin to valuable products-strategies,challenges,and prospects[J]. Bioresource Technology,2019,271:449-461.
[2]赵煜涵,郭俊江. 木质素的降解及其应用概述[J]. 胶体与聚合物,2021,39(2):90-94.
[3]Wang M,Ma J P,Liu H F,et al. Sustainable productions of organic acids and their derivatives from biomass via selective oxidative cleavage of C-C bond[J]. ACS Catalysis,2018,8(3):2129-2165.
[4]霍丽丽,赵立欣,孟海波,等. 中国农作物秸秆综合利用潜力研究[J]. 农业工程学报,2019,35(13):218-224.
[5]任仲杰,顾孟迪. 我国农作物秸秆综合利用与循环经济[J]. 安徽农业科学,2005,33(11):2105-2106.
[6]崔玉虎,王 奇,苟光俊,等. 木质素催化降解液化的研究进展[J]. 材料导报,2017,31(5):112-116,133.
[7]Amidon T E,Liu S J.Water-based woody biorefinery[J]. Biotechnology Advances,2009,27(5):542-550.
[8]Binod P,Kuttiraja M,Archana M,et al. High temperature pretreatment and hydrolysis of cotton stalk for producing sugars for bioethanol production[J]. Fuel,2012,92(1):340-345.
[9]白长胜,刘秋瑾,尹珺伊,等. 产木质纤维素降解酶真菌的筛选及产酶特性[J]. 微生物学通报,2023,50(3):1098-1110.
[10]Chen X L,Yu J,Zhang Z B,et al. Study on structure and thermal stability properties of cellulose fibers from rice straw[J]. Carbohydrate Polymers,2011,85(1):245-250.
[11]趙秀云,赵昕宇,杨津津,等. 堆肥过程中木质素的降解机理及影响因素研究进展[J]. 环境工程,2021,39(6):128-136.
[12]Tuomela M,Vikman M,Hatakka A,et al. Biodegradation of lignin in a compost environment:a review[J]. Bioresource Technology,2000,72(2):169-183.
[13]倪启亮,王敦球,戚拓业. 木质素降解酶的酶活测定方法探讨[J]. 广西农学报,2008,23(2):54-57.
[14]Hemati A,Nazari M,Lajayer B A,et al. Lignocellulosics in plant cell wall and their potential biological degradation[J]. Folia Microbiologica,2022,67(5):671-681.
[15]Pollegioni L,Tonin F,Rosini E.Lignin-degrading enzymes[J]. FEBS Journal,2015,282(7):1190-1213.
[16]Zeng J J,Mills M J L,Simmons B A,et al. Understanding factors controlling depolymerization and polymerization in catalytic degradation of β-ether linked model lignin compounds by versatile peroxidase[J]. Green Chemistry,2017,19(9):2145-2154.
[17]王福玲. 木质素降解菌株的筛选及其与离子液体预处理生物质的研究[D]. 哈尔滨:东北农业大学,2018:16-18.
[18]李新鑫,余学军,俞 暾,等. 竹林环境中木质素降解菌株的分离鉴定[J]. 竹子学报,2016,35(2):20-25.
[19]韩月颖,张喜庆,曲云鹏,等. 一株低温木质素降解菌的筛选、产酶优化及酶学性质[J]. 微生物学通报,2021,48(10):3700-3713.
[20]张芳芳,张 桐,戴 丹,等. 高效木质素降解菌的筛选及其对玉米秸秆的降解效果[J]. 菌物学报,2021,40(7):1869-1880.
[21]李雅琳,李素艳,孙向阳,等. 1株木质素降解菌的筛选、鉴定及液态发酵条件优化[J]. 浙江农林大学学报,2021,38(6):1297-1304.
[22]刘 剑,李南林. 竹材木质素降解菌的筛选与鉴定[J]. 林业与环境科学,2020,36(1):30-35.
[23]尹 静,刘悦秋,于 峰,等. 一株木质素降解菌的筛选鉴定及其在堆肥中的应用[J]. 中国土壤与肥料,2019(3):179-185.
[24]Bugg T D,Ahmad M,Hardiman E M,et al. The emerging role for bacteria in lignin degradation and bio-product formation[J]. Current Opinion in Biotechnology,2011,22(3):394-400.
[25]姜明国,黎海菲,陆冠颖,等. 木质素降解菌Bax的筛选及特性研究[J]. 生物技术通报,2011(3):200-203.
[26]王茂成,李 勇,李世忠,等. 木质素降解真菌的分离与相关酶活性测定及产酶条件优化[J]. 西南师范大学学报(自然科学版),2013,38(11):122-126.
[27]李灵灵,王敬红,赵 铎,等. 木质素降解菌BYL-7的筛选及降解条件优化[J]. 微生物学通报,2020,47(12):4059-4071.
[28]泊翠翠. 木质素降解酶高产菌株的筛选及酶学性质研究[D]. 沈阳:沈阳农业大学,2018:41.

