他克莫司治疗重症肌无力疗效观察
颜聪亚,顾珊珊,赵 帅,乞国艳,尹少华
(1. 石家庄市人民医院,河北 石家庄 050030;2. 邢台市人民医院,河北 邢台 054001)
重症肌无力(MG)是一种累及神经-肌肉接头的自身免疫性疾病,主要表现为骨骼肌无力,症状呈晨轻暮重特点[1]。该病的发病机制复杂,乙酰胆碱受体抗体 (AChR-Ab)、抗肌肉特异性酪氨酸激酶抗体(MUSK-Ab)、抗低密度脂蛋白受体相关蛋白4抗体( LRP4-Ab)与MG的发病均有密切关系[2-4]。近年来,MG的诊断水平不断提高,治疗手段逐步增多,但并没有标准的治疗方案,治疗时需根据患者年龄、并发症、禁忌证、疾病的临床分型、对治疗的反应等调整方案[1]。目前治疗MG的药物主要有糖皮质激素、胆碱酯酶抑制剂、免疫抑制剂、静脉注射免疫球蛋白、新型免疫调节剂、单克隆抗体等。其中胆碱酯酶抑制剂主要是减轻肌无力的症状,但不能影响自身抗体的产生。糖皮质激素是治疗MG最有效也是最常用的药物,几乎对所有类型MG有效,临床中70%~75%的患者治疗后症状明显改善,且起效快[5],但该类药物存在多种不良反应,会严重影响患者的生活质量[6],除此之外,临床上有一部分MG患者对糖皮质激素的治疗反应差。硫唑嘌呤是治疗MG的一线免疫抑制剂,但通常需要3~6个月起效;环磷酰胺存在潜在的严重不良反应,限制了其在临床上的广泛应用[7]。他克莫司是一种钙调磷酸酶抑制剂,属于强力的新型免疫抑制剂,因具有起效快、不良反应小等优点在移植领域得到广泛应用,也被推荐为MG免疫治疗的二线药物,应用越来越广泛[8]。目前国外有研究认为他克莫司可替代硫唑嘌呤[9]。本研究观察了他克莫司治疗MG患者的有效性、安全性及对胸腺瘤可能的影响,旨在为不能耐受糖皮质激素和其他免疫抑制剂或对其疗效差、或既往合并胸腺瘤病史的MG患者提供有效治疗方案。
1 资料与方法
1.1诊断标准 ①典型的临床表现:眼睑下垂、复视、咀嚼吞咽费力、言语不清、四肢无力等,活动后加重,休息后减轻,呈晨轻暮重;②新斯的明试验阳性;③AChR-Ab阳性;④肌电图:重复频率电刺激呈低频衰减,高频无递增。符合①+②或③或④中任一项者可以明确诊断。其中AChR-Ab对于诊断MG特异性强,是诊断MG的金标准,但AChR-Ab阴性并不能排除 MG 的诊断[10]。
1.2分型标准 采用美国重症肌无力基金会(MGFA)临床分型标准(由2000年美国重症肌无力协会提出),分为Ⅰ、Ⅱ、Ⅲ、Ⅳ、Ⅴ型,其中Ⅱ、Ⅲ、Ⅳ型中还分为Ⅱa、Ⅱb、Ⅲa、Ⅲb、Ⅳa、Ⅳb型。
1.3纳入标准 在河北省重症肌无力临床医学研究中心成员单位中明确诊断为MG,有糖皮质激素使用禁忌证或对其他免疫抑制剂(硫唑嘌呤、环孢素、吗替麦考酚酯)不耐受或疗效差者;治疗过程中允许联合溴吡斯的明,剂量<360 mg/d;受试者均签署知情同意书。
1.4排除标准 ①对他克莫司或大环内酯类抗生素过敏者;②合并感染者;③合并类风湿关节炎、肌炎、皮肌炎等自身免疫性疾病及其他恶性肿瘤者;④合并肝肾功能不全、心力衰竭、严重糖尿病者;⑤备孕、已妊娠或需哺乳者;⑥由于精神或心理疾病导致不能配合治疗者;⑦基线时重症肌无力日常生活量表(MG-ADL)评分、重症肌无力肌群耐力评分量表(MGMES)评分为0分者;⑧在开始应用他克莫司前1个月内曾应用免疫球蛋白或血浆置换或行胸腺切除术者。
1.5一般资料 本研究获得石家庄市人民医院伦理委员会批准(第90号),以2020年2月—2022年2月就诊于河北省重症肌无力临床医学研究中心成员单位并确诊为MG的63例患者为研究对象。其中男30例,女33例;年龄(57.8±12.2)岁,其中≤50岁18例,>50岁45例;MGFA临床分型:Ⅰ型(眼肌型)8例,Ⅱa型12例,Ⅱb型15例,Ⅲa型11例,Ⅲb型7例,Ⅳa型5例,Ⅳb型5例,Ⅴ型0例;胸腺切除术后20例,其中胸腺瘤术后6例,胸腺增生术后14例。
1.6治疗方案 患者均给予他克莫司(国药集团川抗制药有限公司,国药准字H20080457)治疗,起始剂量为3 mg/d(早1 mg,晚2 mg),均为餐前1 h或餐后2 h空腹口服;2 周后检测他克莫司血药浓度,结合他克莫司血药浓度、不良反应、临床疗效,调整他克莫司剂量或针对不良反应给予对症治疗。他克莫司维持剂量为2~6 mg/d,他克莫司血药浓度维持在5~10 nmol/L。
1.7观察指标
1.7.1MG-ADL评分、MGMES评分及血清AChR-Ab水平 记录治疗前、治疗1个月、治疗3个月和治疗6个月时MG-ADL评分、MGMES 评分及血清AChR-Ab水平。其中 MG-ADL量表包含8个条目(说话、咀嚼、吞咽、呼吸、刷牙或梳头能力受损、站起困难、复试、眼睑下垂),采用4级评分法,0分为正常,1分为轻度,2分为中度,3分为重度,总分为0~24分,分值越高提示MG症状越重。MGMES量表包含眼肌(上睑遮挡角膜,钟表位)、头肌、颈肌、四肢及躯干肌、球部肌、呼吸肌共13个条目,采用4级评分法,左右分别计分(0~3分),其中球部肌及呼吸肌加权计分(0~25分),总分为0~100分,得分越高提示症状越重[11]。
1.7.2临床疗效 治疗1个月、3个月、6个月后各评估1次疗效。判定方法为口服溴吡斯的明4 h后,由2~3名重症肌无力专科医师共同对患者进行临床绝对评分和临床相对评分。临床绝对评分包括上睑无力、眼球水平活动、上睑及上下肢疲劳试验、面肌无力、咀嚼吞咽功能、呼吸肌功能8个条目,采用5级评分法,左右分别计分(0~4分),对咀嚼吞咽困难及呼吸困难程度采用双倍记分(0~8分),总分为0~60分,分值越高提示症状越重[12];临床相对评分=(治疗前绝对评分-治疗后绝对评分)/治疗前绝对评分100%。疗效评价标准:临床相对评分≥90%为痊愈,临床相对评分50%~89%为显效,临床相对评分25%~49%为好转,临床相对评分<25%为无效。痊愈+显效+好转为总有效。
1.7.3胸腺瘤复发情况及不良反应发生情况 对有胸腺瘤病史的6例患者,在治疗1个月、6个月、12个月时复查胸腹CT,观察是否存在胸腺瘤复发;监测所有患者治疗过程中血清肌酐、尿素氮、丙氨酸氨基转移酶、天冬氨酸氨基转移酶水平,如高于正常上限定义为肝肾功能受损;同时观察并记录患者他克莫司治疗相关的不良反应发生情况。
2 结 果
63例患者均完成6个月的他克莫司治疗,其中合并胸腺瘤的患者完成12个月的他克莫司治疗。
2.1治疗不同时间点MG-ADL评分、MGMES评分及血清AchR-Ab水平 治疗1个月后,患者MG-ADL评分、MGMES评分及血清AchR-Ab水平与治疗前比较差异均无统计学意义(P均>0.05);治疗3个月、6个月后MG-ADL评分、MGMES评分及治疗6个月后血清AchR-Ab水平均明显低于治疗前(P均<0.05)。见表1。
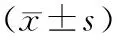
表1 63例重症肌无力患者治疗不同时间点MG-ADL评分、MGMES 评分及血清AchR-Ab水平比较
2.2治疗不同时间点临床疗效 他克莫司治疗1个月后总有效率为9.52%,治疗3个月后为46.03%,治疗6个月后为69.84%。见表2。
2.3胸腺瘤复发情况及治疗安全性 有胸腺瘤病史的6例患者,各时间点复查胸腹CT均未发现胸腺瘤复发。在治疗期间,有5例(7.94%)患者出现不良反应,其中腹泻1例,血糖升高2例,双手震颤1例,肌酐升高1例,所有不良反应均为轻度,减量或对症处理后均缓解,均未停药,未发现尿素氮、丙氨酸氨基转移酶、天冬氨酸氨基转移酶升高者,无死亡者。

表2 63例重症肌无力患者他克莫司治疗不同时间点疗效 例(%)
3 讨 论
MG病变部位在神经和肌肉连接处,由于免疫抗体阻断了神经与肌肉的连接,导致不能传导神经到肌肉的指令,进而造成肌肉无力[13]。免疫抑制剂治疗MG的目的是降低自身免疫反应,以达到长期的临床缓解。常用的免疫抑制剂有糖皮质激素、硫唑嘌呤、环孢素、环磷酰胺、吗替麦考酚酯等,但部分患者对传统的免疫抑制剂疗效不满意,或因严重的不良反应而停药。比如激素可以引起向心性肥胖、高血糖、高血压、骨质疏松、加重或诱发感染,严重者致不可逆的股骨头坏死,部分患者在递减激素的过程中出现肌无力的复发;老年患者免疫功能低下,常常合并心脑血管疾病、糖尿病或骨质疏松,这也限制了糖皮质激素的应用。
他克莫司可以选择性地抑制辅助T细胞,抑制白细胞介素-2的转录,进而产生较强的免疫抑制作用[14],一般2周左右起效。李久伟等[15]对28例糖皮质激素依赖性MG患儿加用他克莫司治疗并随访,结果显示随着治疗时间的延长,MG-ADL绝对评分呈逐渐降低趋势,约一半的患儿在治疗1个月时病情好转,80%患儿于治疗 3 个月时病情得到改善。本研究中发现,他克莫司治疗1个月后MG-ADL和MGMES评分与治疗前相比下降不明显,治疗3个月和6个月的MG-ADL和MGMES评分明显下降,且随着治疗时间的延长,评分逐步降低,提示他克莫司起效时间可能在1个月之后,尤其是在治疗3个月时疗效最明显。结合既往文献,可将3个月作为评价他克莫司是否有效的时间节点。
目前越来越多的研究表明他克莫司治疗MG起效快,可以缓解MG所有的临床症状,特别是上睑下垂和球部症状[16],可以作为MG患者的首选,特别是年轻的、症状轻、AchR-ab滴度低的患者[17]。本研究结果显示,随着治疗时间的延长,他克莫司治疗总有效率逐步升高,治疗6个月后达到69.84%。本研究中的患者大部分为晚发型MG,提示晚发型MG患者可以优先选择他克莫司,这和日本的研究结果一致[18]。
AchR-Ab是MG最常见的致病抗体,目前检测AChR-Ab主要用于MG的诊断,但其滴度的高低与MG病情的严重程度及预后的关系不明确[4,19]。有研究发现,临床稳定缓解的MG患者,AchR-Ab抗体滴度低,随病情的加重,抗体滴度水平呈递增趋势[20-22],提示症状重的MG患者,其AChR-Ab滴度也高。 Aguirre等[22]研究提示AChR-Ab滴度与MG患者症状的严重程度明显相关,可以判断MG患者临床症状是否严重。 Borges等[23]研究提出了“AChR-Ab降低率”的概念,“AChR-Ab降低率”可以预测MG患者的预后。本研究发现,他克莫司治疗1个月、3个月后AchR-Ab下降不明显,治疗6个月后明显下降,提示AChR-Ab滴度的变化对评估MG患者治疗疗效及预后有一定的参考意义。
目前关于他克莫司是否影响胸腺瘤的报道极少,本研究中观察发现合并胸腺瘤病史的患者经他克莫司治疗后胸腺瘤均未复发,但样本量较小,并且为回顾性研究,证据强度较弱,需要更多研究进一步探讨。
他克莫司治疗MG的不良反应主要有头痛、震颤、肝肾损伤、骨髓抑制、高血压、高血糖等[24]。本研究中患者出现的不良反应主要包括腹泻、血糖升高、双手震颤、肌酐升高,反应均为轻度,减量或对症处理后均缓解,未发现肝肾损伤者;但本研究观察时间较短,对于长期口服他克莫司的患者还需严密监测,避免出现严重的不良后果。
综上所述,他克莫司治疗MG患者总有效率高,且不良反应少,为不能接受糖皮质激素和其他免疫抑制剂治疗或对其疗效差的MG患者提供了新的选择。由于MG属于少见病,需积极参与多中心的研究,以进一步明确他克莫司的作用、不良反应等,为其临床应用提供更多循证依据。
利益冲突:所有作者均声明不存在利益冲突。

