南珠粉对皮肤光老化小鼠肠道菌群的调节作用
邓亚胜,韩丝银,黄 慧,梁天薇,郑艺清,范燕萍,林 江
(广西中医药大学,广西 南宁 530200)
皮肤光老化是指皮肤长期暴露于紫外线辐射下而出现的衰老性病变,其常发生于面部、颈部、前臂以及上胸部等光暴露部位[1-2]。皮肤光老化的典型病变特征为光暴露部位皮肤粗糙、干燥、松弛,皱纹增多以及弹性下降,皮肤色素异常,出现黑色或褐色斑点,毛细血管扩张,严重时甚至会出现各种皮肤良性或恶性肿瘤[3-5]。皮肤光老化不仅对患者造成严重的身体和心理上的负担,同时对其正常的社交与工作也产生了巨大的影响,本疾病已经成为严重的公共卫生问题[6]。皮肤微生物组的稳定对于维持皮肤健康发挥着重要的作用,而紫外线辐射会影响皮肤微生物组的组成[7]。另外肠道菌群失调作为环境因素在皮肤光老化的发生和发展中发挥重要作用[8-9],高度多样化的肠道微生物群可能会影响皮肤的健康,称为肠道-皮肤轴[10-11]。口服和外用益生菌已被证实可以通过调节皮肤微生物组和肠道-皮肤微生物相互作用等途径来预防和治疗皮肤光老化[12]。南珠即合浦珍珠,具有镇静安神、明目退翳、解毒生肌功效,近年来对其抗衰老、抗皮肤色斑、美白等作用进了深入研究[13]。本课题组前期研究证实南珠粉可降低光老化小鼠皮肤氧自由基(ROS)、丙二醛(MDA)含量及酪氨酸酶(TYR)活性和基质金属蛋白酶-1(MMP-1)表达量,提高超氧化物歧化酶(SOD)、过氧化氢酶(CAT)活性及Collagen I蛋白表达量[14]。南珠粉对皮肤光老化小鼠肠道菌群的调节作用尚不清楚,本研究拟在前期研究的基础上从肠道菌群的角度探讨南珠粉抗皮肤光老化的相关机制。
1 实验材料与方法
1.1实验动物 SPF级雌性ICR小鼠15只,6~8周龄,体重(30±2)g,购自湖南斯莱克景达实验动物有限公司,许可证编号:SCXK(湘)2019-0004。常规条件饲养,室温(22±2)℃,湿度(50±10)%,自然采光。本实验通过广西中医药大学动物实验伦理审核(DW20220505-063)。
1.2实验药物 南珠粉购自北海宝竹林海运中国北海科技有限公司,加入凡士林搅拌均匀,制备为100 mg/g浓度的南珠粉膏剂。
1.3试剂与仪器 脱水机(武汉俊杰电子有限公司,型号:JJ-12J);包埋剂(武汉俊杰电子有限公司,型号:JB-P7);病理切片机(上海徕卡仪器有限公司,型号:RM2016);光学显微镜(日本Olympus公司,型号:BX53F);紫外微量分光光度计(美国Thermo Electron Corporation,型号:840-210600);-80 ℃超低温冰箱(eppendorf公司,型号:CryoCube F570);高通量测序仪(美国Illumina公司,型号:NovaSeq6000);苏木素染色液(美国Sigma公司,批号:G1120);伊红Y(水溶性)染色剂(国药集团化学试剂有限公司,批号:71014544);4%多聚甲醛通用型组织固定液(Biosharp,批号:69120900);无水乙醇(国药集团化学试剂有限公司,批号:10009218);盐酸(国药集团化学试剂有限公司,批号:10011018);包埋石蜡(国药集团化学试剂有限公司,批号:69019361);中性树胶(国药集团化学试剂有限公司,批号:10004160);粪便DNA提取试剂盒(德国TIANGEN公司,货号:DP328-02);PCR扩增仪(德国ABI公司,型号:2720);酶标仪(美国BioTek公司,型号:FLX800T);电泳仪(北京六一仪器厂,型号:DYY-6C);Agarose(美国Invitrogen公司,型号:75510-019);Quant-iT PicoGreen dsDNA Assay Kit(美国Invitrogen公司,型号:P7589);Marker(日本Takara公司,型号:DL2000)。
1.4实验方法 将ICR小鼠随机分为正常组、模型组、南珠粉组,每组5只。用电动剃须刀剃除各组小鼠背部4.0 cm×6.0 cm区域的毛发,每日定时将9W的UVA和UVB紫外线灯管[飞利浦照明(中国)投资有限公司, UVA灯管光谱波364~366 nm,UVB灯管光谱波308~311 nm]置于模型组、南珠粉组小鼠背部暴露皮肤区域上方20 cm处,模拟太阳光源照射2 h,辐射范围为60 cm×80 cm,UVA和UVB的日照射剂量约为13.5 J/cm2,连续处理8周;正常组不给予任何紫外线照射处理。小鼠背部裸露皮肤区毛发会持续生长,每周对各组小鼠进行剃毛处理,并记录背部照射部位皮肤状况。模型建立成功后,正常组、模型组小鼠均不予任何药物处理,南珠粉组于背部裸露皮肤处涂抹100 mg/g的南珠粉膏剂,每日1次,持续4周。
1.5检测指标及方法
1.5.1皮肤外观及皮肤组织病理形态 观察造模结束后和干预4周后各组小鼠背部皮肤变化;干预4周后,收集各组小鼠新鲜粪便后麻醉处死,取1.0 cm×0.5 cm背部裸露照射区域皮肤组织,将皮肤组织浸于4%多聚甲醛溶液中固定,经过脱水、包埋、切片处理后进行HE染色,光学显微镜下观察皮肤组织病理形态。
1.5.2肠道菌群高通量测序及生物信息分析 小鼠粪便样品16S rDNA检测由上海派森诺生物科技有限公司完成。试验过程中采用DNA提取试剂盒提取粪便样本DNA,Nanodrop对DNA进行定量,并通过1.2%琼脂糖凝胶电泳检测DNA,将质控合格的DNA构建文库。对16S rRNA基因的V3-V4可变区域进行PCR扩增,PCR前序列引物为5’-ACTCCTACGGGAGGCAGCA-3’,后序列引物为5’-GGACTACHVGGGTWTCTAAT-3’,扩增片段500 bp,98 ℃预变性2 min,变性15 s,55 ℃退火30 s,72 ℃延伸30 s,72 ℃最终延伸5 min,10 ℃终止保存,25~30个循环。将PCR扩增产物磁珠纯化回收,并对回收的产物进行荧光定量,根据荧光定量结果,按照每个样本测序要求,对各样本按相应比例混合。使用TruSeq Nano DNA LT Library Prep Kit制备测序文库。对完成构建的文库在生物分析仪(Agilent Bioanalyzer)上进行测序前质检,采用Quant-iT PicoGreen dsDNA Assay Kit在Promega QuantiFluor荧光定量系统上对文库进行定量,Illumina NovaSeq 6000高通量测序平台进行上机测序。对高通量的原始下机数据使用QIIME2软件识别疑问序列,剔除不合格的序列。采用DAD2法进行去引物、质量过滤、去噪、拼接和去嵌合体等步骤,质控去重后产生ASVs(amplicon sequence variants)特征序列,去除低频率ASV以减少假阳性结果。选用Greengenes数据库对得到的ASVs特征序列进行物种分类学注释,根据注释结果运用R语言软件(R.v4.1.2)、QIIME2软件等进行测序结果的可视化分析。
1.6统计学方法 采用SPSS 26.0统计学软件进行数据分析,首先对计量资料进行正态分析和方差齐性检验,若两者均符合,组间比较采用单因素方差分析;若不符合正态分布或方差齐性检验,采用非参数秩和检验;相关性采用Pearson相关性分析;P<0.05为差异有统计学意义。
2 结 果
2.1各组小鼠皮肤外观 正常组小鼠皮肤光滑较薄,肉眼可观察到皮下血管,皮肤呈肉色; 造模后模型组和南珠粉组小鼠皮肤出现松弛、皱纹、粗糙、红斑等皮损变化,肉眼无法观察到皮下血管; 干预4周后,南珠粉组小鼠皮肤皱纹消失,皮肤紧致、变薄,可见皮下血管,与正常组接近。见图1。

图1 正常组和皮肤光老化各组小鼠造模后和干预4周后皮肤外观
2.2各组小鼠皮肤组织病理学形态 正常组小鼠皮肤表皮结构紧密、较薄,具有明显的真皮乳头,真皮与表皮连接紧密,真皮网织层排列紧密均匀;模型组小鼠皮肤角质层出现显著角化不全和角化过度,表皮显著增厚,可发现明显增多的异常形的角质形成细胞,真皮浅层可见到较为明显的炎症细胞浸润,胶原纤维排列紊乱;南珠粉组小鼠真皮与表皮连接紧密,接近于正常组。见图2。
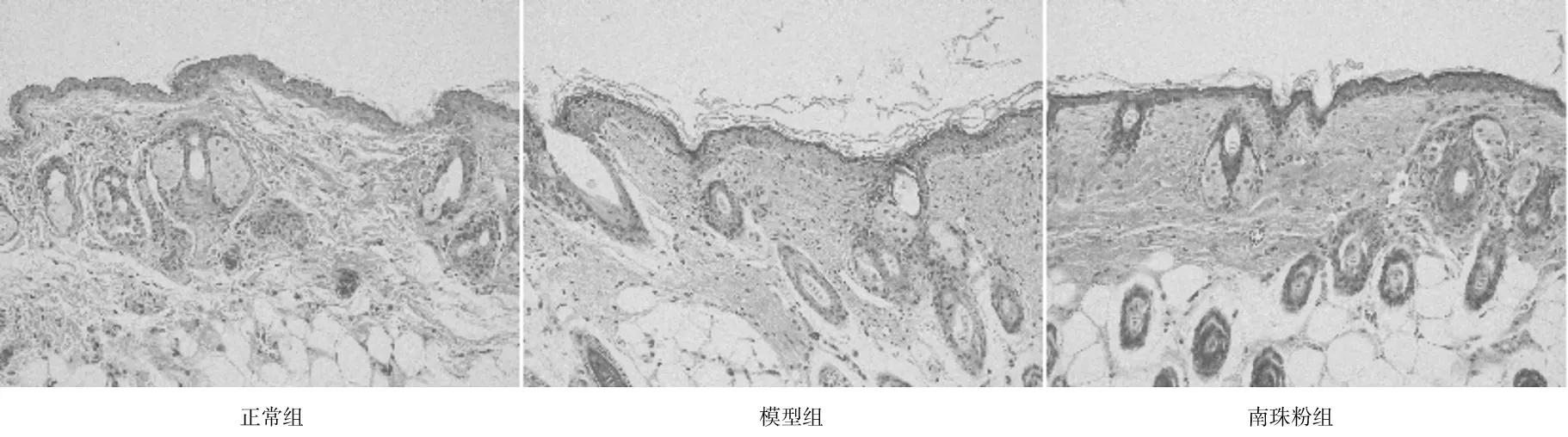
图2 正常组和皮肤光老化各组小鼠皮肤组织病理形态(HE 染色,×200)
2.3各组小鼠肠道菌群OTU分析 3组小鼠存在肠道菌群结构上的差异,正常组肠道菌群物种丰富度明显高于南珠粉组和模型组,南珠粉可增加皮肤光老化降低的菌群数量。OTU韦恩图中重叠部分为共有的菌群,见图3。
2.4各组小鼠肠道菌群Alpha多样性分析
2.4.1肠道菌群Alpha多样性指数 Alpha 多样性分析显示(通过群落多样性指数与群落丰度指数反映样品的物种多样性,其中Chao1指数和Observed species指数反映物种丰富度,Shannon和Simpson指数反映物种多样性,Pielou’s evenness指数反映物种均匀度),模型组Chao1指数、Shannon指数、Simpson指数、Observed species指数和Pielou’s evenness指数均明显低于正常组(P均<0.05);南珠粉组Shannon指数、Simpson指数、Pielou’s evenness指数均明显高于模型组(P均<0.05),Chao1指数、Observed species指数与模型组比较差异无统计学意义(P均>0.05)。提示南珠粉可有效增加肠道菌群丰度、多样性和均匀度。见图4。
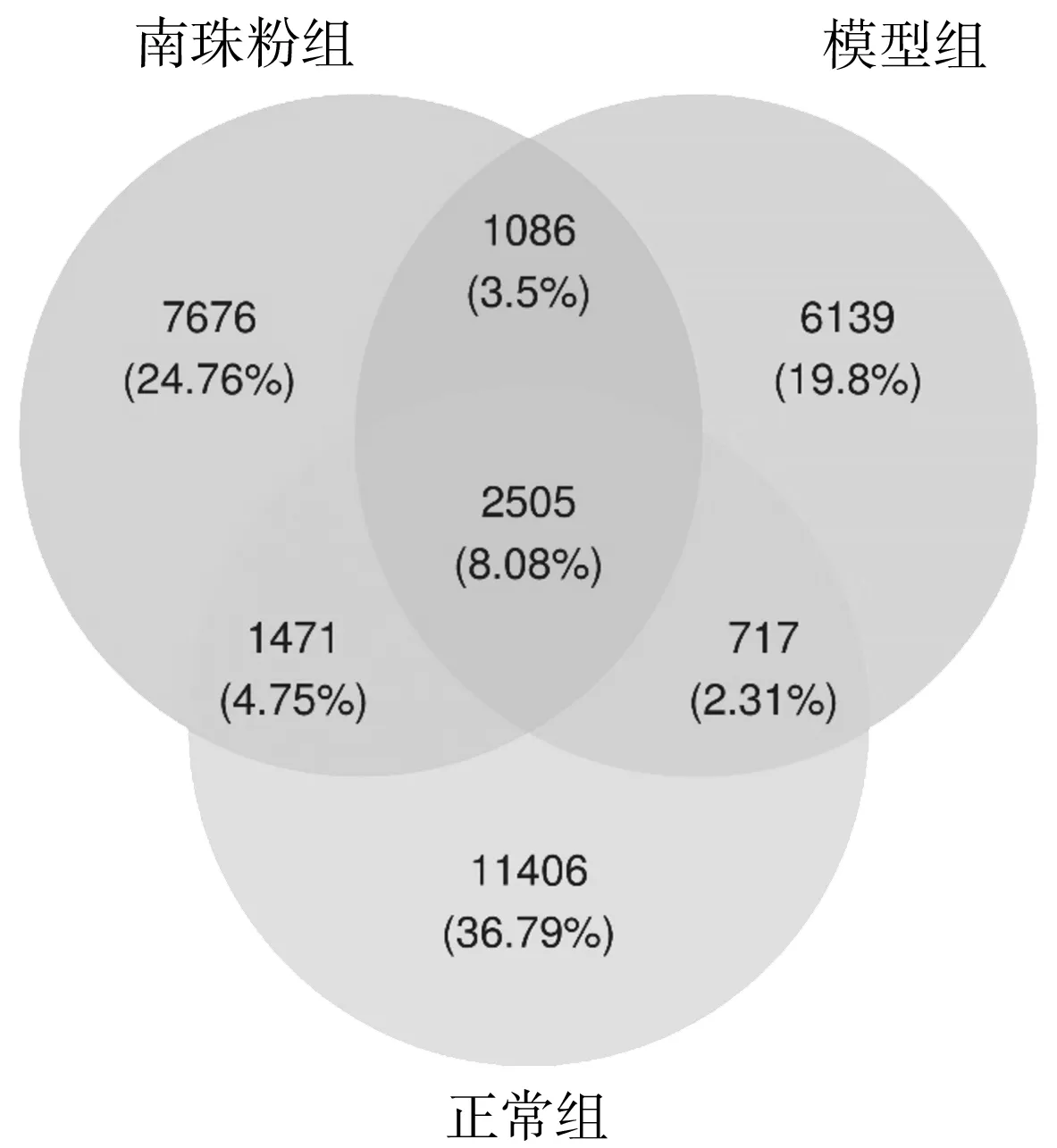
图3 正常组和皮肤光老化各组小鼠肠道菌群总OTU数目
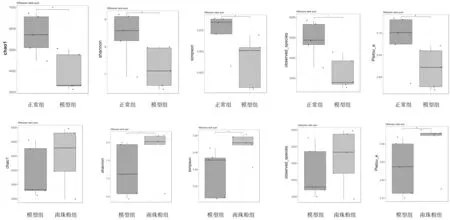
图4 正常组和皮肤光老化各组小鼠肠道菌群Alpha多样性指数分组箱线图
2.4.2肠道菌群物种多样性曲线 当样本量达到6时,各个样本稀释曲线接近平坦,表明样本量足够大,测序已深度达标,即使增加样本的数量,也很少有新的物种出现,见图5。

图5 正常组和皮肤光老化各组小鼠肠道菌群物种稀释曲线
2.5各组小鼠肠道菌群Beta多样性指数分析 采用PCoA分析(为主坐标分析,是一种非约束性的数据降维分析方法,可最大限度反映距离矩阵中样本差异距离,各组样本之间的距离越近,组间的物种成分相似度越高),第一主成分PCoA1解释组间64.9%的差异,第二主成分PCoA2解释组间9.81%的差异;正常组与模型组相距最远,差异较大,说明紫外线能改变小鼠的肠道菌群;南珠粉组介于正常组与模型组之间,且部分与正常组物种产生交集,见图6。Anonsim相似性分析显示,3组小鼠肠道菌群差异组间大于组内(P=0.001),提示南珠粉可改善皮肤光老化小鼠肠道菌群结构组成和菌群多样性。

图6 正常组和皮肤光老化各组小鼠肠道菌群Beta多样性分析
2.6各组小鼠肠道菌群结构分析
2.6.1门水平物种组成分析 各组小鼠肠道菌群在门水平(Phylum)主要由厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)、变形菌门(Proteobacteria)、疣微菌目门(Verrucomicrobiales)、放线菌门(Actinobacteria)、脱铁杆菌门(Deferribacteres)、蓝细菌门(Cyanobacteria)、17志贺菌属(TM7)、软壁菌门(Tenericutes)等构成,占比达到95%以上。对于相对丰度大于1%的门定义为优势物种,小鼠的肠道菌群群落结构中,厚壁菌门、拟杆菌门、变形菌门、疣微菌目门和放线菌门均为优势物种。与正常组相比,模型组拟杆菌门、疣微菌目门丰度降低,厚壁菌门丰度升高,差异均有统计学意义(P均<0.05);与模型组相比,南珠粉组蓝细菌门丰度明显升高(P<0.05)。见图7及图8。
2.6.2属水平物种组成分析 小鼠在肠道菌群属水平上主要由乳酸杆菌属(Lactobacillus)、拟杆菌属(Bacteroides)、紫单胞菌科(Odoribacter)、普雷沃氏菌属(Prevotella)、Rikenella菌属、颤螺旋菌属(Oscillospira)等组成。与正常组相比,模型组unidentified_S24-7菌属、瘤胃球菌属(Ruminococcus)、柄杆菌属(Caulobacter)下调, unclassified_Bacillaceae菌属上调,差异均有统计学意义(P均<0.05)。与模型组相比,南珠粉组unidentified_S24-7菌属、瘤胃球菌属、柄杆菌属上调, unclassified_Bacillaceae菌属下调,差异均有统计学意义(P均<0.05)。见图9及图10。

图7 正常组和皮肤光老化各组小鼠肠道菌群门水平物种相对丰度
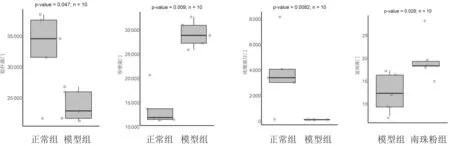
图8 正常组和皮肤光老化各组小鼠肠道菌群门水平差异物种相对丰度
2.7各组小鼠肠道菌群LEfSe分析 模型组、正常组、南珠粉组均存在丰度差异明显的物种。进化分支图由内至外辐射的圆圈代表了由门至属(或种)的分类级别,不同颜色的区域代表不同的处理;圆圈表示从门到属的系统发育水平,每个圆的直径与该组的丰度成正比;空心节点代表组间差异不显著的分类单元,而其他颜色的节点则表明这些分类单元体现出显著的组间差异,且在该色所代表分组样本中丰度较高;字母标识了组间存在显著差异的分类单元的名称。LDA图展示LDA score大于预设值的显著差异物种,柱状图长短值代表LDA score,表示不同组间显著差异物种的影响大小。LEfSe分析,疣微菌门(Verrucomicrobiales)、疣微菌纲(Verrucomicrobiae)、疣微菌目(Verrucomicrobia)、阿克曼氏菌属(Akkermansia)、异杆菌属(Allobaculum)、普雷沃氏菌属(Paraprevotella)等物种在正常组富集,乳酸杆菌属(Lactobacillus)、葡萄球菌属(Staphylococcus)、耐盐咸海鲜球菌属(Jeotaliococcus)、安德克氏菌属(Adlercreutzia)、乳酸杆菌目(Lactobacillales)等物种在模型组富集,毛螺菌属(Lachnospiraceae)、梭菌目(Clostridiales)、噬纤维菌目(Cytophagales)、炭疽芽孢杆菌纲(Cyophagia)、噬冷菌属(Algoriphagus)、环状菌科(Cyclobacteriaceae)、瘤胃球菌科(Ruminococcaceae)、丁酸菌属(Butyricicoccus)等在南珠粉组富集。见图11。

图9 正常组和皮肤光老化各组小鼠肠道菌群属水平物种相对丰度

图10 正常组和皮肤光老化各组小鼠肠道菌群属水平差异物种相对丰度

进化分支图 (p: Phylum,c:Class,o:Order,f:Family,g:Genus)
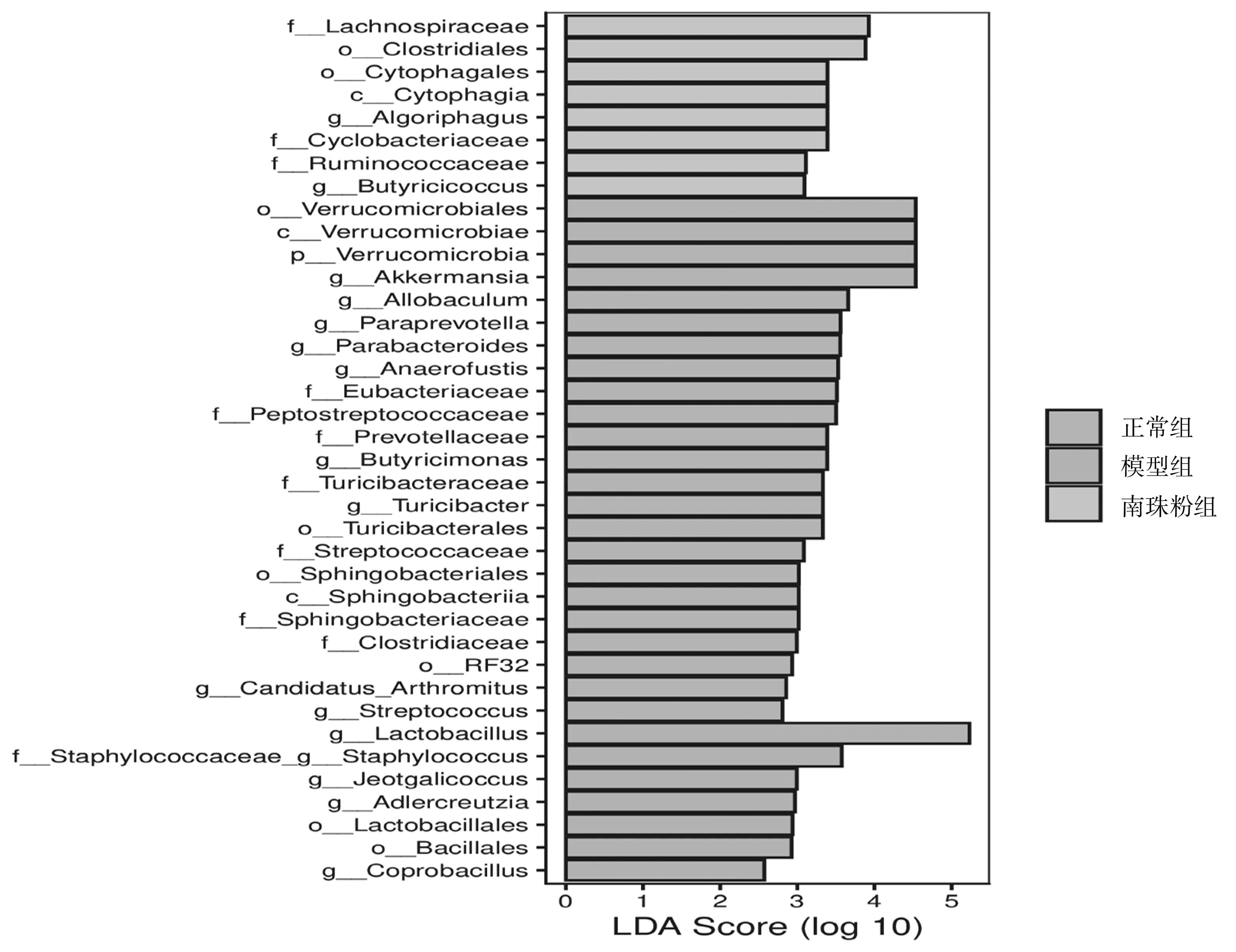
LDA图(LDA评分>2以及P值<0.05的菌群)
2.8各组小鼠肠道菌群环境因子关联分析 根据前期实验研究数据[14],将TYR活性、ROS含量、MDA含量、SOD活性、CAT活性作为环境因子,进行环境因子、样本、菌群(属分类水平总丰度排序前20的菌种)三者之间的RDA相关性分析(基于线性模型进行开展,可以直观的观察菌种与环境因子之间的关系,所夹角为锐角为正相关,所夹角为钝角为负相关),显示SOD、CAT活性成正相关,MDA、ROS、TYR相互之间呈正相关, SOD、CAT与MDA、ROS、TYR之间呈负相关;由样品点向环境因子的箭头做投影,根据投影点至原点的距离发现SOD、CAT活性对正常组影响最大,MDA、ROS、TYR对模型组和南珠粉组影响较大。分析环境因子与菌种之间的Spearman相关性系数,通过颜色深浅变化反映两者之间的正负关系,将获得的数值矩阵通过Heatmap图直观展示,ROS、MDA活性及TYR含量与乳酸杆菌属(Lactobacillus)、葡萄球菌属(Staphylococcus)呈正相关(P均<0.05),与阿克曼氏菌属(Akkermansia)、普雷沃氏菌属(Prevotella)、苏黎世杆菌属(Turicibacter)呈负相关(P均<0.05);SOD、CAT活性与阿克曼氏菌属、普雷沃氏菌属、苏黎世杆菌属呈正相关(P均<0.05),与乳酸杆菌属、葡萄球菌属呈负相关(P均<0.05)。见图12。
2.9各组小鼠肠道菌群PICRUSt功能预测 采用PICRUSt2软件分析3组肠道菌群潜在的代谢功能改变,KEGG的一级代谢通路可分为六大类别,包括代谢(Metabolism)、遗传信息处理(Genetic Information Processing)、环境信息处理(Environmental Information Processing)、细胞进程(Cellular Processes)、生物体系统(Organismal Systems)和人类疾病(Human Diseases),小鼠肠道菌群在代谢、遗传信息处理、人类疾病功能丰度相对较高。对小鼠肠道菌群的二级功能区进一步区分,3组样本功能最显著富集在氨基酸代谢、碳水化合物代谢、外来生物的降解和代谢、脂质代谢、传染病、复制和修复、转录、翻译等功能通路。各组在代谢功能上部分存在显著差异,南珠粉组在蛋白酶体、光合作用、青霉素和头孢菌素的生物合成通路上较为显著;正常组在光合作用、D-精氨酸和D-鸟氨酸的代谢、抗霍乱弧菌感染功能通路上较显著;模型组在阿特拉津降解、青霉素和头孢菌素的生物合成、氯环己烷和氯苯的降解功能通路上较为显著。见图13。

图12 正常组和皮肤光老化各组小鼠肠道菌群环境因子影响的相关性分析
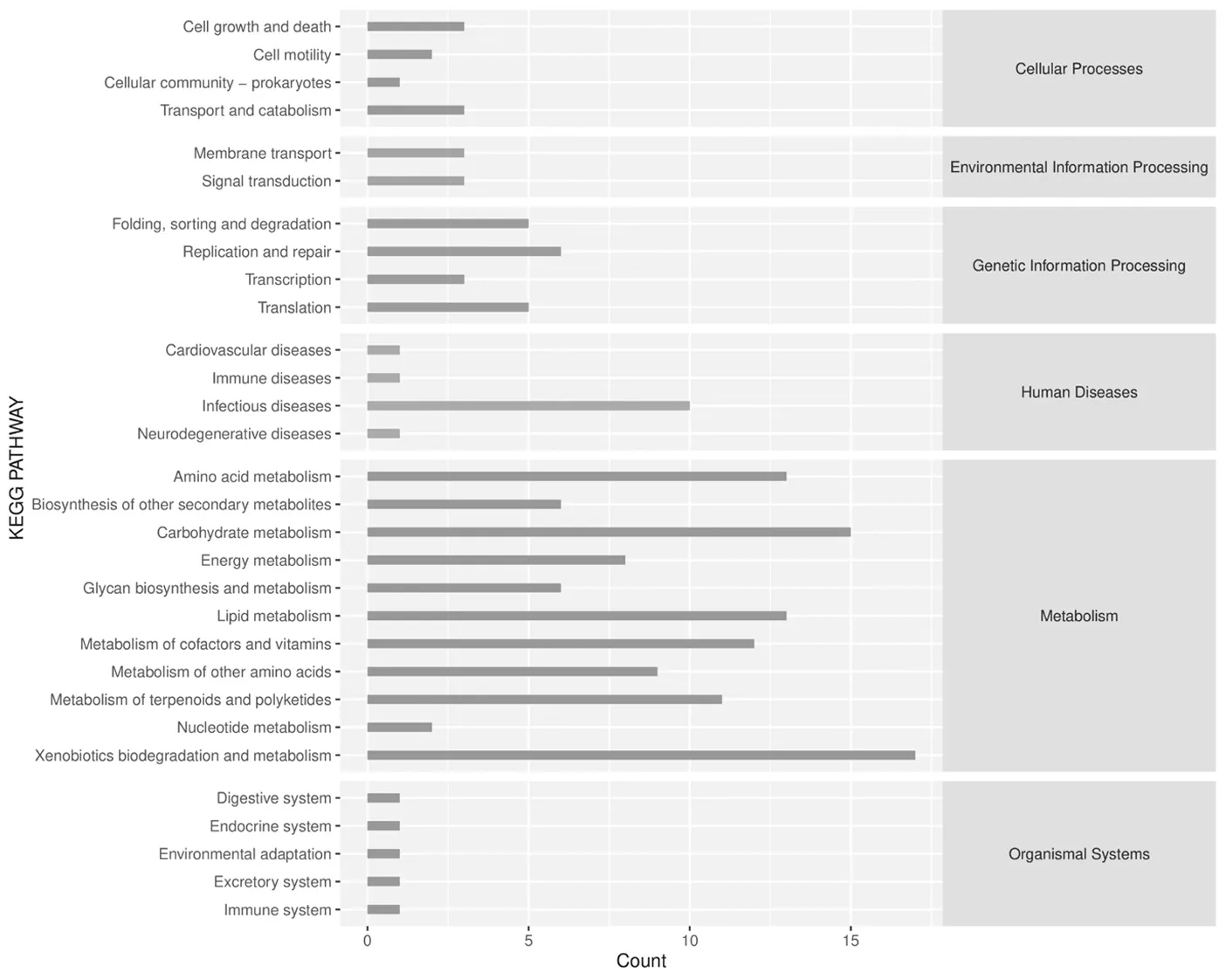
肠道菌群二级功能通路丰度
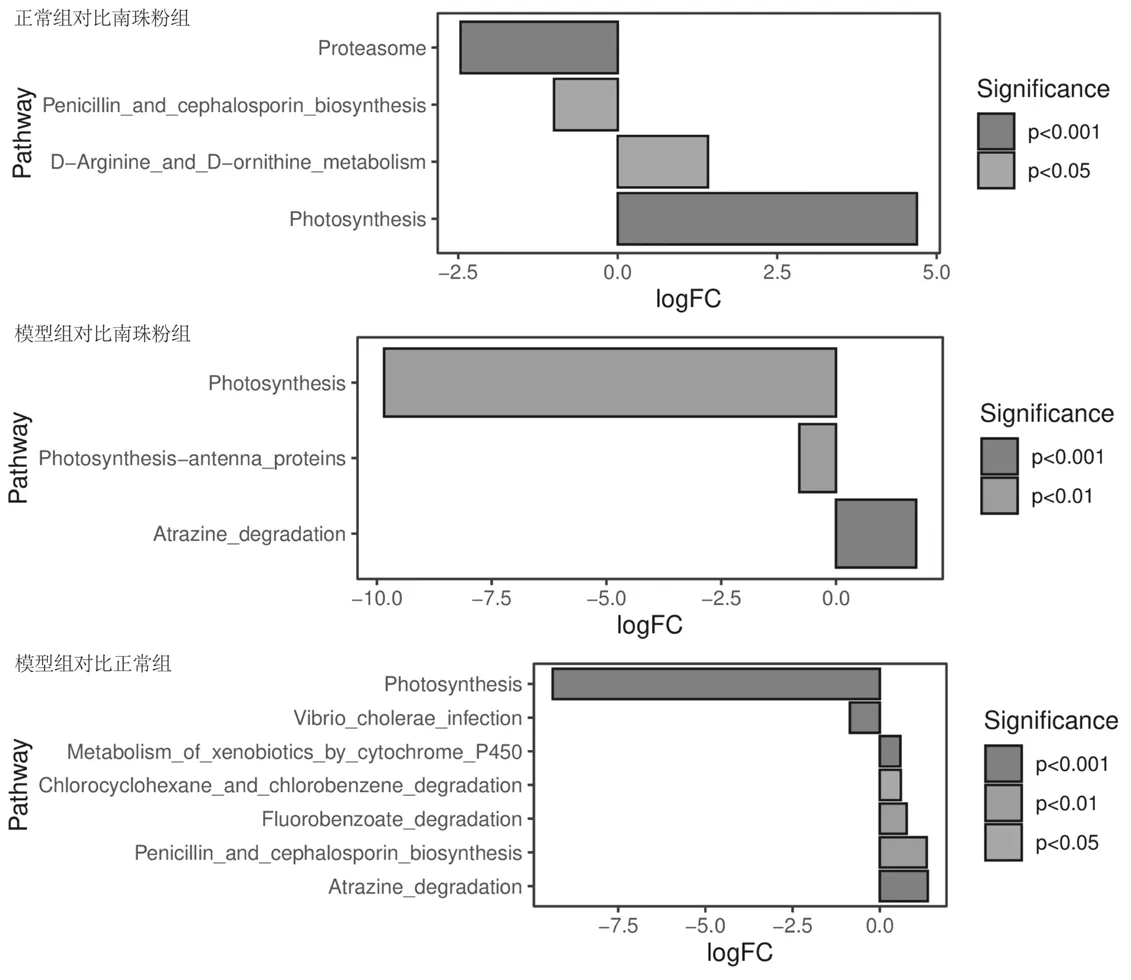
各组存在显著差异的代谢通路
3 讨 论
肠道菌群是一类生活在机体肠道中的微生物群落的总称,肠道菌群的平衡与人类健康和疾病关系密切,是“皮-肠轴”和“脑-皮-肠轴”的一部分[15-17]。肠道菌群具有塑造免疫系统、防止病原体及其分解代谢物入侵和维持机体健康的屏障作用,肠道菌群的失调会导致多种疾病的发生[18]。机体皮肤和肠道以及与外界相通的腔道存在大量的微生物群,其中皮肤约有1012个微生物细胞,肠道约有1014个微生物细胞[19-20]。许多皮肤疾病的产生都伴随肠道菌群的改变,如银屑病、痤疮、特异性皮炎以及皮肤癌等[19,21-22]。现有研究表明,肠道菌群具有抗氧化、抗皱、抗衰老作用,可以显著改善紫外线引起的细胞和分子损伤[22-25]。益生菌是活性微生物,可以通过改变宿主菌群特定部分的微生物群组成对机体产生有益影响,益生菌正在成为减轻 UVR 对皮肤的破坏性影响的潜在治疗手段。
本研究采用16S rDNA高通量测序研究了南珠粉对皮肤光老化小鼠肠道微生物群落的影响,结果OTU聚类分析、Alpha多样性分析和Beta多样性分析均证实南珠粉能够在一定程度上提高肠道菌群的丰度及多样性。门水平物种分析显示,模型组拟杆菌门、疣微菌目门丰度较正常组低,厚壁菌门丰度较正常组高;南珠粉组蓝细菌门丰度较明模型组高。拟杆菌门可维持肠道菌群内环境稳态,厚壁菌门和拟杆菌门的比值在一定程度上能够反映肠道菌群的紊乱程度。蓝细菌门具有促进抗氧化剂产生、DNA 修复、蛋白质再合成、紫外线吸收/屏蔽化合物的合成以及产生光保护化合物等作用[26-27],南珠粉可通过提高蓝细菌门丰度增强皮肤光保护屏障功能。属水平物种分析显示,模型组瘤胃球菌属相对丰度明显降低。瘤胃菌属是一种产丁酸盐菌,其产生的丁酸盐具有抑制炎症反应的作用[28],模型组瘤胃球菌属相对丰度下调可能与皮肤光老化产生的炎症反应相关;南珠粉组瘤胃球菌属相对丰度明显上调,提示南珠粉治疗皮肤光老化可能与调节上述菌群相关。
基于课题组前期研究进行环境因子关联分析,显示ROS、MDA活性与TYR含量和乳酸杆菌属、葡萄球菌属呈正相关,与阿克曼氏菌属、普雷沃氏菌属、苏黎世杆菌属呈负相关;SOD、CAT活性与阿克曼氏菌属、普雷沃氏菌属、苏黎世杆菌属呈正相关,与乳酸杆菌属、葡萄球菌属呈负相关。相关研究表明,乳酸杆菌属可以抑制紫外线诱导的人真皮成纤维细胞中MMP-1的表达,有效缓解紫外线造成的前胶原蛋白表达降低,可减少皮肤水分的流失,增加皮肤的弹性,具有显著的抗皮肤光老化作用[29-30]。葡萄球菌属可以产生多种抗菌蛋白和蛋白酶,保护皮肤免受病原体入侵并维持皮肤微生物群稳态[31]。Keshari等[32]发现来自新一代外用益生菌表皮葡萄球菌属的丁酸可以通过短链脂肪酸受体下调紫外线诱导的促炎细胞因子白细胞介素-6(IL-6)的表达。普雷沃氏菌属可以激活Toll样受体2,通过抗原呈递细胞产生Th17极化细胞因子,包括IL-23和IL-1;普氏菌属介导的黏膜炎症导致炎症介质、细菌和细菌产物的全身传播,导致机体皮肤屏障功能降低[33]。阿克曼氏菌属主要对消化系统起保护作用,同时可以增强宿主的免疫功能、新陈代谢和肠道屏障功能[34]。皮肤光老化可能导致肠道微环境和免疫反应异常,南珠粉可能通过上调阿克曼氏菌属丰度,改善肠道微环境和免疫反应异常。苏黎世杆菌属是产丁酸的菌,丁酸是一种脂肪酸,具有调节肠道菌群、维持体液和电解质平衡、抑制炎症因子释放、保护肠黏膜屏障和维持肠道免疫平衡等作用[35-36]。
PICRUSt功能预测分析表明,3组小鼠样本功能集中富集在氨基酸代谢、碳水化合物代谢、外来生物的降解和代谢、脂质代谢、传染病、复制和修复、转录、翻译等功能通路,其中氨基酸代谢、碳水化合物代谢、外来生物的降解和代谢、脂质代谢等通路与皮肤光老化的发生密切相关[37-39],相关通路的代谢紊乱会引起小鼠肠道菌群的失调。
综上所述,皮肤光老化小鼠在门、纲、目、科、属等不同菌群分类水平上均存在微生物组成及相对丰度的变化,可以为皮肤光老化的诊断提供参考。南珠粉可通过调节肠道微生态环境发挥抗皮肤光老化的作用。但16S rDNA高通量测序技术是一种半定量检测,因此仍需要靶向微生物学或宏基因组、宏转录组及代谢组等不同组学技术相关的研究进一步阐明差异菌群,同时进行相关的机制研究并加以验证,以进一步阐明南珠粉治疗皮肤光老化的作用机制。
利益冲突:所有作者均声明不存在利益冲突。

