温肾壮阳方含药血清调控HIF-1α/VEGF通路对髓核细胞凋亡与增殖的影响
李欣怡,王洪伸,林涌鹏,麦烙棋,陈博来
(1. 广州中医药大学第二临床医学院,广东 广州 510006;2. 广东省中医院,广东 广州 510006)
腰椎间盘退行性疾病是我国严重的公共卫生问题,在腰痛复杂的多因素中,大约40%的腰痛是由于椎间盘退变引起的[1],而在发病人群中有11%~12%因腰痛致残[2]。因此,对椎间盘退变进行早期预防和治疗具有非常重要的临床价值和公共卫生学意义。临床对于腰椎间盘退变的治疗主要为抗炎镇痛等保守治疗和手术治疗,治疗效果有限,且手术治疗有发生并发症的风险[3]。另外,目前尚无药物干预、生物疗法或技术被批准用于预防椎间盘退变[4]。 邓晋丰教授根据内经“肾主骨生髓”的论述,体悟肾中精气阴阳的盛衰与骨骼的生长代谢密切相关[5],进一步认识到“补肾阳”的重要性,开发出代表性方剂“温肾壮阳方”,经过现代制剂技术开发出院内制剂“温通胶囊”,临床用于治疗腰椎间盘突出症获得良好疗效[6]。但该方缓解腰痛及对退变椎间盘的生物学机制尚不明确,本实验旨在通过观察温肾壮阳方含药血清对髓核细胞凋亡、增殖及缺氧诱导因子-1α(HIF-1α)/血管内皮生长因子(VEGF)通路的影响,探讨温肾壮阳方延缓腰椎间盘退变的可能机制。
1 实验材料与方法
1.1实验细胞系 由广东省中医院骨一科提供人髓核组织(经椎间孔镜手术取得,患者均知情同意),进行原代细胞提取与培养,采用第三代细胞进行实验。
1.2实验动物 SPF级雄性SD大鼠25只,3月龄,体重约350 g,购自广东省实验动物中心,动物合格证编号:44829700001434。大鼠饲养于广东省中医药科学院实验动物中心SPF级环境[许可证号:SYXK(粤)2018-0094],每笼5只,自由饮食饮水,适应性饲养1周后开始实验,实验通过该中心伦理审查通过(2022009)。
1.3主要实验设备、试剂与耗材 多功能酶标仪M1000pro(TECAN);荧光定量PCR仪ABI Quant Studio 7 Flex(ABI);nanodrop2000c超微量分光光度计(Thermo Fisher);SDS-PAGE垂直电泳槽(Bio-Rad);高灵敏度化学发光成像仪(Bio-Rad);NovoCyte Advanteon 流式细胞仪(安捷伦)。 SteadyPure通用型RNA提取试剂盒(艾科瑞);Evo M-MLV 反转录试剂盒(艾科瑞);BeyoFastTMSYBR Green One-Step qRT-PCR Kit(碧云天);氯化钴(CoCl2)粉末(九鼎化学);Ⅱ型胶原酶(Sigma);CCK8溶液(博士德);HIF-1α Monoclonal antibody(Proteintech);VEGFA Monoclonal antibody(Proteintech);Actin Monoclonal antibody(Proteintech);半胱天冬酶-1(Caspase-1) Monoclonal antibody(Proteintech);p53 Monoclonal antibody(Proteintech);HRP-conjugated Affinipure Goat Anti-Rabbit IgG(H+L) (Proteintech);HRP Conjugated AffiniPure Goat Anti-mouse IgG (H+L)(博士德);10%水合氯醛溶液(BBI);Human MSC Analysis Kit(BD)。
1.4实验药物 温肾壮阳方(熟附子15 g、骨碎补15 g、巴戟天15 g、仙茅15 g、杜仲20 g、黄芪30 g、全蝎5 g、白术15 g、桂枝10 g,康美药业),按照人与大鼠剂量换算制备低、中、高浓度分别为4.821 4 g/(kg·d)、9.792 8 g /(kg·d)、19.285 7 g /(kg·d)的药液;依托考昔(齐鲁制药有限公司,国药准字H20193275,规格:60 mg),按照人与大鼠剂量换算制备浓度为0.001 5 g/(kg·d)的药液。
1.5含药血清制备 将25只SD大鼠随机分为5组,分别用生理盐水、依托考昔溶液及低、中、高浓度温肾壮阳方进行灌胃,每次灌胃量1.5 mL,2次/d,连续灌胃7 d。于末次灌胃后2 h,采用10%水合氯醛腹腔注射麻醉大鼠,使用手术刀或剪刀打开大鼠腹腔,钝性分离暴露腹主动脉,一次性采血针平行刺入腹主动脉,另一端迅速连接真空促凝采血管,待血液充满后换管,3 000 r/min离心15 min,移液器吸取上清液,56 ℃恒温水浴灭活30 min,0.2 μm微孔滤膜除菌,分装,-80 ℃储存备用,血清浓度均为10%。
1.6细胞实验
1.6.1细胞生存率检测 取生长良好的髓核细胞,1 104个/孔铺于96孔板中,培育24 h至全部贴壁。实验分为6组,空白对照组用正常大鼠血清培养,缺氧造模组用300 μmol/L CoCl2溶液干预24 h诱导缺氧状态,依托考昔组用300 μmol/L CoCl2+依托考昔含药血清同时干预24 h,低、中、高浓度温肾壮阳方组分别用300 μmol/L CoCl2+相应浓度肾壮阳方含药血清同时干预24 h。按照CCK-8试剂盒说明处理细胞2 h后,使用多功能酶标仪检测每个孔在450 nm波长处的吸光度值。
1.6.2细胞中HIF-1α、VEGF、Caspase-1、p53蛋白表达情况 采用Western blot法检测:取生长良好的髓核细胞,按1 105个/孔铺于96孔板中,培育24 h至全部贴壁。待细胞生长至80%后分组培养,实验分组及培养同1.6.1。作用24 h后添加RIPA裂解液,细胞刮匙收集蛋白,在4 ℃下12 000 r/min离心15 min,抽取上层蛋白清液转移至EP管。BCA法测定蛋白浓度,蛋白均一定量后变性,SDS-PAGE电泳,湿转法转膜至PVDF膜,快速封闭液封闭30 min,加入一抗4 ℃过夜。TBST清洗10 min×3次,加入二抗室温孵育1 h,TBST缓冲液洗膜10 min 3次。ECL化学发光显影。ECL化学发光显影,重复实验3次,使用Image Lab软件测量条带灰度值。
1.6.3细胞中HIF-1α、VEGF、Caspase-1、p53 mRNA表达情况 采用qPCR法检测:取生长良好的髓核细胞,按1 105个/孔铺于6孔板,培育24 h至全部贴壁。待细胞生长至80%后分组培养,实验分组及培养同1.6.1。作用24 h后,采用SteadyPure通用型RNA提取试剂盒提取细胞RNA,并用Nanodrop分光光度计测总RNA浓度和纯度。按反转录试剂盒说明书将RNA反转录为cDNA。按照PCR试剂盒说明书,选择β-actin为内参,HIF-1α、VEGF、Caspase-1、p53引物序列见表1。PCR反应条件:95 ℃预变性20 s,95 ℃ 1 s,60 ℃ 20 s,95 ℃ 15 s,60 ℃ 1 min,共40个循环。2-△△CT法计算mRNA相对表达量。每个实验组重复3次。
1.6.4髓核间充质干细胞(NPSCs)增殖情况 采用流式细胞术检测:取生长良好的髓核细胞,按1 106个/皿进行铺板,培育24 h至全部贴壁。待细胞生长至80%后分组培养,实验分组及培养同1.6.1。作用24 h后,用PBS清洗,不含EDTA胰酶消化,离
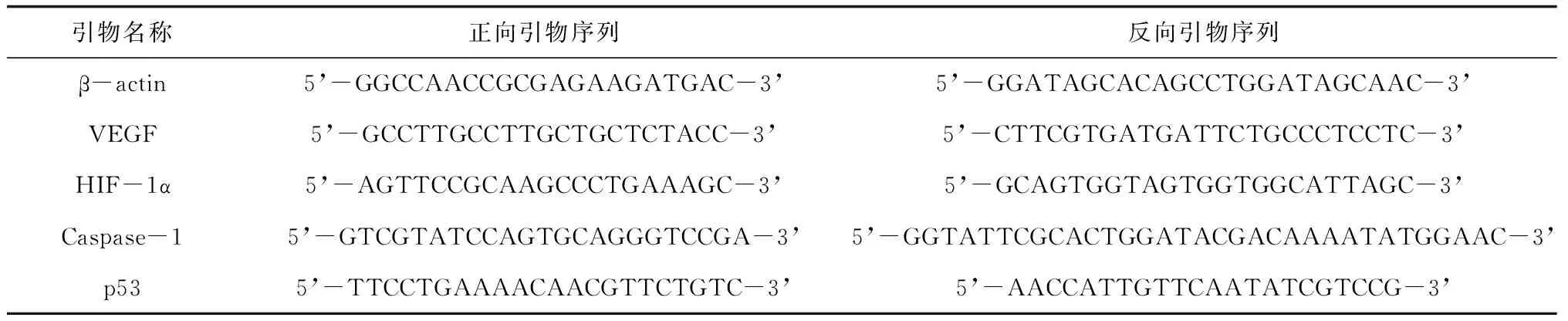
表1 引物序列
心,弃上清,PBS重悬,用细胞计数板定浓度为5 106个/mL。根据Human MSC Analysis Kit试剂盒说明书,以CD90、CD73、CD105为阳性表面抗体,CD34、CD45、CD11b、CD19、HLA-DR为阴性表面抗体,用5 mL流式管每管加入100 μL细胞悬液,避光加入荧光染料。冰上或室温孵育30 min,期间每隔10 min震荡1次反应管,使细胞和抗体充分反应。孵育完毕后用PBS清洗2次,每次1 500 r/min离心3 min,再用PBS重悬至500 μL/管,上机分析NPSCs增殖情况。
1.7统计学方法 采用 GraphPad Prism 8.3.0 软件(GraphPad Software公司,美国)进行数据的统计分析。实验数据采用Tukey’s Method分析进行多组间差异分析,P<0.05为差异有统计学意义。
2 结 果
2.1各组细胞存活率比较 缺氧诱导各组细胞存活率均明显低于空白对照组(P均<0.05),且依托考昔组细胞存活率明显低于缺氧造模组(P<0.05);中浓度温肾壮阳方组、高浓度温肾壮阳方组的细胞存活率均明显高于缺氧造模组(P均<0.05)。见图1。
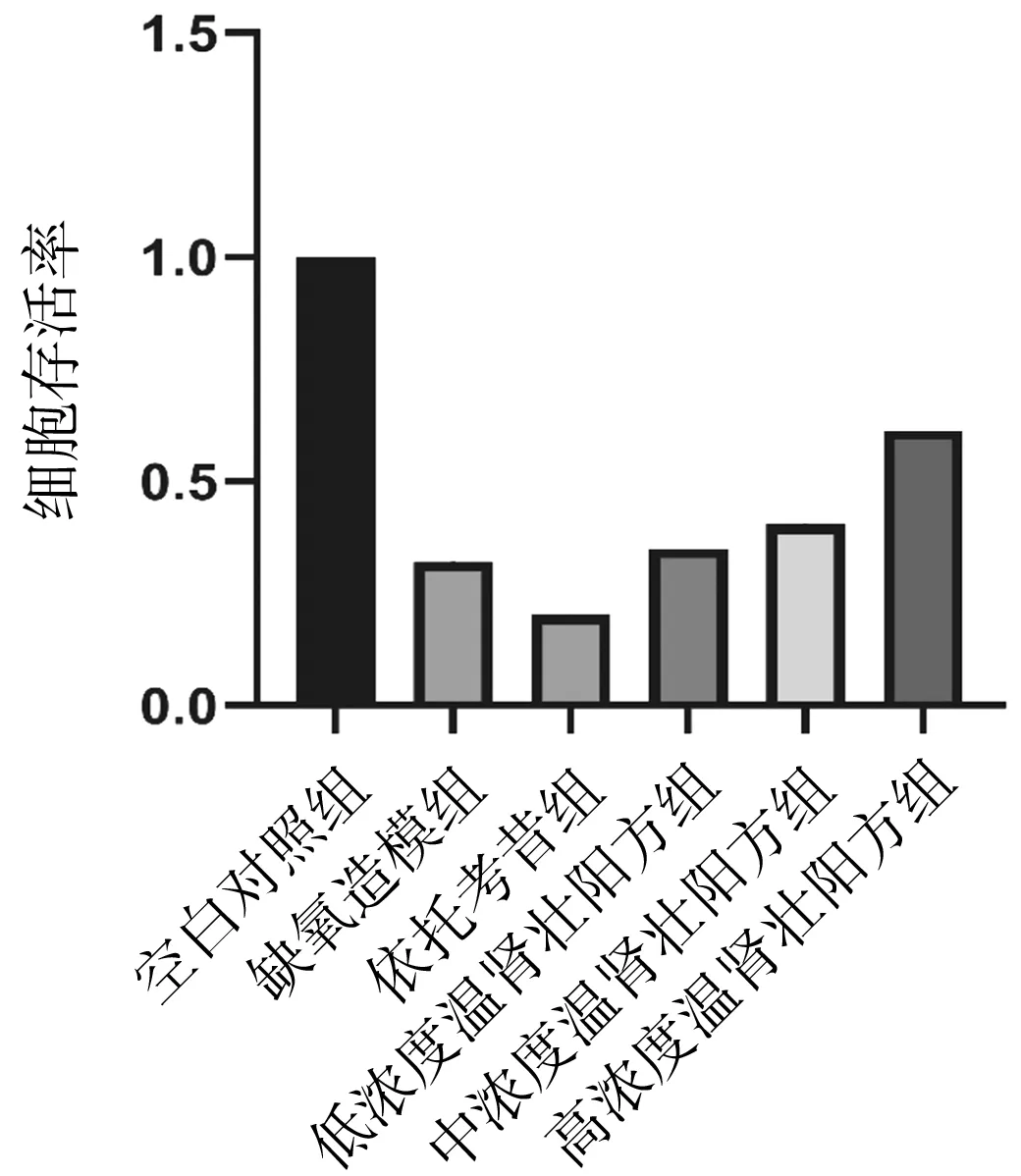
图1 空白对照组和缺氧诱导各组髓核细胞存活率
2.2各组细胞中缺氧及凋亡相关蛋白表达情况缺氧造模组细胞中HIF-1α、VEGF、Caspase-1、p53蛋白相对表达量均明显高于空白对照组(P均<0.05)。依托考昔组HIF-1α蛋白相对表达量明显高于缺氧造模组(P<0.05),VEGF、Caspase-1、p53蛋白相对表达量与缺氧造模组比较差异均无统计学意义(P均>0.05);温肾壮阳方各组HIF-1α蛋白相对表达量与缺氧造模组比较差异均无统计学意义(P均>0.05),VEGF蛋白相对表达量均明显高于缺氧造模组(P均<0.05);中浓度温肾壮阳方组、高浓度温肾壮阳方组Caspase-1、p53蛋白相对表达量及低浓度温肾壮阳方组p53蛋白相对表达量均明显低于缺氧造模组(P均<0.05)。见图2。
2.3各组细胞中缺氧及凋亡相关因子mRNA表达情况 缺氧造模组细胞中HIF-1α、VEGF、Caspase-1、p53 mRNA相对表达量均明显高于空白对照组(P均<0.05)。依托考昔组HIF-1α mRNA相对表达量明显高于缺氧造模组(P<0.05),VEGF、Caspase-1、p53蛋白相对表达量与缺氧造模组比较差异均无统计学意义(P均>0.05);温肾壮阳方各组HIF-1α mRNA相对表达量与缺氧造模组比较差异均无统计学意义(P均>0.05),VEGF mRNA相对表达量均明显高于缺氧造模组(P均<0.05);中浓度温肾壮阳方组、高浓度温肾壮阳方组Caspase-1、p53 mRNA相对表达量均明显低于缺氧造模组(P均<0.05)。见图3。
2.4各组NPSCs增殖情况 空白对照组NPSCs占总活细胞比例为80.59%,缺氧造模组为45.10%,依托考昔组为43.31%,低、中、高浓度温肾壮阳方组分别为47.96%,54.49%,40.65%。各造模组NPSCs占比均明显低于空白对照组(P均<0.05),中浓度温肾壮阳方组NPSCs占比明显高于缺氧造模组、依托考昔组、高浓度温肾壮阳方组(P均<0.05)。见图4。
3 讨 论
椎间盘长期处于缺氧环境中,缺氧是椎间盘退变的重要因素之一[7]。本研究采用温肾壮阳方含药血清干预缺氧诱导的髓核细胞,意在探讨温肾壮阳方对于椎间盘退变的干预机制。
CCK-8及流式细胞术检测显示,经过缺氧诱导的髓核细胞存活率明显降低,较好地模拟了髓核细胞的缺氧环境。依托考昔组细胞生存率以及NPSCs比例相比缺氧造模组反而下降,提示依托考昔针对缺氧诱导的髓核细胞并无细胞保护作用,甚至有促进凋亡的作用。而既往在骨关节炎的研究中,依托考昔显示出明显的抗炎镇痛效果,并且通过其抗炎效应来维持细胞生存[8]。本项关于髓核细胞的研究中,依托考昔表现出相反的效应,与COX-2特异性抑制剂的抗癌作用[9]有相似之处,即COX-2特异性抑制剂能够诱导肿瘤凋亡相关因子的表达,促进肿瘤细胞凋亡[10]。考虑到椎间盘是人体最大的免疫特权组织[11],并且长期处于与肿瘤细胞相似的低氧环境中[12],髓核细胞的生理功能与普通的软骨细胞相比可能有所差异,且髓核细胞缺氧机制与软骨细胞炎性损伤机制并不相同,导致了依托考昔在本项研究中产生了不同的效应,但具体机制仍待进一步研究。另外,中、高浓度温肾壮阳方组的细胞存活率和中浓度温肾壮阳方组NPSCs比例明显高于缺氧造模组,提示中高浓度温肾壮阳方能够有效提高髓核细胞存活率,但高浓度温肾壮阳方对于NPSCs的增殖并无明显作用,可能原因是中浓度温肾壮阳方通过促进NPSCs增殖而减少细胞的凋亡,而高浓度温肾壮阳方促使干细胞向其他种类细胞分化。由于VEGF是血管生成的特异性代表因子[13],结合温肾壮阳方对于VEGF的激活功能,以及高浓度温肾壮阳方干预后CD73+CD90、CD105阳性细胞的占比降低,提示高浓度温肾壮阳方可能改变了NPSCs的表型,使之向血管内皮细胞分化,这需要进一步的实验确认。

图2 空白对照组和缺氧诱导各组髓核细胞中缺氧与凋亡相关蛋白表达情况
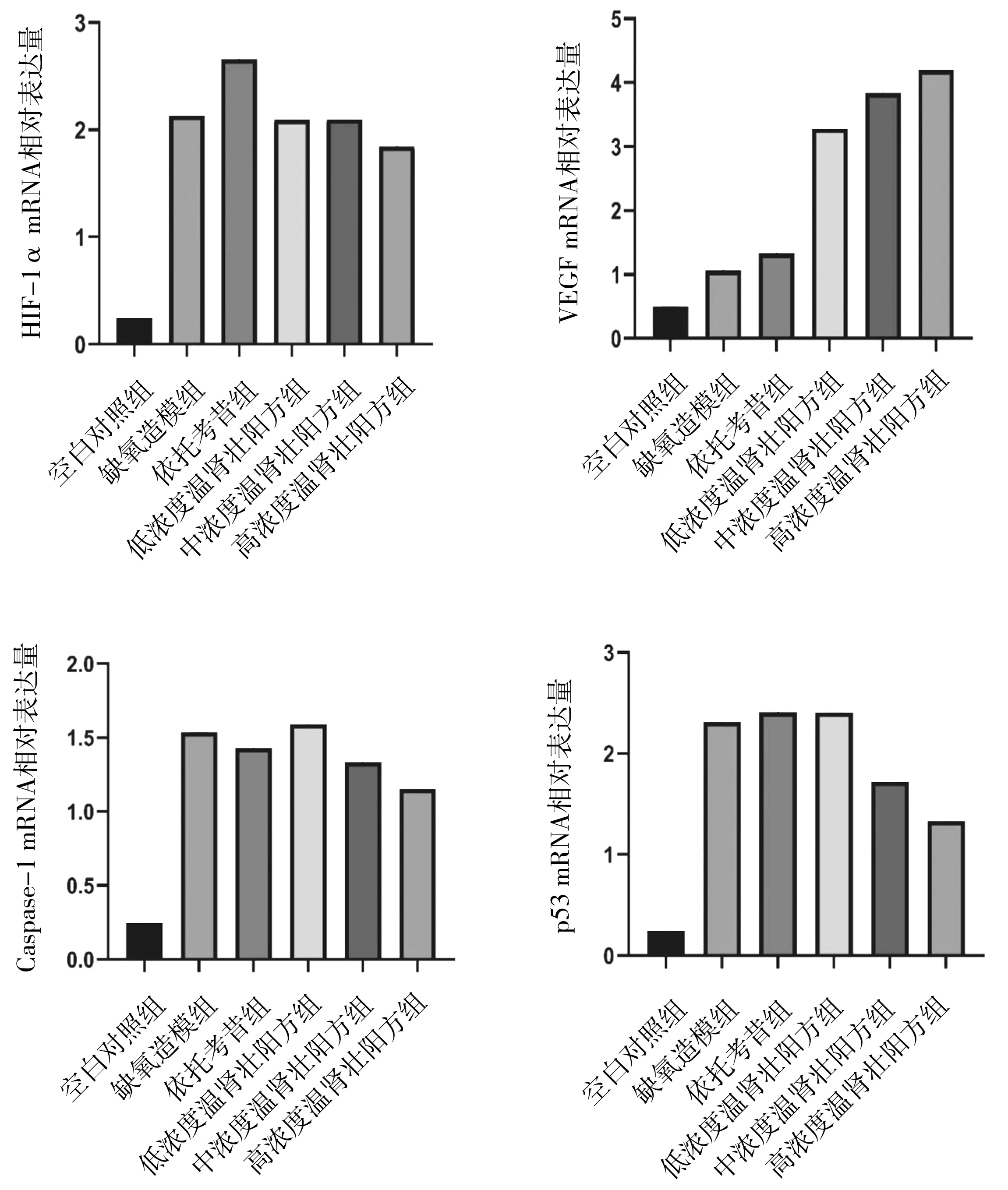
图3 空白对照组和缺氧诱导各组髓核细胞中缺氧与凋亡相关蛋白mRNA表达情况

图4 空白对照组和缺氧诱导各组髓核间充质干细胞占总活细胞比例
HIF-1α是细胞适应缺氧的主要调节因子,其有明显的抗炎作用[14]。本研究结果显示,依托考昔可促进HIF-1α过表达,符合依托考昔所公认的抗炎效应[15];而温肾壮阳方对于HIF-1α并无明显调控效应,说明温肾壮阳方有效成分可能并无抗炎作用。VEGF是炎性分子的招募因子之一[16],温肾壮阳方明显上调了VEGF的表达,所以间接引发了炎症反应。综上所述,温肾壮阳方也许并无抑制炎症的功能,其可能在一定程度上能够维持机体的低水平炎症反应,并且由于VEGF是血管生成的特异性代表因子,能够促进血管的形成,可能提示温肾壮阳对于髓核细胞向血管内皮细胞分化有着特异性的激活作用,长期来看有利于血管的分化与生成,改善组织内部灌注功能,使组织重吸收,促进组织修复。这与临床上观察到温肾壮阳方的治疗效果相一致,例如温肾壮阳方可以有效改善肾阳虚证患者的肢体发冷情况,其机制有可能是因为VEGF的激活,招募炎症因子,并促进了血管生成,改善了机体的血液灌注。关于温肾壮阳方的血管生成效应,还需要进一步的动物模型研究与临床研究进行确认。
虽然温肾壮阳方能够上调VEGF表达并促进血管生成,但是关于VEGF激活后血管生成对于椎间盘退变的影响仍旧未有定论。因为在临床治疗中,椎间盘血管化对于椎间盘退变的影响一直存在争论。首先,在胚胎时期椎间盘血管便开始退变,成人椎间盘生理情况下并无血管存在[17]。在椎间盘退变的过程中,长期的低氧环境诱导了HIF-1α的持续表达[18],VEGF作为HIF-1α的下游因子也在退变的椎间盘中持续生成[19]。Freemont等[20]研究发现,退变椎间盘中神经与血管会在椎间盘内伴行生长,这种病理改变是导致盘源性腰痛的病理基础。徐坤林等[21]研究发现,突出的椎间盘组织在接触血运后诱发了连续的免疫炎性反应,此时促进了血管的分化与形成,这对突出椎间盘重吸收起到了关键性作用。所以, VEGF的激活以及血管的生成对于椎间盘退变的影响依旧存在争论:首先,VEGF的激活以及血管的生成常常会伴随神经生长,这是临床产生椎间盘退变并导致盘源性腰痛的病理基础,所以VEGF有可能是导致盘源性腰痛的关键因子之一。其次,VEGF的激活以及血管的生成改善了局部血流灌注,引发了局部的免疫反应,促进了椎间盘的重吸收和组织修复,提示VEGF发挥了促进椎间盘修复的作用。所以在临床使用温肾壮阳方时,应当考虑到VEGF激活后对于椎间盘的双重影响,针对神经伴行可能产生盘源性腰痛的情况,还需要进一步研究与神经生长因子抑制剂联合使用效果,以指导临床用药。
利益冲突:所有作者均声明不存在利益冲突。

