基于 TGR5/cAMP/PKA信号通路探讨疏肝、健脾疗法对肝损伤大鼠的作用及机制
魏伟莉,郑智礼,邓秀兰,高艺宁,史兴华,钟相根
(北京中医药大学中医学院,北京100029)
肝脏在维持代谢动态平衡,排泄外源性和内源性有毒物质方面起着关键作用,肝脏损伤可导致肝脏炎症、肝脂肪变性、肝纤维化等多种病理改变[1-2]。胆汁酸由肝脏中胆固醇合成并进入肠道,可调节肠道菌群的组成[3],肝损伤时造成的胆汁酸代谢改变可引起肠道菌群失衡和肝脏炎症[4]。G蛋白偶联受体5(TGR5)是G蛋白偶联受体(GPCRs)大家族中的成员,是胆汁酸膜受体,在肝脏枯否细胞、结肠中表达[5-6],并在小鼠肝脏中具有抗炎特性[7],调节其表达可能是治疗肝损伤的有效靶点。目前治疗肝损伤的西药有限,中医药的应用越来越多。四逆散具有疏肝理脾、透邪解郁的功效[8],可调节非酒精性脂肪性肝炎大鼠脂代谢紊乱、改善胰岛素抵抗、减轻肝细胞损伤[9];四逆散加味对大鼠肝纤维化有明显的预防和治疗作用[10]。六君子汤具有益气健脾、燥湿化痰的功效,能预防阿霉素所致的肝细胞损伤[11],有效预防抗生素相关性肠道菌群失调[12]。但两种方药辨治证型有所不同,对肝损伤的保护作用机制尚不明确 。本实验将四逆散作为疏肝方、六君子汤作为健脾方,基于TGR5/环磷酸腺苷(cAMP)/蛋白激酶A(PKA)信号通路探讨了疏肝、健脾治疗对于肝郁叠加肝损伤大鼠肝脏的作用及机制,旨在为肝损伤的临床治疗提供实验依据。
1 实验材料与方法
1.1实验动物 30只清洁级雄性SD大鼠,体重(180±20)g,由斯贝福(北京)生物技术有限公司提供,动物合格证号:SCXK(京)2019-0010。饲养条件:室温(25±5)℃,相对湿度(55±5)%,采用12 h/12 h明暗光照,自由摄食饮水。本实验经北京中医药大学动物伦理委员会批准(BUCM-4-2019082602-3073)。
1.2药物和试剂 双环醇片(北京协和药厂,国药准字H20040467,规格:25 mg/片);四逆散(柴胡12 g、白芍15 g、枳壳10 g、炙甘草5 g),六君子汤(党参15 g、茯苓10 g、白术10 g、炙甘草5 g、法半夏10 g、陈皮10 g、焦神曲10 g、焦山楂10 g、焦麦芽10 g)组方中中药饮片均购于北京同仁堂医药药材有限公司,经北京中医药大学中药学院李向日教授鉴定,药物符合2020年版《中华人民共和国药典》规范。药物煎煮方法:先加药物组方10倍量纯水浸泡2 h,药物煎煮至沸腾,保持沸腾40 min后过滤药液,滤渣再加8倍量纯水煎煮40 min,过滤,2次煎煮滤液合并后文火浓缩,四逆散、六君子汤含生药质量浓度分别为0.21 g/mL和0.45 g/mL,4 ℃保存备用。四氯化碳(CCl4,上海沪试化工有限公司,批号:20180129);肝功能生化指标检测试剂原厂配套试剂(BECKMAN COULTER,USA);RNA提取液、Servicebio®RT First Strand cDNA Synthesis Kit、2×SYBR Green qPCR Master Mix(None ROX)(Servicebio,G3013、G3330、G3320);兔抗TGR5多克隆抗体(Abcam,ab72608);AB-PAS染液(Servicebio,G1049)。
1.3仪器 石蜡切片机(Leica,RM2245);组织包埋机(Leica,EG1150H);脱水机(DIAPATH,Donatello);烤箱(上海慧泰仪器制造有限公司,DHG-9140A);光学显微镜(Olympus,BX5);荧光定量PCR仪(Bio-rad,CFX96);超微量分光光度计(Thermo,NanoDrop2000);全自动生化分析仪(Beckman Coulter,CX4Pro);台式高速冷冻型微量离心机(DragonLab,D3024R)。
1.4实验方法 大鼠适应性喂养7 d后,采用随机数字表法分为正常组、模型组、双环醇组、四逆散组、六君子汤组,每组6只。正常组大鼠不进行造模,其余组大鼠采用束缚叠加CCl4橄榄油溶液皮下注射的方法制备肝郁叠加肝损伤模型。慢性束缚方式[13]:将大鼠放于特制的束缚筒内,根据大鼠体重,通过拧动螺丝固定束缚筒前端的筒塞及调节束缚筒后端的插片进行相应的活动空间调整,空间大小以大鼠无强烈反抗动作为准。每天开始束缚的时间随机,持续束缚的时间从开始的4 h/d逐渐增加到6 h/d,1次/d,连续束缚42 d,束缚期间大鼠禁食并禁水。造模期间,各组大鼠均给予新鲜配制的40% CCl4橄榄油溶液5.89 g/kg皮下注射[14],正常组大鼠皮下注射等容量橄榄油溶液,均1次/3 d;同时双环醇组给予双环醇0.2 g/kg灌胃(1次/d),四逆散组、六君子汤组分别给予四逆散4.32 g/kg、六君子汤9.26 g/kg灌胃(中药给药剂量参照普通成人体重60 kg的临床用量、大鼠与人的等效剂量换算及本课题组实验研究而定[15-16],均1次/d),正常组与模型组大鼠给予等体积去离子水灌胃(1次/d),均持续42 d。以血清ALT、AST、ALP水平明显升高为大鼠肝损伤造模成功。
1.5观察指标及检测方法
1.5.1肝功能生化指标 末次灌胃结束后,麻醉各组大鼠,腹主动脉取血 ,使用全自动生化分析仪测定血清ALP、ALT、AST、TBil、DBil水平。
1.5.2肝脏组织中TNF-α、IL-6、cAMP、PKA mRNA表达情况 采用RT-PCR法检测:取大鼠肝脏组织,将组织充分研磨后取上清液,提取总RNA,使用Nanodrop 2000检测RNA浓度及纯度后进行反转录,加入Total RNA 10 μL作为模板,反转录程序设置条件为25 ℃ 5 min,42 ℃ 30 min;结束后85 ℃保温5 s灭活反转录酶,然后进行定量PCR,PCR扩增反应条件:95 ℃预变性30 s;95 ℃变性15 s,60 ℃延伸30 s,共进行40个循环。熔解曲线为65 ℃ 95 ℃,每升温0.5 ℃采集1次荧光信号。用甘油醛-3-磷酸脱氢酶(GAPDH)作内参,通过2-ΔΔCT法计算肝脏组织中TNF-α、IL-6、cAMP、PKA mRNA相对表达量。各引物由武汉赛维尔生物科技有限公司设计合成,引物序列见表1。
1.5.3肝脏、结肠组织中TGR5阳性表达情况 采用免疫组化法检测:取出4%甲醛固定好的肝脏、结肠组织并进行切片,将切片依次放入脱蜡液Ⅰ、Ⅱ、Ⅲ,每次15 min;浓度梯度乙醇浸泡,每次5 min;将切片放于抗原修复液并在微波炉中进行抗原修复;使用3 %双氧水进行封闭;在组织上均匀滴加3 % BSA,室温30 min;加一抗,50 μL/片,4 ℃湿盒内孵育过夜;加入二抗,50 μL/片,37 ℃室温孵育50 min;再进行DAB显色、复染细胞核、脱水封片等处理。显微镜下每张切片随机取6个视野,在放大相同倍数(×400)条件下进行观察,以出现棕褐色为TGR5阳性表达,然后采集图像,用Image-Pro Plus 6.0软件进行定量分析,计算平均光密度值(阳性细胞染色的累积光密度与区域面积比值) 。
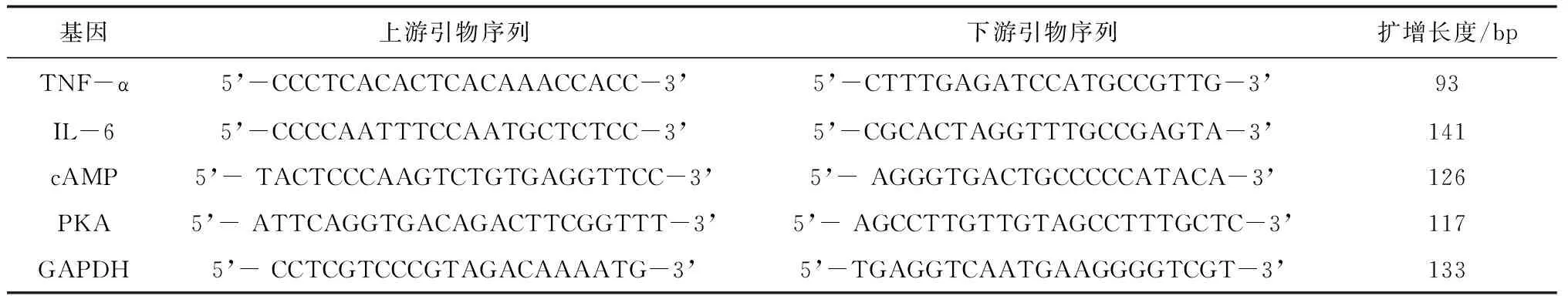
表1 TNF-α、IL-6、cAMP、PKA mRNA检测引物序列
1.5.4结肠组织中杯状细胞数量 采用 AB-PAS法检测:将4%甲醛固定好的结肠组织进行切片,按照AB-PAS染液试剂说明严格进行染色操作。每张切片随机取6个视野进行观察,以杯状细胞蓝染为阳性表达,用Image-Pro Plus 6.0软件进行定量分析,记录每张切片视野下出现的阳性细胞数量。
2 结 果
2.1各组大鼠肝功能生化指标比较 模型组大鼠血清ALP、ALT、AST、TBil、DBil水平均明显高于正常组(P均<0.05)。双环醇组、四逆散组血清ALP、ALT、AST、TBil、DBil水平及六君子汤组ALP、ALT、TBil、DBil水平均明显低于模型组(P均<0.05)。四逆散组ALP水平明显低于双环醇组、六君子汤组(P均<0.05),双环醇组DBil水平明显低于四逆散组、六君子汤组(P均<0.05)。见表2。
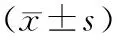
表2 正常组和肝郁叠加肝损伤各组大鼠血清ALP、ALT、AST、TBil、DBil水平比较
2.2各组大鼠肝脏组织中TNF-α、IL-6 mRNA相对表达量比较 与正常组比较,模型组大鼠IL-6 mRNA相对表达量明显升高(P<0.05),cAMP、PKA mRNA相对表达量均明显降低(P均<0.05)。与模型组比较,双环醇组、四逆散组TNF-α、IL-6 mRNA相对表达量均明显降低(P均<0.05),四逆散组cAMP、PKA mRNA相对表达量和双环醇组PKA mRNA相对表达量、六君子汤组cAMP mRNA相对表达量均明显升高(P均<0.05);且四逆散组TNF-α、IL-6 mRNA相对表达量均明显低于六君子汤组(P均<0.05),PKA mRNA相对表达量明显高于六君子汤组(P<0.05);四逆散组各指标与双环醇组比较差异均无统计学意义(P均>0.05)。见表3。
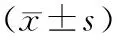
表3 正常组和肝郁叠加肝损伤各组大鼠肝脏组织中TNF-α、IL-6、cAMP、 PKA mRNA相对表达量比较
2.3各组大鼠肝脏、结肠组织中TGR5阳性表达情况比较 与正常组比较,模型组大鼠肝脏组织中TGR5阳性表达平均光密度值明显降低(P<0.05),结肠组织中TGR5阳性表达平均光密度值明显升高(P<0.05);与模型组比较,双环醇组、四逆散组、六君子汤组肝脏组织中TGR5阳性表达平均光密度值均明显升高(P均<0.05),双环醇组、四逆散组、六君子汤组结肠组织中TGR5阳性表达平均光密度值均明显降低(P均<0.05);各药物组间肝脏、结肠组织中TGR5阳性表达平均光密度值比较差异均无统计学意义(P均>0.05)。见图1、图2及表4。
2.4各组大鼠结肠组织中杯状细胞数量比较 正常组和模型组杯状细胞数量分别为(83.67±10.60)个/视野和(53.67±14.05)个/视野,模型组杯状细胞数量明显少于正常组(P<0.05);双环醇组、四逆散组、六君子汤组杯状细胞数量分别为(82.50±12.82)个/视野、(76.50±5.01)个/视野、(84.33±5.57)个/视野,各药物组杯状细胞数量均明显多于模型组(P均<0.05);各药物组间杯状细胞数量比较差异均无统计学意义(P均>0.05)。见图3。
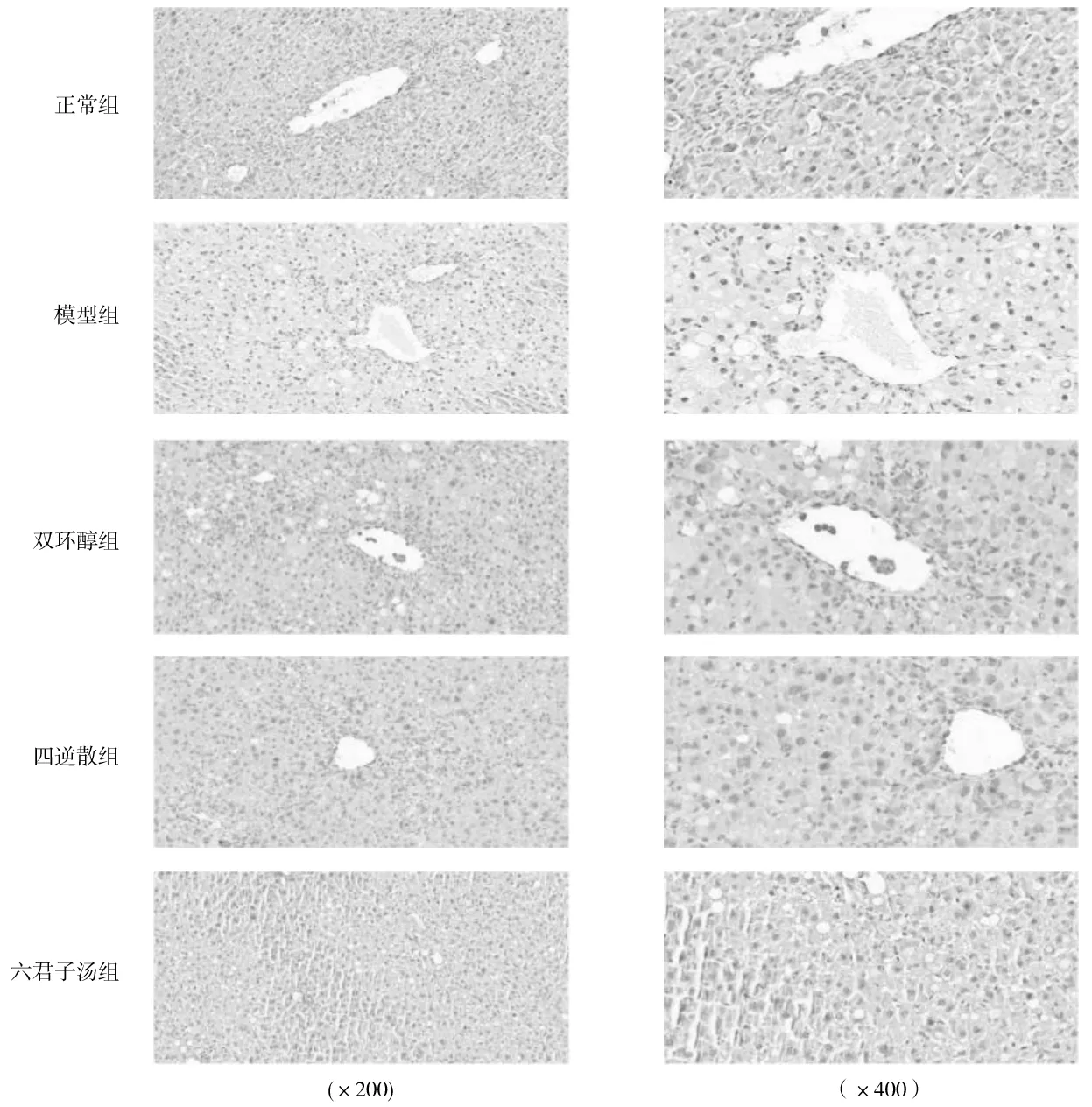
图1 正常组和肝郁叠加肝损伤各组大鼠肝脏组织中TGR5阳性表达情况(免疫组化染色)
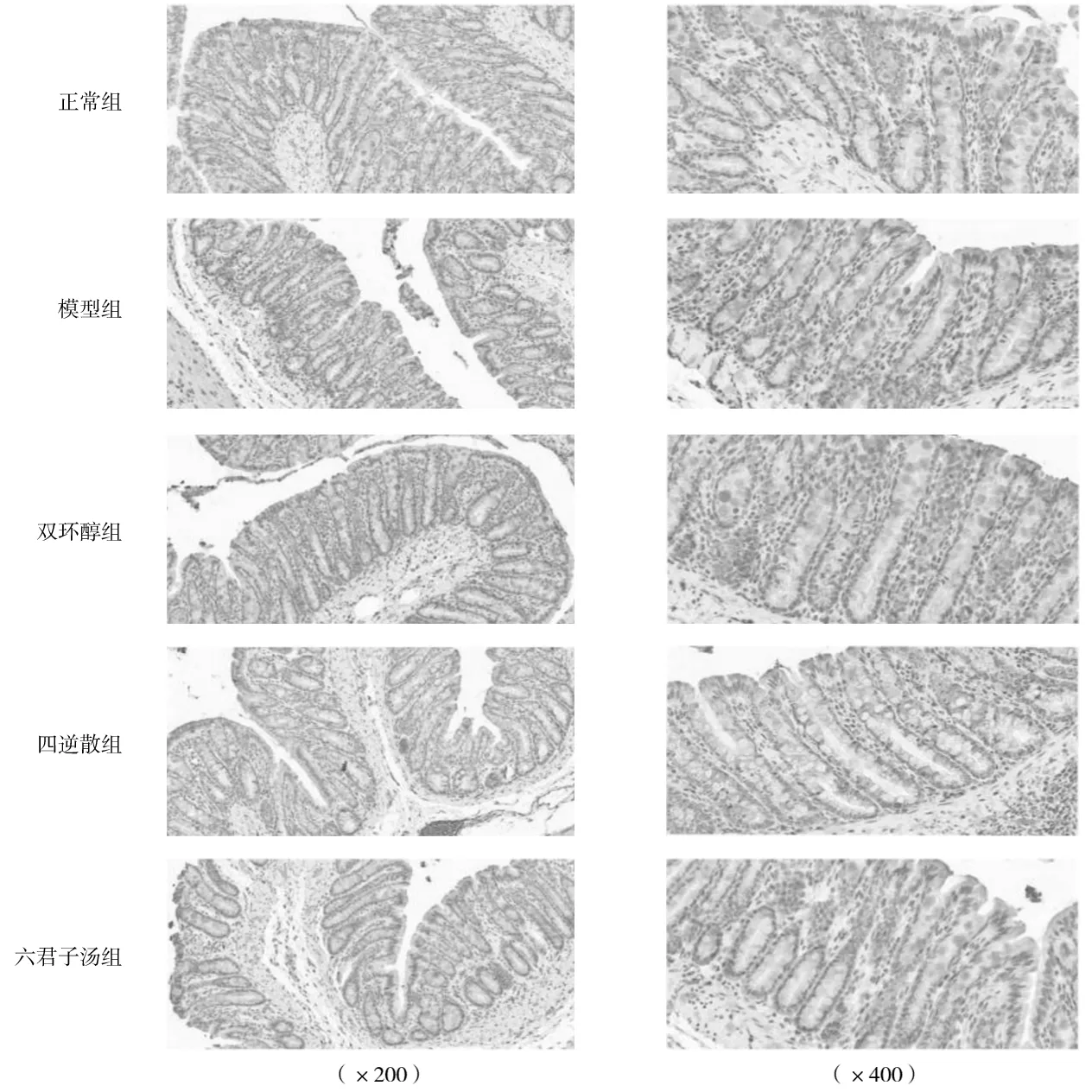
图2 正常组和肝郁叠加肝损伤各组大鼠结肠组织中TGR5阳性表达情况
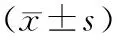
表4 正常组和肝郁叠加肝损伤各组大鼠肝脏、结肠组织中TGR5阳性表达平均光密度值比较
3 讨 论
肝损伤时肠黏膜屏障被破坏,肠道通透性增加,肠道菌群失调和细菌过度生长,随之而来的细菌易位使细菌及其产物从胃肠道经门静脉循环和淋巴系统进入肝脏,加重肝损伤[17-20]。另外,肝脏枯否细胞产生过量的TNF-α和其他促炎介质,引发肝脏炎症[21]。杯状细胞位于肠上皮内,是胃肠道重要的分泌细胞,杯状细胞的产物之一是黏蛋白,黏蛋白能形成一种覆盖在上皮表面的生物凝胶,对维持肠道屏障至关重要[22]。本实验以束缚叠加CCl4制造肝郁叠加肝损伤病证结合动物模型,结果显示模型组大鼠血清ALP、ALT、AST、TBil、DBil水平及肝组织中IL-6 mRNA相对表达量均明显升高,肠组织中杯状细胞数量显著减少,表明大鼠肝功能和肠道受损;双环醇、四逆散、六君子汤灌胃均能在一定程度上改善肝功能和增加肠组织中杯状细胞数量,双环醇和四逆散灌胃能下调肝组织中IL-6、TNF-α mRNA表达,六君子汤灌胃对TNF-α、IL-6表达无明显影响但杯状细胞数量略多于四逆散灌胃,提示四逆散疏肝治疗更有利于减轻肝脏炎症,六君子汤健脾治疗有利于肠道功能的改善。
肝的生理功能包含了排泄胆汁、分泌胆汁,胆汁参与食物和水液的消化与吸收。TGR5是胆汁酸膜受体,TGR5被激活后,随即释放Gαs亚基并激活cAMP,细胞内cAMP浓度增加进而激活PKA,PKA使cAMP反应元件结合蛋白(CREB)磷酸化,抑制巨噬细胞、树突状细胞中核因子-κB的激活,进而减少IL-1α、IL-1β、IL-6、IL-8、TNF-α的释放及各种黏附分子如E-选择素、血管细胞黏附分子-1(VCAM-1)、细胞间黏附分子-1(ICAM-1)的表达,减轻炎症反应[23-29]。本实验结果显示,模型组大鼠肝脏组织中TGR5阳性表达及cAMP、PKA mRNA表达减少,结肠组织中TGR5阳性表达增加;与模型组比较,四逆散组肝脏组织中TGR5阳性表达及cAMP、PKA mRNA表达增加,结肠组织中TGR5阳性表达减少;六君子汤组肝脏组织中TGR5阳性表达及cAMP mRNA表达增加,结肠组织中TGR5阳性表达减少,但肝脏组织中PKA mRNA表达无明显变化。结合先前研究六君子汤可上调肝郁叠加肝损伤大鼠肠黏膜紧密连接蛋白表达[20],肝脏免疫应答对从消化道流入的许多抗原具有耐受性,这种耐受性使肝脏不像其他器官那样容易发生排斥反应[30],故推测六君子汤健脾治疗可能通过调节肠道菌群、减少细菌易位而发挥间接作用 ;四逆散疏肝治疗能激活TGR5/cAMP/PKA信号通路,增加肝脏TGR5含量,激活TGR5导致细胞中cAMP水平升高,cAMP水平升高进一步激活PKA,PKA磷酸化下游效应元件结合因子(CREB-P),被激活的CREB-P可结合至特定位点,调节相关基因的表达,减少肝脏炎症因子TNF-α、IL-6的表达,从而减轻肝损伤。
综上所述,在肝郁叠加肝损伤状态下,六君子汤健脾治疗通过维护肠道内环境从而防止肝损伤进一步发展;四逆散疏肝治疗对于维护肠道屏障功能是有利的,其减轻肝脏炎症作用优于六君子汤健脾治疗,其作用机制可能与TGR5/cAMP/PKA信号通路的激活有关。
利益冲突:所有作者均声明不存在利益冲突。

