发酵豆制品中氨肽酶产生菌的分离鉴定及固态发酵工艺优化
李冬琪,程江华,万娅琼,尤逢惠,徐雅芫*
(1.安徽省农业科学院 农产品加工研究所,安徽 合肥 230031;2.安徽省食品微生物发酵与功能应用工程实验室,安徽 合肥 230031)
豆制品富含蛋白质、脂肪、维生素、不饱和脂肪酸等营养成分[1],蛋白质的相对分子质量较大,不利于人体的消化吸收[2],蛋白质水解生成的小肽与游离氨基酸的溶解性、营养特性都明显优于蛋白质本身[3],容易被人体肠道细胞吸收并进入循环[4]。蛋白质的水解液对滋味的贡献可分为鲜味、甜味、苦味和无味[5],而其中大多数呈现苦味,究其原因是当蛋白质大分子酶解时,肽链中含有的疏水性氨基酸暴露出来,接触味蕾,产生苦味[6]。苦味的产生限制了蛋白质水解物的应用,因此减少、阻止和去除蛋白质水解物的苦味,就显得尤为重要。氨肽酶(Aminopeptidase)是一种肽链外切蛋白酶,能够从多肽链的氨基末端由外向内依次切断肽键,使氨基酸逐个游离出来形成小肽和游离氨基酸,更利于人体吸收,增加了发酵食品的风味[7],且其可切除苦味肽氨端的疏水氨基酸从而去除苦味[8]。因此氨肽酶可以广泛用于肉制品、豆制品等高蛋白食品加工工业等,减少苦味的同时也可以增加游离氨基酸,提高食品营养价值;并且氨肽酶还可用于蛋白序列测序的分子工具以及重组蛋白或融合产物的固化剂[9-11]。因此,氨肽酶在食品工业上可以与蛋白酶协同作用,增加发酵食品游离氨基酸含量,提高营养价值,改善食品风味。
氨肽酶广泛存在于不同物种的生物体中,包括哺乳动物、植物、微生物等。由于动植物体内成分复杂、氨肽酶含量较低,导致提取成本较高[12]。微生物作为氨肽酶的重要来源,其种类多、繁殖快、易于培养管理等优点适应大规模工业化生产[13],同时还可以应用现代生物学技术对产氨肽酶微生物进行改造,提高酶产量,改变酶学特性[14]。因此筛选到高产氨肽酶的菌种,特别是我国食品安全管理规定中可用于食品领域的微生物菌种尤为重要[15]。本研究以传统发酵豆制品为分离源,以高产氨肽酶为目标分离筛选产酶菌株,研究固态发酵的适宜条件,通过检测小肽及总游离氨基酸的含量评判其发酵效果,为该菌株在食品发酵工业中的应用提供参考。
1 材料与方法
1.1 材料与试剂
传统发酵豆酱:采自皖北民间作坊,放置于无菌取样盒中于4 ℃保存;黄豆粉:由安徽合肥中黄901品种的大豆经过研磨过100目筛所得,置于4 ℃冰箱中储存备用。
KH2PO4、Na2HPO4、L-亮氨酸-对硝基苯胺、水合茚三酮、乙二醇、三氯乙酸等(均为分析纯):上海阿拉丁生化科技股份有限公司;上海麦克林生化科技股份有限公司。
富集培养基:可溶性淀粉8 g/L,酵母膏2 g/L,干酪素10 g/L,KH2PO42 g/L,MgSO4·7H2O 0.2 g/L,pH 7.0。
筛选培养基:乳糖10 g/L,酪蛋白胨10 g/L,酵母粉5 g/L,NaCl 5 g/L,琼脂18 g/L,调节pH 7.0。
产酶培养基:牛肉膏10g/L,酵母膏10g/L,葡萄糖20g/L,蛋白胨10 g/L,K2HPO42 g/L,醋酸钠5 g/L,MgSO4·7H2O 0.2 g/L,MnSO4·4H2O 0.5 g/L,吐温80 1 g/L,柠檬酸三钠2 g/L,琼脂18 g/L,pH 7.0。
以上培养基均在115 ℃高压蒸汽灭菌20 min。
1.2 仪器与设备
BCC-2000生化培养箱:福建九圃生物科技有限公司;ZQZY-CS8振荡培养箱:北京经日今典科技有限公司;UV-752紫外可见分光光度计:东菀市谱标试验器材科技有限公司;HH-WO-20L电热恒温水浴锅:上海壹茗实业有限公司;LC-LX-H165A台式高速离心机:深圳市益百顺科技有限公司;BF-1000-2C电子分析天平:北京赛欧华创科技有限公司;BPH-9140AS高温烘干箱:武汉森苏科技有限公司。
1.3 方法
1.3.1 高产氨肽酶菌株的筛选
称取1 g传统发酵豆酱样品于10 mL无菌水中,振荡混合均匀后取2.0 mL接入富集培养基中37 ℃培养48 h,取富集培养菌液倍比稀释后均匀涂布到筛选培养基上,37 ℃培养。观察菌落形态,挑取长势较好的菌落平板划线形成单菌落,测量水解透明圈(D)与菌落直径(d)比值(D/d),选择比值较大的菌落,传代纯化,并分别适量接种于产酶培养基中37 ℃培养48 h,采用LNA法测定氨肽酶活力[16],选取氨肽酶活力最高的菌株进行后续试验。
1.3.2 高产氨肽酶菌的鉴定
形态学观察:通过裸眼观察单菌落形态特征(颜色、形状、质地等)。用革兰氏染色[17],扫描电镜观测菌体[18-19]。
生理生化检测:将菌株接种于固体斜面培养基上,37 ℃条件下恒温培养24 h送上海复达检测技术集团有限公司采用API Plus自动判读系统、CHL微生物鉴定系统进行菌株生理生化特性分析[20]。
分子生物学鉴定:菌株MRS平板送至上海生工生物有限公司测试,并在美国国家生物技术信息中心(national center for biotechnology information,NCBI)的GenBank数据库进行基本局部比对搜索工具(basic local alignment search tool,BLAST)同源关系序列比对,最后使用程序MEGA 6构建系统进化树并进行菌种鉴定[21-22]。
1.3.3 高产氨肽酶菌固态发酵条件的优化
(1)单因素试验
以筛选菌株对数生长期菌液为种子液接种于装有100 g黄豆粉的分装袋中进行固态发酵,通过单因素试验,对固态发酵原料的初始含水量(50%、55%、60%、65%、70%),发酵时间(3 d、6 d、9 d、12 d、15 d),发酵温度(33 ℃、35 ℃、37 ℃、39 ℃、41 ℃),接种量(2%、4%、6%、8%、10%),起始pH(4.5、5.5、6.5、7.5、8.5)5个因素进行优化,分析发酵产物中小肽含量与总游离氨基酸含量,以确定固态发酵显著影响因子及水平范围,试验重复3次,计算平均值。
(2)正交试验
根据单因素试验结果,选择对小肽含量与总游离氨基酸有显著影响的3个因素:含水量(A)、培养时间(B)、接种量(C),设计3因子3水平L9(33)正交试验[23-25],正交试验因素与水平见表1。

表1 菌株IFJ1固态发酵条件优化正交试验因素与水平Table 1 Factors and levels of orthogonal experiments for solid-state fermentation conditions optimization of strain IFJ1
1.3.4 总游离氨基酸和小肽含量的测定
总游离氨基酸的测定:茚三酮法[26],以精氨酸作为对照品,在波长570 nm处测定总游离氨基酸的吸光度值,根据下面公式计算总游离氨基酸含量:

1.3.5 试验数据统计学分析
单因素方差(analysis of variance,ANOVA)分析和差异显著性分析均由WPS office 2018、IBM SPSS Statistics 25和GraphPad Prism 8.0.2完成,正交试验设计使用正交设计助手;绘图由GraphPad Prism 8.0.2完成。结果用“平均值±标准差”表示,P<0.01表示差异极显著,P<0.05表示差异显著。
2 结果与分析
2.1 高产氨肽酶菌株的筛选
从初筛平板上挑取10个周边有透明圈的菌落,其D/d值如表2所示。

表2 初筛菌株的D/d值Table 2 D/d value of primary screened strain
由表2可知,D/d值较大的5株菌为IFJ1、IFJ7、IFJ9、IFJ18、IFJ20,对其氨肽酶活力进行测定,产酶情况见图1。由图1可知,菌株IFJ1发酵液酶活力最高,发酵24 h的氨肽酶活力达到(1 853.98±11.37)U/mL,与有关文献报道的德氏乳杆菌、蜡样芽孢杆菌、乳酸乳球菌等菌株相比[30-31],属于产氨肽酶能力较强的菌,故优选菌株IFJ1进行下一步试验。
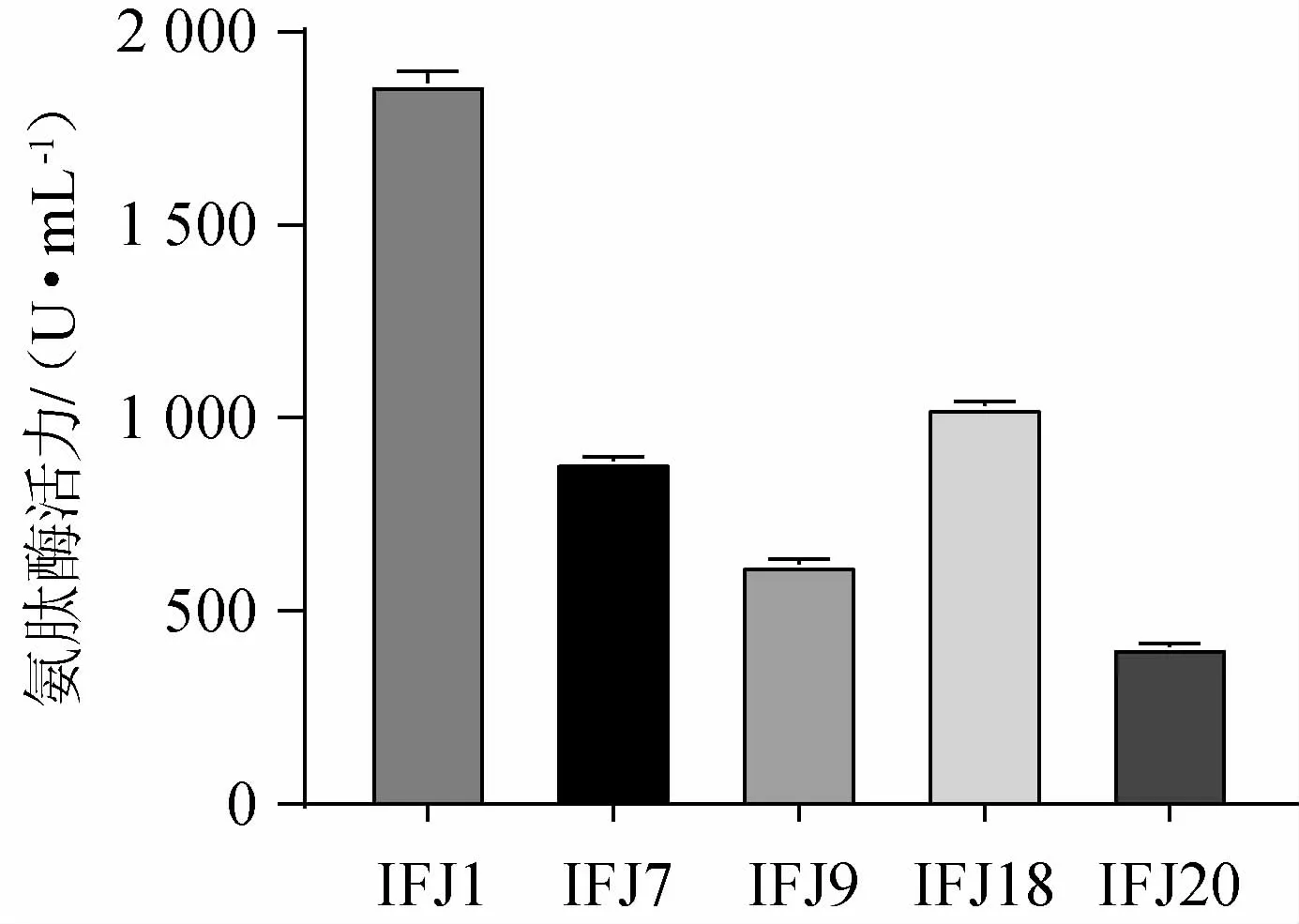
图1 复筛菌株的氨肽酶活力Fig.1 Aminopeptidase activity of re-screened strains
2.2 高产氨肽酶菌株的鉴定
菌株IFJ1的菌落形态特征、革兰氏染色结果、扫描电镜图见图2。

图2 菌株IFJ1的形态特征Fig.2 Morphological characteristics of strain IFJ1
由图2可知,菌株IFJ1在MRS固体培养基上的菌落特征为圆形、微白色、湿润、表面凸起,边缘光滑整齐;经革兰氏染色与显微镜观察,菌种IFJ1的菌体形态呈球形,为革兰氏阳性菌。在扫描电镜下观察,菌体的呈现形式主要是单个卵圆形,长度约为1.0~1.4 μm,无芽孢,无鞭毛。
菌株IFJ1的生理生化鉴定结果见表3。由表3可知,菌株IFJ1可发酵核糖、葡萄糖、果糖、甘露糖、甘露醇、纤维二糖、麦芽糖、乳糖、蜜二糖、蔗糖、海藻糖、棉籽糖、D-阿拉伯糖醇、苦杏仁苷等,不发酵多糖,过氧化氢酶阴性。
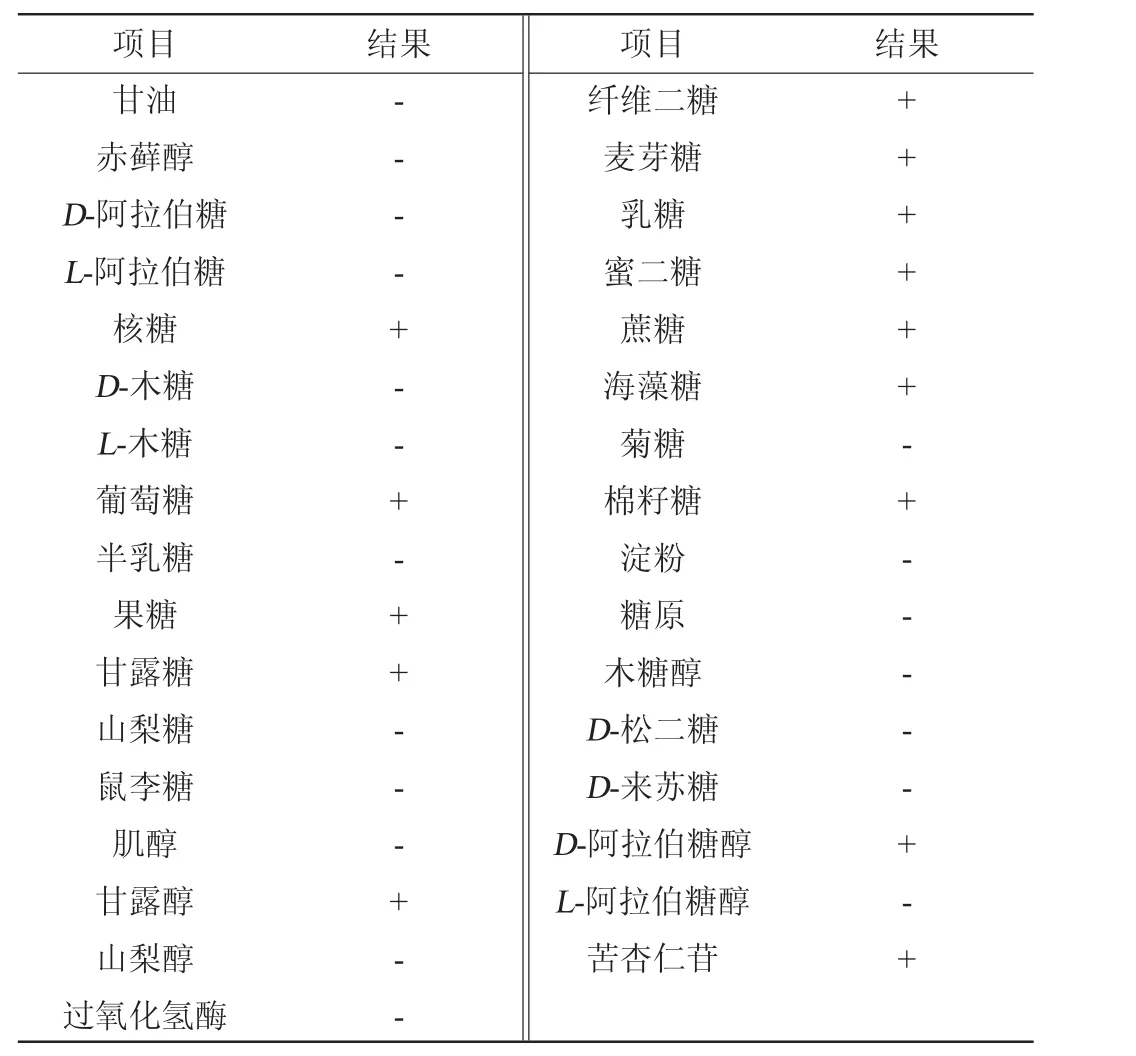
表3 菌株IFJ1生理生化鉴定结果Table 3 Physiological and biochemical identification results of strain IFJ1
对菌株IFJ1的16S rDNA基因进行测序,在GenBank中获得序列登录号为OK310791。菌株IFJ1的系统发育树见图3。

图3 基于16S rDNA基因序列菌株IFJ1的系统发育树Fig.3 Phylogenetic tree of strain IFJ1 based on 16S rDNA gene sequences
由图3可知,菌株IFJ1与乳酸片球菌(Pediococcus acidilactici)LMG 17680、Pediococcus acidilacticiDSM20284、Pediococcus loliigenes等菌株聚类在同一分枝上,因此鉴定该菌株为乳酸片球菌(Pediococcus acidilactici),菌株IFJ1专利保存编号为M2022828。研究表明,乳酸菌可产生包括氨肽酶、二肽酶、三肽酶和脯氨酸特异性肽酶等特异性肽酶[32-33],这与菌株IFJ1具有氨肽酶产生能力的性质一致。
2.3 菌株IFJ1固态发酵条件优化单因素试验
由图4A可知,随含水量的增加,发酵产物中小肽含量和总游离氨基酸含量均呈先升高后降低的趋势;含水量为55%时,发酵产物中小肽含量最高,为(11.87±0.45)%;含水量为60%时,发酵产物中总游离氨基酸含量最高,为(13.13±0.12)%,但含水量为65%时,总游离氨基酸的含量为(11.84±0.11)%,较含水量为55%时(10.80%)高。推测初始含水量较低时,后期发酵底物会较干燥,不利于微生物的生长繁殖及产酶;而随着含水量达到最适值,此时菌株生长状态最佳,发酵效果达到最佳;发酵底物水分含量过高容易产生粘黏现象,无法充分散热,不利于菌体的生长及酶产生,同时过于粘黏物料也不利微生物所产酶的分散,从而影响发酵效果[34-35]。因此,菌株IFJ1发酵的适宜含水量为55%~65%。

图4 不同发酵条件对小肽含量与总游离氨基酸含量的影响Fig.4 Effect of different fermentation conditions on small peptide and total free amino acid contents
由图4B可知,发酵产物中小肽含量和总游离氨基酸含量均随着发酵时间的增加呈先升高后降低的趋势;当发酵时间为12 d时,发酵产物中小肽含量与总游离氨基酸含量最高,分别为(11.38±0.08)%与(13.34±0.22)%;发酵前期发酵产物中小肽含量与总游离氨基酸含量逐渐上升,推测其可能原因随着发酵的进行,微生物的生长代谢产生更多的氨肽酶,增强了蛋白质酶解程度[36];当发酵时间>12 d后,发酵产物中小肽含量开始降低,推测可能是由于氮源逐渐被消耗,在发酵后期小肽进入代谢循环,导致肽得率降低。发酵时间过长,菌株进入衰亡期,产酶量逐渐减少,且部分酶开始失活,酶活力下降,发酵效率降低[37]。因此菌株IFJ1的适宜发酵时间范围为9~15 d。
由图4C可知,随着随接种量的增加,发酵产物中小肽含量和总游离氨基酸含量均呈先升高后降低的趋势;当接种量为6%时,发酵产物中小肽含量达到最大为(10.21±0.06)%,总游离氨基酸含量升至最大为(12.83±0.12)%,较接种量4%和8%时分别提高了223.87%和317.69%(P<0.05);接种量为2%~6%时,发酵产物中小肽含量与总游离氨基酸含量逐渐上升,随着接种量增大,可缩短菌株延滞期的时间,促使氨肽酶的形成分泌提早出现[38];当接种量在6%~10%时,发酵产物中小肽含量与总游离氨基酸含量开始降低,可能是因为接种量过大,菌体初期生长迅速,过早达到发酵终点,不利于氨肽酶形成和积累,除此之外还会产生大量代谢废物[39]。因此菌株IFJ1发酵的适宜接种量范围为4%~8%。
由图4D和4E可知,起始pH与发酵温度对发酵产物中小肽含量和总游离氨基酸含量的影响不显著(P>0.05)。
2.4 菌株IFJ1固态发酵条件优化正交试验
正交试验结果与分析见表4,试验结果方差分析见表5。
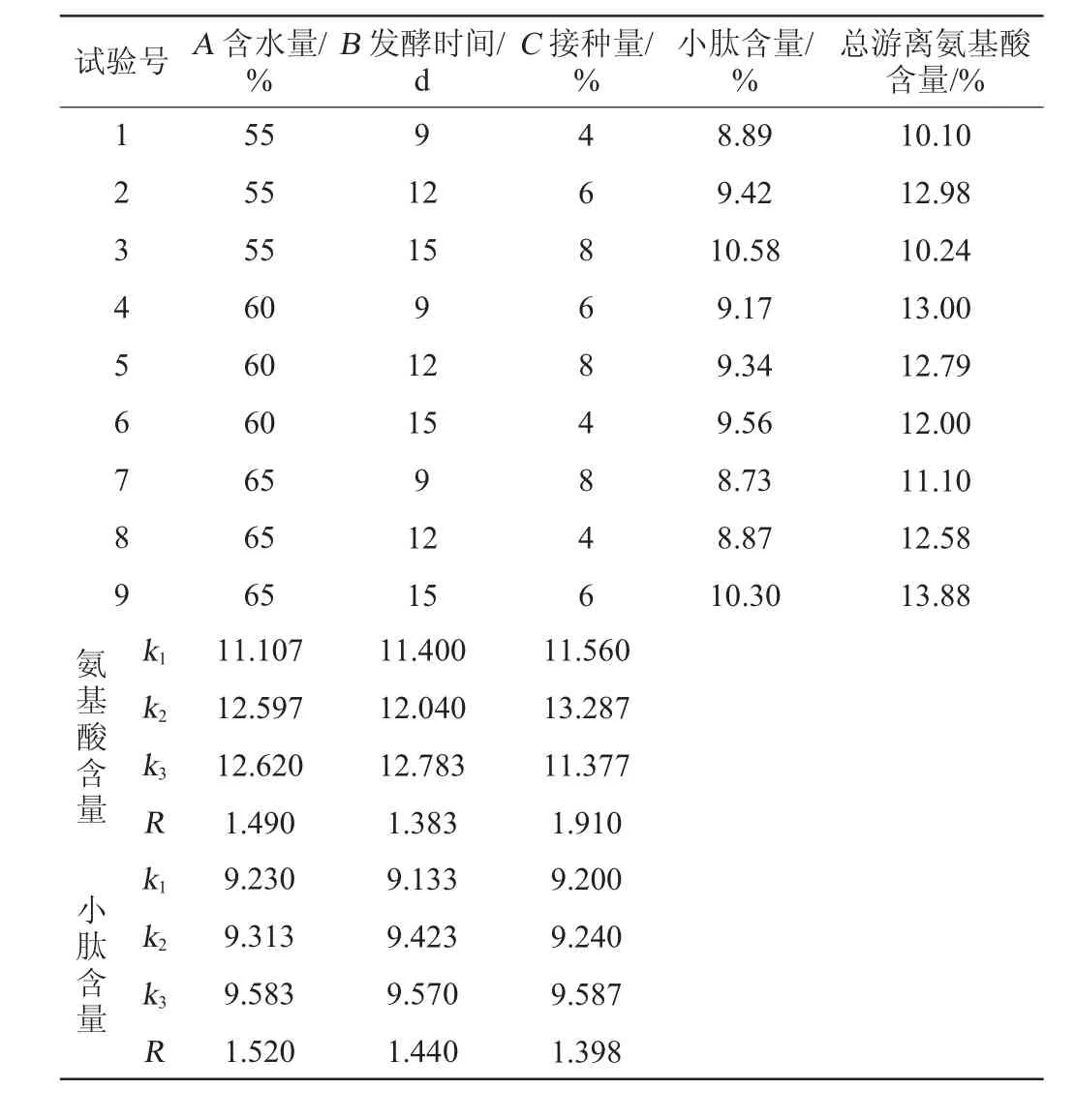
表4 菌株IFJ1固态发酵条件优化L9(33)正交试验结果与分析Table 4 Results and analysis of L9(33)orthogonal experiments for solidstate fermentation conditions optimization of strain IFJ1
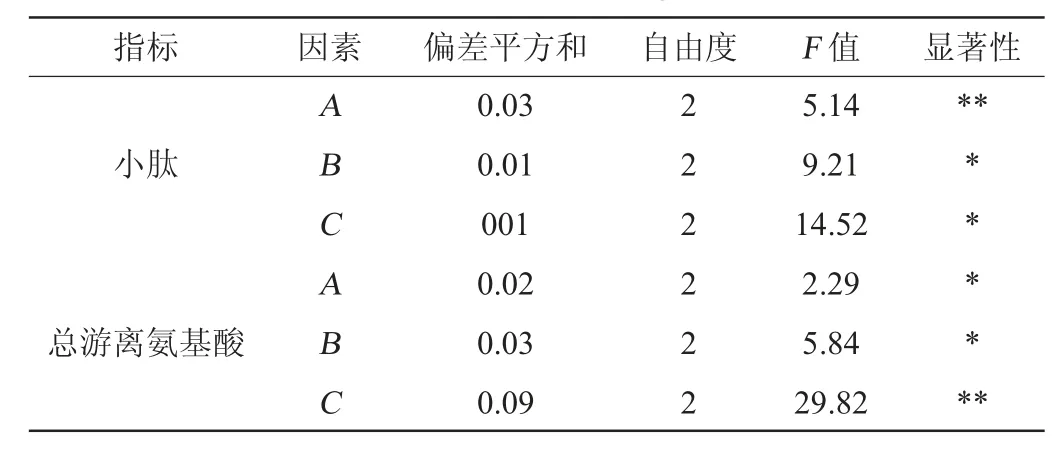
表5 正交试验结果方差分析Table 5 Variance analysis of orthogonal tests results
根据表4中的R值能够发现,影响小肽含量的主要因素次序为A>B>C,对总游离氨基酸含量影响的主要因素次序为C>A>B。考虑到各因素的极差R值,分别确定影响两个指标因素的主次顺序,同时结合水平结果k值确定两个指标下的最适因素组合[19]。发酵产小肽的最适组合为A3B3C3,在此条件下发酵产物小肽含量为10.58%,总氨基酸含量达10.24%;而发酵产总游离氨基酸的最适组合为A3B3C2,在此条件下发酵产物总氨基酸含量高达13.88%,小肽含量也达到10.30%。故综合平衡试验目的与实际情况,选择发酵的最佳组合为A3B3C2,即含水量为65%、发酵时间为15 d、接种量为6%。在最佳试验条件下进行验证试验,发酵产物成品小肽含量平均值为10.57%;总游离氨基酸含量平均值为14.05%。
根据表5中的F值能够发现,A、B、C三个因素对小肽及总游离氨基酸含量的影响都具有显著性,其中含水量对发酵产小肽含量有着极显著影响,接种量对发酵产总游离氨基酸含量有着极显著影响。
3 结论
本试验从皖北豆酱中分离得到一株产氨肽酶能力强的菌株IFJ1,经形态学鉴定、生理生化试验和分子生物学试验鉴定该菌株为乳酸片球菌(Pediococcus acidilactici)。通过单因素和正交试验优化确定IFJ1菌株固态发酵条件:发酵时间为15 d、接种量为6%、含水量为65%,在此优化条件下,菌株IFJ1发酵产物中小肽含量达到10.57%、总游离氨基酸含量可达14.05%。利用乳酸片球菌IFJ1的高产氨肽酶特性进行发酵,不仅为氨肽酶的生产提供了菌种来源,也可以作为优良的氨肽酶产生菌应用于发酵豆制品,以期得到风味品质更好的发酵食品。

